Андрогенний рецептор

Андрогеновий рецептор, або андрогенний рецептор (англ. androgen receptor, AR), або NR3C4 — один з рецепторів стероїдних гормонів, активований андрогенами — тестостероном або дигідротестостероном[6]. Належить до підродини 3, групи З (ген 4) родини ядерних рецепторів, здатних безпосередньо взаємодіяти з ядерною ДНК[7][8]. Андрогеновий рецептор активується при зв'язуванні з андрогенами в цитоплазмі, а потім переноситься в ядро.
Андрогеновий рецептор — фактор транскрипції, який регулює експресію генів[9] шляхом взаємодії з ДНК, а також виконує інші функції, не пов'язані зі взаємодією з ДНК[10]. Гени, регульовані андрогенами за допомогою AR, мають важливе значення для розвитку і підтримки чоловічого фенотипу[11].
У людини андрогеновий рецептор - білок, який кодується геном AR, розташованим на короткому плечі Х-хромосоми в локусі Xq11.2-12[12][13][14]. Довжина поліпептидного ланцюга білка становить 920 амінокислот, а молекулярна маса — 99 188[15].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MEVQLGLGRV | YPRPPSKTYR | GAFQNLFQSV | REVIQNPGPR | HPEAASAAPP | ||||
| GASLLLLQQQ | QQQQQQQQQQ | QQQQQQQQQQ | ETSPRQQQQQ | QGEDGSPQAH | ||||
| RRGPTGYLVL | DEEQQPSQPQ | SALECHPERG | CVPEPGAAVA | ASKGLPQQLP | ||||
| APPDEDDSAA | PSTLSLLGPT | FPGLSSCSAD | LKDILSEAST | MQLLQQQQQE | ||||
| AVSEGSSSGR | AREASGAPTS | SKDNYLGGTS | TISDNAKELC | KAVSVSMGLG | ||||
| VEALEHLSPG | EQLRGDCMYA | PLLGVPPAVR | PTPCAPLAEC | KGSLLDDSAG | ||||
| KSTEDTAEYS | PFKGGYTKGL | EGESLGCSGS | AAAGSSGTLE | LPSTLSLYKS | ||||
| GALDEAAAYQ | SRDYYNFPLA | LAGPPPPPPP | PHPHARIKLE | NPLDYGSAWA | ||||
| AAAAQCRYGD | LASLHGAGAA | GPGSGSPSAA | ASSSWHTLFT | AEEGQLYGPC | ||||
| GGGGGGGGGG | GGGGGGGGGG | GGGEAGAVAP | YGYTRPPQGL | AGQESDFTAP | ||||
| DVWYPGGMVS | RVPYPSPTCV | KSEMGPWMDS | YSGPYGDMRL | ETARDHVLPI | ||||
| DYYFPPQKTC | LICGDEASGC | HYGALTCGSC | KVFFKRAAEG | KQKYLCASRN | ||||
| DCTIDKFRRK | NCPSCRLRKC | YEAGMTLGAR | KLKKLGNLKL | QEEGEASSTT | ||||
| SPTEETTQKL | TVSHIEGYEC | QPIFLNVLEA | IEPGVVCAGH | DNNQPDSFAA | ||||
| LLSSLNELGE | RQLVHVVKWA | KALPGFRNLH | VDDQMAVIQY | SWMGLMVFAM | ||||
| GWRSFTNVNS | RMLYFAPDLV | FNEYRMHKSR | MYSQCVRMRH | LSQEFGWLQI | ||||
| TPQEFLCMKA | LLLFSIIPVD | GLKNQKFFDE | LRMNYIKELD | RIIACKRKNP | ||||
| TSCSRRFYQL | TKLLDSVQPI | ARELHQFTFD | LLIKSHMVSV | DFPEMMAEII | ||||
| SVQVPKILSG | KVKPIYFHTQ |
Кодований геном білок за функціями належить до рецепторів, активаторів, фосфопротеїнів. Задіяний у таких біологічних процесах, як транскрипція, регуляція транскрипції, альтернативний сплайсинг. Білок має сайт для зв'язування з ліпідами, іонами металів, іоном цинку, ДНК, стероїдами. Локалізований у цитоплазмі, ядрі.
1953 року Джон Морріс (англ. John Morris), акушер з Єльського університету, повідомив про 82 індивідууми, які мали жіночий фенотип, попри наявність сім'яників. Проведені після цього ендокринологічні, патофізіологічні, біохімічні і молекулярно-біологічні дослідження дозволили встановити, що такий фенотип обумовлений синдромом нечутливості до андрогенів. Ці дослідження пролили світло на роль андрогенів у визначенні чоловічої статі, механізми дії андрогенів, а також на будову і функціонування андрогенових рецепторів[16].
Ген[ред. | ред. код]

Ген андрогенового рецептора (AR) людини розташовується на довгому плечі Х-хромосоми в локусі Xq11.2-12, причому 5'-кінець гена звернений до центромери. Нуклеотидна послідовність гена містить 90 тисяч пар основ[17] і включає 8 екзонів. Їх структурна організація аналогічна до генів інших рецепторів стероїдних гормонів. Екзон 1 кодує N-кінцевий домен (NTD) білка, екзони 2 і 3 — центральний ДНК-зв'язувальний домен (DBD), а екзони 4-8 — С-кінцевий домен. В різних клітинних лініях виявлено 2 альтернативні форми мРНК AR завдовжки 8,5 і 11 тисяч основ відповідно; вони є результатом альтернативного сплайсингу на 3'-нетрансльованій області. Жодних структурних і функціональних розходжень між продуктами трансляції цих мРНК не виявлено, проте можливо, що наявність у певної тканини тієї чи іншої форми мРНК визначається специфічними тканинними регуляторами. В передміхуровій залозі і фібробластах шкіри, яка покриває статеві органи, переважно експресується довша мРНК[8]. Ген AR містить дві поліморфні ділянки, що складаються з тринуклеотидних повторів, які кодують напівглутамінову і напівгліцинову ділянки N-кінцевого трансактиваційного домену рецептора (докладніше див. розділ #Структура)[17][18].
Будова гена AR консервативна серед ссавців — від гризунів до людини. Ген локалізований в Х-хромосомі і в інших ссавців, таких як сумчасті і однопрохідні, що може показувати зв'язок між AR та іншими синтенічними генами[17].
CAG-повтори[ред. | ред. код]
Перший екзон AR містить кілька ділянок з повторюваними послідовностями. Найбільш примітний з таких повторів починається з кодону 58 і складається з 21 ± 2 повтору триплету CAG, оскільки при синдромі Кеннеді[en] саме в ньому найчастіше відбувається збільшення кількості CAG-повторів[19]. Повтори CAG еволюційно консервативні: у щурів і мишей є короткі ділянки CAG-повторів, які відповідають аналогічній ділянці гену AR людини, яка кодує напівглутамінову ділянку андрогенового рецептора, що починається з позиції 57. Регіон з повторами CAG є і в генах AR приматів, причому його довжина тим менша, чим вид тварин далі відстоїть від людини. Як і в інших генів, які мають ділянки CAG-повторів, довжина цієї ділянки у AR широко варіює через проковзування[en] ДНК-полімерази на матриці, тому загальна кількість реплікованих триплетів CAG може різнитися. Кількість CAG-повторів варіює від 14 до 35 і може бути пов'язана з етнічною та расовою приналежністю. Довжина напівглутамінової ділянки AR, кодованої CAG-повторами, може впливати на активність рецептора і впливати на ризик розвитку раку передміхурової залози[17].
Регуляція експресії[ред. | ред. код]
Транскрипція гену AR залежить від типу клітин, а в деяких тканинах — і від віку. Ба більше, рівень мРНК AR регулюється андрогенами та іншими стероїдними гормонами. Промотор гену AR не має типових ТАТА- і СААТ-боксів. На відміну від більшості генів, позбавлених ТАТА-боксу, 5'-нетрансльована область AR містить GC-збагачені послідовності, які зв'язуються з фактором транскрипції Sp1. Крім Sp1, позитивно експресію AR регулюють такі білки, як CREB і C-myc, а негативно — транскрипційний фактор NF-κB і конститутивно активний фактор NF-1[en][20]. Ген AR може транскрибуватися принаймні з двох різних промоторів, активність яких залежить від типу клітин. Дослідження промотору AR щура показали наявність безлічі сайтів зв'язування з різними коактиваторами транскрипції. AR експресується в найрізноманітніших тканинах, які не мають стосунку до первинних і вторинних статевих органів, а це узгоджується з його багатогранними ефектами. І справді, складно знайти тканину, у якій не експресувалась хоча б невелика кількість AR (виняток становить селезінка). У печінки щура виявлено також залежність рівня експресії AR від віку, що зумовлено зв'язуванням різних транскрипційних чинників зі специфічними послідовностями-мішенями в промоторі AR[17].
У щура промотор AR містить паліндромні послідовності[en] ДНК, які слугують сайтами зв'язування для андрогенового рецептора, глюкокортикоїдного рецептора і прогестеронового рецептора. У зв'язку з цим існує негативний зворотний зв'язок, що регулює транскрипцію AR за допомогою самого AR. Кастрація призводить до збільшення рівня мРНК AR, однак цей ефект усувається при прийомі андрогенів. Експресія AR у пацюка негативно регулюється андрогенами і гонадотропіном фолікулостимулювальним гормоном, причому ця регуляція може бути опосередкована циклічним АМФ, для якого в промоторі AR є елемент відгуку[17].
Еволюційна консервативність[ред. | ред. код]
Консервативність деяких сегментів гену AR у ході еволюції віддзеркалює критичне значення цих сегментів для функціонування молекули рецептора. Найбільш консервативна ділянка — DBD, яка практично незмінна в ланцюгові від шпоркової жаби до людини; крім того, високу консервативність демонструють ліганд-зв'язувальний домен (LBD) і шарнірна (англ. hinge) ділянка. Оскільки AR у різних організмів зв'язуються з дуже близькими за будовою лігандами, то консервативні кодони 12-43 LBD відповідають ліганд-зв'язувальній ділянці. Мутації, які зачіпають LBD, призводять до синдрому нечутливості до андрогенів, що проявляється у широкої низки видів хребетних, від жаб до людини. Крім того, шарнірна ділянка, зокрема, її N-кінцевий домен, також висококонсервативна — від жаб до гризунів. У NTD, кодованих першим екзоном, починаючи з 539-го кодону, не спостерігається практично ніякої консервативності від гризунів до людини. Однак, аналіз послідовностей на ділянках від кодону 1 до 53 і від кодону 360 до 429 показав, що вони кодують ділянку білка, консервативного серед різних організмів. Ці ділянки важливі для димеризаціі AR, і їх консервативність віддзеркалює функціональну схожість AR у всіх приматів[17].
Структура[ред. | ред. код]
Ізоформи[ред. | ред. код]

Дві різні ізоформи андрогенового рецептора — AR-A і AR-B — вперше були описані у людини в фібробластах шкіри статевих органів. AR-A має масу 87 кДа і має вкорочений, у порівнянні з ізоформою AR-B (110 кДа), N-кінцевий домен. У всьому іншому ці ізоформи ідентичні. Передбачають, що трансляція AR-A починається з першого внутрішнього залишку метіоніну (Met-188) на тому ж транскрипті, з якого транслюється повна форма AR-B. Обидві ізоформи експресуються в різних тканин як зародків, так і дорослих людей (і чоловіків, і жінок), однак найбільш рясна експресія спостерігається в репродуктивних тканин. Співвідношення AR-B:AR-A варіює в різних тканинах і по-різному на різних стадіях розвитку. У тім'яній кістці плоду, який розвивається, рівень AR-B відносно низький, тоді як AR-A там не виявлено взагалі. У людських остеобластах виявлено обидві ізоформи. Невідомо, чи можуть ці ізоформи брати участь у різних сигнальних шляхах у людей, але, ймовірно, їхні функції все-таки різняться[21].
В інших хребетних також виявлено кілька ізоформ AR. У гортані гладенької шпоркової жаби описано дві різні ізоформи AR, які різняться N-кінцевим доменом (AR α і AR β). Експресія AR β пов'язана з проліферацією і диференціюванням гортанних м'язів у молодих особин і хрящів у самців, тоді як експресія AR α зберігається впродовж наступних стадій розвитку. Дві різні форми AR (AR1 і AR2) також виявлено в риби Micropogonias undulatus[en]. У цієї риби дві ізоформи AR різняться спорідненістю зв'язування з агоністами, фізичними властивостями та розподілом за тканинами. AR1 експресується переважно в мозку, AR2 — в мозку, яєчниках і сім'яниках. AR2 має високу спорідненість до великого спектру андрогенів, тоді як AR2 може пов'язуватися лише з тестостероном. Ці дані вказують на те, що в X. laevis і M. undulatus дві різні форми андрогенових рецепторів виконують різні функції в тканинах-мішенях[21].
Домени[ред. | ред. код]

Як і інші ядерні рецептори, андрогеновий рецептор складається з С-кінцевого α-спірального глобулярного домену, що відповідає за зв'язування з лігандом і димеризацію, який через шарнірну ділянку пов'язаний з другим α-спіраль глобулярним доменом, що відповідає за специфічне зв'язування з ДНК і димеризацію, і пластичного N-кінцевого домену зі змінною структурою, який у деяких випадках бере участь у регуляції транскрипції[22]. N-кінцевий домен, який містить функціональну ділянку активації 1 (AF-1) між залишками 101-370, необхідний для повної ліганд-активованої транскрипційної активності, функціональну ділянку активації 5 (AF-5) між залишками 360-485, відповідальну за конститутивну активність (активність без зв'язаного ліганду)[23] і поверхню димеризаціі, що включає залишки 1-36 (містять мотив FXXLF, де F — фенілаланін, L — лейцин, а Х — будь-який амінокислотний залишок) і 370-494 (обидві ці поверхні взаємодіють з LBD у внутрішньомолекулярній[24][25][26] взаємодії типу «голова до хвоста»[27][28][29]). Шарнірна ділянка містить ліганд-залежний сигнал ядерної локалізації[30]. Ліганд-зв'язувальний домен (LBD) містить функціональну ділянку активації 2 (AF-2), відповідальну за агоніст-індуковану активність (активність у присутності зв'язаного агоніста). AF-2 зв'язується або внутрішньомолекулярно з N-кінцевим мотивом FXXFL, або з білками-коактиваторами (містять мотиви LXXLL або, ймовірніше, FXXFL)[29]. Крім того, в LBD міститься ліганд-залежний сигнал ядерного експорту[en][31].
N-кінцевий домен[ред. | ред. код]
N-кінцевий домен андрогенового рецептора (NTD) кодується екзоном 1 і містить дві основні функціональні ділянки активації транскрипції та кілька структурних субдоменів. Як і в інших рецепторів стероїдних гормонів, NTD AR від природи не має впорядкованої структури й існує у вигляді безлічі різних конформаційних варіантів. Його структура являє собою розплавлену глобулу[en], яка здатна формувати спіральні ділянки. Серед його 539 амінокислот розташовані дві незалежні функціональні активаційні ділянки: AF-1 (розташована між залишками 103-372), яка необхідна для трансактивації повної форми AR, і AF-5 (розташована між залишками 362-486), яка потрібна для трансактивації конститутивно активного AR, позбавленого ліганд-зв'язувального домену (LBD). Станом на 2017 рік відомо, що AF-5 взаємодіє зі збагаченими глутаміном доменами кофакторів родини р160, наприклад, SRC-1 і TIF2/GRIP1 (докладніше про взаємодіях AR з іншими білками див.)[8].
Іншою функцією NTD AR є його зв'язування з LBD, розташованим на C-кінці (N/C-взаємодія). Для зв'язування з LBD необхідні такі ділянки NTD: перші 36 амінокислот і амінокислоти 372-495. Гормонзалежна взаємодія NTD з LBD може відігравати роль у стабілізації димеру AR і стабілізації комплексу ліганд-рецептор, уповільнюючи швидкість дисоціації ліганду і зменшуючи деградацію рецептора. Агоністи, такі як тестостерон і дигідростерон, але не антагоністи (наприклад, гідроксифлутамід і бікалутамід) індукують N/C-взаємодію в повній формі AR. Методом флуоресцентного резонансного переносу енергії (FRET) показано, що внутрішньомолекулярна N/C-взаємодія починається в цитоплазмі невдовзі після зв'язування з гормоном, а в ядрі, при димеризації рецептора, відбувається ще одна N/C-взаємодія, цього разу міжмолекулярна (між двома молекулами AR). N/C-взаємодія відбувається переважно в рухливих AR, де вона захищає ділянку зв'язування з коактиваторами від непотрібних білок-білкових взаємодій. Після зв'язування з ДНК внутрішньомолекулярний N/C-зв'язок розривається, дозволяючи різним кофакторам зв'язатися з рецептором. Деякі мутації в LBD у пацієнтів з синдромом нечутливості до андрогенів, порушують нормальну взаємодію NTD з LBD, що не дозволяє андрогену зв'язатися з рецептором[8].
NTD — найменш консервативний домен AR; частка збігу амінокислотних залишків між NTD AR людини і щура становить лише 20 %[17].
ДНК-зв'язувальний домен[ред. | ред. код]


ДНК-зв'язувальний домен (DBD) — найбільш консервативний домен AR: подібність між послідовностями амінокислотних залишків DBD людини і щура досягає 100 %. Збіг амінокислотних послідовностей між DBD AR і прогестеронового рецептора досягає 79 %, глюкокортикоїдного рецептора — 76 % і естрогенового — 56 %[17]. Він містить 70 амінокислотних залишків і кодується екзонами 2 і 3. Він характеризується великою часткою основних амінокислот і дев'ятьма консервативними цистеїновими залишками. DBD має компактну глобулярну структуру, в якій добре помітні три субструктури: два цинкових кластери і менш щільне упаковане З-кінцеве видовження (CTE). Обидва цинкових кластери містять по одному атомові цинку, який за допомогою координаційних зв'язків взаємодіє з чотирма залишками цистеїну. Кожен цинковий кластер з С-кінця фланкується α-спіраллю. Два цинкових кластери структурно і функціонально різні й кодуються різними екзонами. α-Спіраль цинкового кластера, найближчого до N-кінця, безпосередньо взаємодіє з особливими послідовностями в ДНК. За специфічне впізнавання цих відповідних елементів у ДНК відповідають три ключові амінокислоти (залишки гліцину, серину і валіну), які в сукупності утворюють так званий Р-бокс (від «proximal» — ближній) (докладніше про взаємодію AR з ДНК див.). Другий цинковий кластер, імовірно, бере участь у білок-білкових взаємодіях (наприклад, димеризації) й називається D-боксом (від «distal» — дальній)[8].
Шарнірна ділянка[ред. | ред. код]
Між ДНК-зв'язувальним доменом і ліганд-зв'язувальним доменом розташовується неконсервативна шарнірна ділянка, розмір якої в різних рецепторів стероїдних гормонів різниться. Вона кодується екзоном 4. Її можна розглядати як гнучкий лінкер між ліганд-зв'язувальним доменом та іншою частиною молекули. Шарнірна ділянка важлива для ядерної локалізації й містить відповідний сигнал. Крім того, з шарнірною ділянкою можуть зв'язуватися деякі корепресори AR. Також AR може ацилюватися за мотивом [KLLKK] у шарнірній ділянці[8].
Ліганд-зв'язувальний домен[ред. | ред. код]

Ліганд-зв'язувальний домен (англ. ligand binding domain, LBD) — другий за консервативністю після DBD домен андрогенового рецептора, кодується екзонами 5-8. Цей домен утворюють близько 250 амінокислотних залишків на С-кінці AR. Визначено просторову структуру AR людини в комплексі з синтетичним агоністом метилтрієнолоном (R1881) і дигідростероном. Його просторове укладання відповідає типовому укладанню ліганд-зв'язувальних доменів ядерних рецепторів, хоча ідентичність амінокислотних послідовностей з деякими іншими рецепторами стероїдних гормонів може становити лише 20 %. LBD цих рецепторів включає 12 α-спіралей (згідно з деякими джерелами, AR спіраль 2 погано помітна). Зв'язувальна кишеня включає 18 амінокислотних залишків, які більш або менш безпосередньо взаємодіють з лігандом. Залишки глутаміну 711, метіоніну 745, аргініну 752 зв'язуються з циклом A стероїдного ліганду, а лейцин 704 і аспарагін 705 зв'язуються з його З-кільцем. У зв'язку з цим зі зв'язаним лігандом переважно контактують спіралі 4, 5 і 10. Зв'язувальна кишеня має деяку гнучкість і може зв'язуватися з лігандами, які мають різні структури. При зв'язуванні ліганда спіраль 12 закриває собою кишеню і «закриває» ліганд всередині. При зв'язуванні рецептора з антагоністом спіраль 12 відводиться назад, де вона перешкоджає зв'язуванню коактиваторів у спеціальній борозенці, що формується на LBD після зв'язування з гормоном. В AR після зв'язування з лігандом відбувається не лише закривання зв'язувальної кишені спіраллю 12, але й закриття борозенки, яка забезпечує зв'язування LBD з NTD. З цією борозенкою можуть зв'язуватися деякі коактиваторы, але основна частина коактиваторів зв'язується з AR в області NTD[8][17].
У LBD розташована ще функціональна активаційна ділянка, AF-2. Її робота в LBD строго залежить від присутності коактиваторів ядерних рецепторів. В експериментах in vivo показано наявність сприятливої функціональної ліганд-залежної взаємодії між AF-2 і NTD[8] (AF-2 взаємодіє з мотивом FXXFL в NTD). AF-2 також може взаємодіяти з білками-коактиваторами, що містять мотиви LXXLL або, краще, FXXFL[29].
На поверхні LBD виявлено особливу регуляторну щілину, названу BF-3. Вона включає залишки Ile-673, Phe-674, Pro-724, Gly-725, Asn-728, Phe-827, Glu-830, Asn-834, Glu-838 і Arg-841. При зв'язуванні з BF-3 гормону щитоподібної залози трийодтироніну (Т3) і деяких нестероїдних протизапальних препаратів транскрипційна активність AR і його здатність зв'язуватися з коактиваторами зменшувалася; причини цього явища станом на 2017 рік не зрозумілі. Крім того, деякі мутації, що зачіпають BF-3, призводять або до синдрому нечутливості до андрогенів (мутації втрати функції), або до раку передміхурової залози (мутації, які змінюють функції). Мутаційний аналіз показав необхідність деяких з цих амінокислот для трансактивації AR. Однак це встановлено лише в присутності дигідростерону[8].
Молекулярні основи функціонування[ред. | ред. код]
Геномна дія[ред. | ред. код]

Сигнальний шлях андрогенового рецептора включає в себе такі етапи. Після проникнення тестостерону в клітину-мішень він зв'язується з андрогеновим рецептором або безпосередньо, або після перетворення на більш метаболічно активну форму — 5α-дигідростерон (DHT) — під дією ферменту 5-альфа-редуктази[35]. DHT утворює стабільніший комплекс з AR, і дія комплексу AR-DHT в 3-10 разів сильніша, ніж комплексу AR-тестостерон. Зв'язування ліганду з рецептором у цитоплазмі викликає дисоціацію комплексів шаперонів (зокрема білків теплового шоку, а саме Hsp70, Hsp90 і p23), які в стані спокою перебувають у зв'язаному з AR стані і захищають його від деградації. Одночасно в рецепторі відбуваються конформаційні зміни і фосфорилювання, внаслідок яких він транслоцюється в ядро. В ході цих перетворень утворюється сайт зв'язування з коактиваторами (AF-2-сайт)[8][36], а домен LBD перебудовується з тришарової структури, яка нагадує сендвіч з α-спіралей, на компактнішу структуру шляхом переміщення З-кінцевої спіралі (спіраль 12) на корову частину білка[20].
У ядрі, комплекс рецептора з лігандом, зв'язується з послідовностями-мішенями ДНК (елементами відгуку на андрогени, ARE), які розташовуються в промоторах генів-мішеней. Структура ARE різниться в різних генів, завдяки чому AR може виконувати безліч регуляторних функцій у межах одного ядра. Посиленню та більшій специфічності взаємодії AR з ДНК сприяє наявність декількох ARE (насправді, одиничний ARE зазвичай забезпечує лише малу активність). Більш того, специфічності відповіді промотору на зв'язування з AR і посиленню взаємодії сприяє наявність двох основних класів ARE. Послідовності ARE першого класу мають вигляд RGAACA-NGN-TGTNCT (AR зв'язується з підкресленими залишками гуаніну); другого — RGGACA-NNA-AGCCAA (це зв'язування забезпечує кооперацію двох сусідніх пов'язаних з ДНК рецепторів і посилює специфічність)[17]. Крім того, ARE зазвичай є складними елементами і поруч з послідовностями зв'язування з AR містять послідовності для взаємодії з іншими транскрипційними факторами[37], серед яких транскрипційні фактори «домашнього господарства» (Sp1, CCAAT і NF-1), індуцибельні (NF-kB, Ets[en] і AP-1[en]) і тканиноспецифічні транскрипційні фактори. Таким чином, AR регулює експресію генів ще й за рахунок взаємодії з різними транскрипційними факторами[20].
Зв'язування з ДНК забезпечує мотив з двох цинкових пальців у домені DBD (амінокислотні залишки 550-624). Ключову роль у цьому процесі відіграють дві α-спіралі, розташовані перпендикулярно одна до одної. N-кінцева спіраль відіграє роль елемента, який розпізнає, причому для цього найважливіші такі її залишки, як гліцин 568, серин 569 і валін 572, що разом утворюють так званий Р-бокс. Наявність Р-боксу характерна і для низки інших рецепторів стероїдних гормонів, а саме глюкокортикоїдного, мінералокортикоїдного і прогестеронового рецепторів. Окрім Р-боксу, для зв'язування AR із ДНК також важливі 12 амінокислотних залишків, розташованих в С-кінцевій спіралі всередині кору AR[20].
При зв'язуванні з ДНК андрогеновий рецептор димеризується з другою молекулою AR, утворюючи антипаралельний димер[38]. У той час як для деяких рецепторів стероїдних гормонів показано утворення гомодимерів у розчині і кристалічному вигляді, AR не може утворювати димер in vitro[17]. Утворений гомодимер рекрутує додаткові білки (РНК-полімеразу II, інші компоненти транскрипційного апарату — TBP, TAF[en], інші загальні фактори транскрипції (GTF) та інші ДНК-зв'язувальні білки, наприклад, сиворотковий фактор відгуку[39]) шляхом специфічної взаємодії структурних мотивів. Це зрештою призводить до активації або супресії генів-мішеней андрогенів[8][36].
Станом на 2017 рік описано 146 генів-мішеней андрогенового рецептора, серед яких гени, що кодують білки, які беруть участь у згортанні білків, клітинному метаболізмі, секреції, управлінні цитоскелетом і внутрішньоклітинній передачі сигналу. Наприклад, AR позитивно регулює експресію простатичного специфічного антигену (PSA), пробазину, фактору росту кератиноцитів[en] (KGF), інгібітору апоптозу р21, циклін-залежних кіназ 2 і 4, рецептора інсуліноподібного фактору росту 1[40]. AR проявляє негативну регуляцію експресії інгібітору клітинного циклу р16[en], результатом чого стає посилена проліферація клітин[41], а також генів-супресорів пухлин, що кодують білки серпін і маспін[20].
Хоча в деяких дослідженнях AR показано, що його зв'язування з лігандом відбувається в цитоплазмі, ймовірно, що ендогенний AR насправді накопичується в ядрі. Внутрішньоклітинна локалізація AR може також залежати від типу клітин. Перебування AR у ядрі значною мірою залежить від шарнірної ділянки, причому делеції, що зачіпають цю ділянку, значно знижують ліганд-індуковане переміщення AR у ядро, хоча й не повністю блокують передачу сигналу[8].
Під корегуляторами андрогенового рецептора розуміються білки, які можуть посилювати або пригнічувати дію AR на транскрипцію. Ідентифіковано понад 170 корегуляторів AR, серед яких і активатори, і репресори. Деякі коактиватори, такі як c-jun або коактиватор рецепторів стероїдів-2 (SRC-2), зв'язуються з N-кінцевим доменом андрогенового рецептора і сприяють його димеризаціі. Цікаво, що надекспресія або ампліфікація гену SRC-2 спостерігається в 11 % випадків раку передміхурової залози. (Докладніше про взаємодії AR з іншими білками див.)
Андрогеновий рецептор може брати участь у епігенетичних процесах. Наприклад, AR може змінювати специфічність LSD1 — ферменту, який у незв'язаному з AR вигляді видаляє метильні групи з Н3К4 (залишок лізину 4 в гістоні H3[en]) та з допомогою цього здійснює репресію транскрипції гену-мішені. Однак при зв'язуванні з AR LSD1 змінює свою специфічність: комплекс LSD1-AR деметилює Н3К9 замість Н3К4 і таким чином активує, а не пригнічує транскрипцію. Крім того, AR може залучати до промоторів генів-мішеней деметилазу[en] JHDM2A, яка деметилює Н3К9 і активує транскрипцію[42].
Негеномна дія[ред. | ред. код]
Функція андрогенового рецептора не обмежується зв'язуванням зі специфічними послідовностями ДНК в ядрі. Зокрема, він може швидко і незалежно від статі впливати на сигнальний шлях Src/RAF1/Erk-2. Показано, що андрогеновий рецептор бере участь в опосередкованому андрогенами дозріванні ооцитів у шпоркової жаби через сигнальний шлях МАРК незалежно від транскрипції[8]. І AR, і естрогеновий рецептор можуть зв'язуватися з гомологічними або гетерологічними лігандами в цитоплазмі і демонструють інгібувальну дію на клітинну смерть. Однак ці ефекти відносно слабко виражені в порівнянні зі значним ефектом на клітинний ріст, виживання і диференціацію, які справляє ліганд-зв'язувальний комплекс у ядрі[17].
Функції[ред. | ред. код]
У деяких типах клітин тестостерон взаємодіє безпосередньо з андрогеновими рецепторами, тоді як в інших тестостерон спочатку перетворюється ферментом 5-альфа-редуктазою на дигідротестостерон, ще більш потужний агоніст андрогенового рецептора[35]. Тестостерон, ймовірно, є основним активувальним гормоном андрогенового рецептора у вольфовому каналі, тоді як дигідротестостерон є основним андрогеновим гормоном у сечостатевому синусі[en], сечостатевому горбку і волосяних фолікулах[43]. Таким чином, тестостерон відповідає, насамперед, за розвиток чоловічих первинних статевих ознак, тоді як дигідротестостерон — за розвиток вторинних. Крім того, встановлено, що поліморфізм у гені AR може бути пов'язаний з віковим облисінням у чоловіків[44].
Андрогени сповільнюють дозрівання кісток, але ще більш виражений уповільнювальний ефект на кістки справляє естроген, який утворюється при ароматизації андрогенів. У людей, які вживають стероїди в підлітковому віці, можливе уповільнення росту від надлишку андрогенів і/або естрогену. Індивіди з дуже низьким рівнем статевих гормонів можуть мати невеликий зріст під час статевого дозрівання, але в міру дорослішання їх зріст збільшується до нормального, як у випадку синдрому Морріса або синдрому нечуттєвості до естрогенів[en][45].
Крім того, дослідження на мишах, яким видалили ген AR (нокаутні миші), показали, що AR має важливе значення для нормальної жіночої фертильності, оскільки він необхідний для розвитку і повноцінного функціонування фолікулів яєчника і овуляції, діючи як через внутрішньояєчниковий, так і нейроендокринний механізми[46].
Діючи через андрогенові рецептори, андрогени відіграють ключову роль у підтримці цілісності чоловічого скелета. Регулювання цієї цілісності через сигнальні шляхи андрогенових рецепторів (AR) може стосуватися як остеобластів, так і остеоцитів[47]. Андрогени важливі для регуляції активності і чутливості до статевих гормонів, підтримання маси тіла і визначення статури в обох статей[48].
Андрогени впливають на клітини судинного ендотелію та гладких м'язів судин, а також на процес ангіогенезу. Встановлено, що дигідростерон, зв'язуючись з клітинами ендотелію, індукує експресію в них білку судинної клітинної адгезії-1 (VCAM1), що посилювало зв'язування моноцитів з ендотелієм. Крім того, тестостерон швидко посилює утворення оксиду азоту (NO) у клітинах ендотелію аорти у людини[49].
Регуляція[ред. | ред. код]
Для здійснення регуляції транскрипції необхідно, по-перше, шляхом ремоделювання хроматину зробити доступними для зв'язування регуляторні елементи у промоторах, і, по-друге, залучити основний апарат транскрипції до промоторів для посилення ініціації та/або елонгації транскрипції. Потенційно андрогеновий рецептор може регулювати обидва цих процеси, приводячи до підвищення вмісту мРНК гену-мішені. Продемонстровано доказ гормон-залежного ремоделювання хроматину в промоторі вірусу пухлини молочної залози миші (MMTV[en]), який запускається AR. Надалі показано, що для AR-залежної зміни топології ДНК і активації генів необхідні BRG-1 та аденозинтрифосфатазна субодиниця комплексу ремоделювання хроматину SWI/SNF[en]. Передбачають, що SWI/SNF рекрутується не безпосередньо, а за допомогою коактиваторів SRC і CREBBP (CBP), причому наявність у останнього білку гістонацетилтрансферазної активності важлива для рецептор-залежної активації та стабілізації SWI/SNF. Втім, при роботі AR можуть ацилюватися не лише гістони, але й сам AR за допомогою коактиваторних білків EP300 і p300/CBP-асоційованого фактору (PCAF), а також Tip60. Тому ацетилювання може і безпосередньо активувати AR, і «відкриваючи» хроматин у генах-мішенях[20].
Іншими посттрансляційними модифікаціями (крім ацетилювання), яких може зазнати AR, є фосфорилювання, метилювання, убіквітинування та сумоїлювання. Всі ці реакції зворотні, тому можливі також дефосфорилювання, деметилювання, деубіквітинування і десумоїлювання. Близько 23 сайтів AR можуть безпосередньо зазнавати тієї чи іншої модифікації. Метилювання AR може здійснювати гістонметилтрансфераза SET9; убіквітинування — RNF6. І метилювання, і убіквітинування, і сумоїлювання відбуваються за залишками лізину. Цікаво, що більшість сайтів фосфорилювання лежать в межах регіону AR-NTD і AF-1; це підтверджує, що ці модифікації безпосередньо модулюють рецептор-залежну трансактивацію. Можливі механізми, що лежать в основі цього — зміна білок-білкових взаємодій і/або зміни в структурі та стабільності білку[20]. AR може фосфорилюватися за залишками серину, треоніну і тирозину, і це можуть здійснювати такі білки, як циклін-залежна кіназа 9 (CDK9), МАРК, TFIIH (за залишками серину); Ack1 (за залишками тирозину); кіназа Aurora A (за залишками треоніну)[8].

Функціонування AR може пригнічуватися:
- кошапероном BAG1[50];
- фактором визначення клітинної долі DACH1[51];
- DAXX[52];
- DJBP, який рекрутує гістондеацетилазу[53];
- кіназою глікогенсинтази 3-β;
- гістондеацетилазою 1 (HDAC1), яка деацетилює гістони й заважає роботі AR[54];
- SRY[55].
З ліганд-зв'язувальним доменом AR і його N-кінцем може зв'язуватися бета-катенін[56]. Гелсолін, ще один корегулятор AR, взаємодіє з DBD і LBD рецептора[57]. Білок антигену меланоми MAGEA11 регулює функціонування AR, змінюючи взаємодію його доменів[58].
Встановлено, що AR може регулювати ініціацію транскрипції генів-мішеней шляхом взаємодії з одним із загальних факторів транскрипції — TFIIF[en]. Крім того, AR може взаємодіяти з іншим фактором транскрипції — P-TEFb[en]. Сайти зв'язування з цими білками розташовані в межах регіону AF1. Цей самий домен містить сайти зв'язування андрогенового рецептора з такими білками, як родина коактиваторів p160, регулятор клітинного циклу Циклін E1, фактори транскрипції SMAD3 та STAT3, новий коактиватор ART-27 і корепресор SMRT[20].
З регіоном AR-NTD також пов'язується безліч різних білків. Серед них:
- компоненти загального транскрипційного апарату: TFIIF, TFIIH[en], P-TEFb;
- коактиватори: ARA160, ART27, CREBBP, родина коактиваторів р160, AES;
- корепресори: SMRT, SMAD3;
- фактори транскрипції: STAT3, ANT-1;
- корегуляторні білки: ARNIP, BRCA1, кавеолін-1, циклін D1, циклін Е[en], pRb[20].
Підбиваючи підсумок, можна сказати, що AR-залежна регуляція генів складається зі спільної дії з іншими факторами транскрипції (зокрема тканиноспецифічними) і численних взаємодій з транскрипційним апаратом[20].
Агоністи, антагоністи і модулятори[ред. | ред. код]
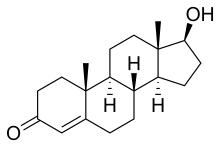
Ендогенними агоністами AR є тестостерон і дигідростерон, причому дигідростерон значно ефективніший, ніж тестостерон. Відомі й синтетичні агоністи AR, наприклад, метилтрієнолон[en][8] і похідне тестостерону андріол[59]. Агоністи AR можуть застосовуватися як анаболічні засоби[60], в андрогензамісній терапії[en] для лікування чоловічого гіпогонадизму і, можливо, їх можна застосовувати як чоловічі контрацептиви[59]. Нещодавні дослідження показали, що зв'язування агоністів (як і деяких антагоністів) може змінювати послідовність ДНК, яку розпізнає комплекс AR-ліганд, що може бути корисним при лікуванні, наприклад, раку передміхурової залози[61].

Антагоністи андрогенових рецепторів часто використовуються при лікуванні захворювань, викликаних надлишком андрогенів, наприклад, раку передміхурової залози. Сполуки, які є повними або частковими антагоністами андрогенових рецепторів, називають антиандрогенами[en]. Повними антагоністами AR є, наприклад, нестероїдні сполуки гідроксифлутамід[en], нілутамід[en] і бікалутамід. Деякі сполуки стероїдної природи, наприклад, ципротеронацетат і міфепристон, мають як антагоністичну, так і агоністичну дію на AR[8]. Прогестини у високих дозах можуть блокувати андрогенові рецептори[62][63], оскільки андрогеновий рецептор найбільш споріднений з рецепторами прогестерону.
Селективні модулятори андрогенових рецепторів[en] (SARM) впливають як на геномну, так і на негеномну дію андрогенів за рахунок взаємодії з ними в цитоплазмі. Розробка таких сполук, які модулюють біологічну активність AR тканеспецифічним чином, розпочалася 1999 року[8]. Станом на 2017 рік ведуться клінічні випробування препаратів групи SARM енобосарму[64], що діє переважно на кістки і м'язи, і LGD-4033[en][65].
Зв'язування AR з антагоністами, агоністами та іншими модуляторами викликає в ньому конформаційні зміни, внаслідок яких набір корегуляторів (коактиваторів і корепресорів), з якими може взаємодіяти AR, змінюється. Таким чином, тканинна специфічність та селективність дії того чи іншого модулятора пояснюється унікальним корегулятором, з яким може взаємодіяти рецептор після зв'язування з модулятором, а силу кінцевої відповіді визначають рівні певних коактиваторів і корепресорів[8].
Роль у патогенезі[ред. | ред. код]
Синдром нечутливості до андрогенів[ред. | ред. код]

Різноманітні мутації (зазвичай, міссенс-мутації[17]) андрогенового рецептора, що роблять неможливою внутрішньоклітинну передачу сигналу через AR при зв'язуванні з тестостероном, призводять до розвитку стану, відомого як синдром нечутливості до андрогенів (AIS). У плодів з AIS в ході ембріонального розвитку клітини Лейдіга виробляють нормальну кількість тестостерону, однак похідні вольфового каналу, які дають початок елементам чоловічої статевої системи, залишаються недорозвиненими. Мюллерів канал руйнуються під дією антимюлерівського гормону, що виділяється клітинами Сертолі. Сім'яники розташовані в черевній або паховій області і в постпубертантний період характеризуються недорозвинутими клітинами Лейдіга і сім'яними канальцями[en] з незрілими клітинами Сертолі і примітивними гоноцитами, розвиток яких не йде далі стадії сперматогоніїв. У деяких випадках у пацієнтів з повністю вираженим AIS зовнішні геніталії при народженні відповідають жіночому фенотипові і представлені вагінальною кишенею, яка закінчується сліпо, а у підлітковий період починається розвиток молочних залоз. В інших випадках, коли AIS виражений не повною мірою, геніталії з гіпоспадією не відповідають ні чисто чоловічому, ні жіночому фенотипові. Нарешті, у випадку помірно вираженого AIS хворі характеризуються відносно нормальним чоловічим фенотипом і безпліддям або атрофією м'язів у дорослому віці, зумовленої синдромом Кеннеді[en]. У ранньому дитинстві і постпубертатному періоді в плазмі крові хворих AIS фіксується рівень тестостерону, який відповідає або злегка перевищує нормальний вміст цього гормону у чоловіків, а також підвищений рівень лютеїнізуючого гормону. Однак в умовах повної або часткової нечутливості до тестостерону починають переважати ефекти естрогену, який утворюється при ароматизації тестостерону[66].
Синдром Кеннеді[ред. | ред. код]
Синдром Кеннеді, також відомий як спинобульбарна (тобто пов'язана зі спинним і довгастим мозком) м'язова атрофія, розвивається у тих випадках, коли кількість CAG-повторів у AR збільшується до 40-62 повторів. У пацієнтів з синдромом Кеннеді розвиваються прогресуючі неврологічні порушення, обумовлені дегенерацією спинномозкових мотонейронів і подальшим ослабленням м'язів; зазвичай хвороба проявляється у 40-60 років. Неврологічні прояви синдрому Кеннеді пояснюються тим, що білки, які містять надмірно довгі поліглутамінові ділянки, індукують апоптоз у нейронах, що характерно для багатьох нейродегенеративних захворювань. Цікаво, що синдром Кеннеді нерідко супроводжується нечутливістю до андрогенів, оскільки AR із занадто довгою поліглутаміновою ділянкою не може нормально функціонувати[17].
Серцево-судинні захворювання[ред. | ред. код]
Є численні дані про зв'язок андрогенового рецептора і серцево-судинних захворювань. Згідно з епідеміологічними і клінічними даними, андрогени виступають як незалежні фактори, що обумовлюють вищу чутливість до атеросклерозу в чоловіків через несприятливий вплив на ліпіди, кров'яний тиск і метаболізм глюкози. Існують докази того, що андрогени задіяні в передчасному розвитку коронарної недостатності у спортсменів. Водночас брак андрогенів, особливо тестостерону, зумовлений старінням у чоловіків або двобічною оофоректомією в жінок, пов'язаний з появою гіпертензії, діабету, атеросклерозу, причому замісна тестостеронова терапія виявилася ефективною щодо таких хворих. У нормальних фізіологічних концентраціях тестостерон може справляти сприятливу дію на систему кровообігу, посилюючи антикоагулювальну активність, і може проявляти антитромбічні ефекти. Більш того, короткочасне застосування тестостерону в чоловіків, які страждають на коронарну недостатність, зменшувало міокардіальну ішемію і покращувало ендотеліальні вазомоторні функції. Втім, дані про участь андрогенів у захисті від атеросклерозу залишаються суперечливими[49].
Рак[ред. | ред. код]
Рак передміхурової залози[ред. | ред. код]

Для розвитку і цілісного функціонування передміхурова залоза потребує андрогенів. Вроджена дисфункція андрогенового рецептора або 5-альфа-редуктази у чоловіків призводить або до повної відсутності, або лише до мінімального розвитку передміхурової залози. Те ж саме стосується і самців інших тварин. Через тиждень після кастрації передміхурова залоза самця щура зазнає дегенерації через апоптоз епітеліальних клітин (після видалення сім'яників рівень андрогенів недостатній для підтримки цілісності простати). Андрогени також належать до чинників, що стимулюють розвиток раку передміхурової залози. Вивчення євнухоїдних індивідуумів показало, що у них простата залишається маленькою і не зазнає гіпертрофії або злоякісного переродження. Більш того, в тваринних моделях канцерогенезу в передміхуровій залозі необхідна наявність насінників або екзогенних андрогенів для підтримки розвитку пухлини. У трансгенних мишей з підвищеною експресією AR у простаті клітини епітелію простати оновлюються набагато швидше, ніж у нормі, і простатична інтраепітеліальна неоплазія (злоякісна пухлина) у таких мишей з'являється значно раніше. Хоча необхідність андрогенів для розвитку раку простати не викликає сумнівів, але складно встановити зв'язок між відносним рівнем андрогенів у крові і ризиком розвитку раку простати. Для пояснення відмінностей у частоті виникнення та ступеня вираженості раку простати запропоновано расові відмінності у рівні андрогенів, які циркулюють у крові. Втім, дані щодо зв'язку між рівнем андрогенів у крові і ризиком розвитку раку передміхурової залози дуже суперечливі, і остаточного рішення з цього питання немає. Можливо, суперечливість даних пояснюється різною активністю андрогенових рецепторів, яка може відігравати винятково важливу роль у розвитку раку простати[17].
Показано, що генетичне різноманіття в локусі AR пов'язане з ризиком раку простати. Зокрема, встановлено, що кількість повторів в області CAG-повторів зворотно пов'язана з активністю AR. Прояв цього на клітинному рівні тканиноспецифічний, оскільки поліглутамінова ділянка в N-кінцевому домені впливає на взаємодію рецептора з p160 та іншими коактиваторами. У різних дослідженнях показано, що чим коротша ділянка CAG-повторів у N-кінцевому домені AR, тим агресивніша пухлина, раніший початок розвитку раку і вища ймовірність рецидиву. Втім, в інших дослідженнях отримано інші дані. З ризиком раку простати пов'язують й інші зміни в AR, наприклад, у 5'-нетрансльованій області, але пояснення цим зв'язкам станом на 2017 рік ще немає. На відміну від синдрому нечутливості до андрогенів, для якого визначено багато мутацій, які його викликають, мутацій, що обумовлюють схильність до раку простати, небагато. Втім, одну таку успадковувану мутацію (міссенс-мутацію) виявлено у Фінляндії[17].
У клітинах раку простати ген AR іноді зазнає різних змін. Встановлено, що клітини раку простати, як і клітини епітелію простати, від яких вони походять, зберігають необхідність у андрогенах, і в умовах нестачі андрогенів гинуть. Справді, у 80 % випадках клітини раку простати реагують на відсутність андрогенів. Однак в умовах терапії, спрямованої на зниження рівня андрогенів (наприклад, внаслідок кастрації), ген AR цих клітин може зазнати змін. Так, у 25-30 % пацієнтів, які зазнали такого лікування, ген AR зазнає ампліфікації, що збільшує кількість андрогенових рецепторів у пухлинних клітинах і допомагає їм виживати в умовах низького рівня андрогенів. В інших випадках зміни призводять до підвищення чутливості рецептора до ендогенних агоністів, дозволяють йому розпізнавати ширший спектр агоністів або зменшують його чутливість до антиандрогенів[17].
Інші ракові захворювання[ред. | ред. код]
До 1970-х років рак молочної залози з певним успіхом лікували андрогенами (тестостероном, дигідростероном, флуоксиместероном[en]). Однак згодом виявилося, що у жінок, які страждають на рак молочної залози, спостерігається підвищений рівень андрогенів у крові. Справді, групу ризику для раку грудей становлять жінки в пре - і постменопаузний період з підвищеним вмістом естрогену, тестостерону та надниркових андрогенів у крові. Вивчення тваринних моделей показало, що комбінований вплив естрогену і тестостерону індукував проліферацію клітин молочної залози, надекспресію андрогенового рецептора і активацію генів-мішеней естрогенів, причому всі ці ефекти усувалися терапією з застосуванням антиандрогенів. Однак розробка антиандрогенів, специфічних до раку молочної залози, перебуває на зародковому рівні, хоча про наявність андрогенових рецепторів у цій тканині відомо вже майже 50 років[36].
Ймовірно, що андрогенові рецептори задіяні у розвитку карциноми слинних залоз[en][67]. Крім того, висунуто припущення, що андрогени (зокрема, дигідростерон) беруть участь у розвитку раку яєчників[68].
Примітки[ред. | ред. код]
- ↑ Захворювання, генетично пов'язані з AR переглянути/редагувати посилання на ВікіДаних.
- ↑ Сполуки, які фізично взаємодіють з Androgen receptor переглянути/редагувати посилання на ВікіДаних.
- ↑ Сполуки, які фізично взаємодіють з андрогенний рецептор переглянути/редагувати посилання на ВікіДаних.
- ↑ Human PubMed Reference:.
- ↑ Mouse PubMed Reference:.
- ↑ PMID 9949684 (PMID 9949684)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 17132855 (PMID 17132855)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в г д е ж и к л м н п р с т у ф PMID 25905257 (PMID 25905257)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 3549275 (PMID 3549275)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12351684 (PMID 12351684)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 10664515 (PMID 10664515)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 3353726 (PMID 3353726)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 3377788 (PMID 3377788)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ HUGO Gene Nomenclature Commitee, HGNC:644 (англ.) . Архів оригіналу за 23 жовтня 2017. Процитовано 12 вересня 2017.
- ↑ UniProt, P10275 (англ.) . Архів оригіналу за 30 серпня 2017. Процитовано 12 вересня 2017.
- ↑ а б PMID 7671849 (PMID 7671849)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в г д е ж и к л м н п р с т у ф PMID 12089231 (PMID 12089231)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ NCBI: AR androgen receptor [ Homo sapiens (human) ]. Архів оригіналу за 4 жовтня 2016. Процитовано 22 жовтня 2017.
- ↑ PMID 2062380 (PMID 2062380)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в г д е ж и к л м PMID 15163303 (PMID 15163303)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 14643880 (PMID 14643880)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 19117136 (PMID 19117136)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 7706276 (PMID 7706276)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 15994236 (PMID 15994236)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 17189428 (PMID 17189428)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 17420290 (PMID 17420290)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 8530400 (PMID 8530400)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 9717843 (PMID 9717843)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в PMID 15178743 (PMID 15178743)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 18420738 (PMID 18420738)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12923188 (PMID 12923188)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 15705293 (PMID 15705293)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 9845666 (PMID 9845666)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12700055 (PMID 12700055)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 16633980 (PMID 16633980)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в PMID 25722318 (PMID 25722318)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 17699749 (PMID 17699749)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 10077001 (PMID 10077001)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 15623502 (PMID 15623502)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 15753383 (PMID 15753383)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 25921704 (PMID 25921704)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Эпигенетика / под ред. С. Д. Эллиса, Т. Дженювейна, Д. Рейнберга. — М. : Техносфера, 2013. — С. 200. — ISBN 978-5-94836-257-1.
- ↑ PMID 12834017 (PMID 12834017)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 11231320 (PMID 11231320)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12868122 (PMID 12868122)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 20231167 (PMID 20231167)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 22836391 (PMID 22836391)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 25925349 (PMID 25925349)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 25563353 (PMID 25563353)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 14517289 (PMID 14517289)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 19351840 (PMID 19351840)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 15572661 (PMID 15572661)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12612053 (PMID 12612053)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 11994312 (PMID 11994312)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 11585838 (PMID 11585838)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 11792709 (PMID 11792709)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12941811 (PMID 12941811)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 15684378 (PMID 15684378)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 14579074 (PMID 14579074)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 5955468 (PMID 5955468)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 25535248 (PMID 25535248)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6371845 (PMID 6371845)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12600226 (PMID 12600226)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 22031847 (PMID 22031847)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 22459616 (PMID 22459616)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 8537246 (PMID 8537246)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 25871467 (PMID 25871467)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 26091707 (PMID 26091707)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.
Література[ред. | ред. код]
- Chang C., Kokontis J., Liao S. (1988). Structural analysis of complementary DNA and amino acid sequences of human and rat androgen receptors. Proc. Natl. Acad. Sci. U.S.A. 85: 7211—7215. PMID 3174628 DOI:10.1073/pnas.85.19.7211
- Tilley W.D., Marcelli M., Wilson J.D., McPhaul M.J. (1989). Characterization and expression of a cDNA encoding the human androgen receptor. Proc. Natl. Acad. Sci. U.S.A. 86: 327—331. PMID 2911578 DOI:10.1073/pnas.86.1.327
- Govindan M.V. (1990). Specific region in hormone binding domain is essential for hormone binding and trans-activation by human androgen receptor. Mol. Endocrinol. 4: 417—427. PMID 2342476 DOI:10.1210/mend-4-3-417
- Ahrens-Fath I., Politz O., Geserick C., Haendler B. (2005). Androgen receptor function is modulated by the tissue-specific AR45 variant. FEBS J. 272: 74—84. PMID 15634333 DOI:10.1111/j.1432-1033.2004.04395.x
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC). Genome Res. 14: 2121—2127. 2004. PMID 15489334 DOI:10.1101/gr.2596504
- Chang C., Kokontis J., Liao S. (1988). Molecular cloning of human and rat complementary DNA encoding androgen receptors. Science. 240: 324—326. PMID 3353726 DOI:10.1126/science.3353726
- PMID 25905231 (PMID 25905231)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.
Посилання[ред. | ред. код]
- База даних відомих мутацій андрогенового рецептора (2013 рік) (PDF). Архів оригіналу (PDF) за 8 серпня 2017. Процитовано 22 жовтня 2017.
Див. також[ред. | ред. код]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


