Vaiolo

| Vaiolo | |
|---|---|
 | |
| Specialità | infettivologia |
| Eziologia | Variola virus |
| Mortalità mondiale | 69% |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 050050 |
| ICD-10 | B03 |
| MeSH | D012899 |
| MedlinePlus | 001356 |
| eMedicine | 830328 e 237229 |
Il vaiolo è stata una malattia infettiva causata da due varianti del virus Variola, la Variola maior e la Variola minor[1]. La malattia è anche conosciuta con i termini latini variola o variola vera (dal tardo latino variŏla, derivato da varius, a significare "vario", "chiazzato"[2]), mentre il termine inglese smallpox venne coniato nel Regno Unito nel XV secolo per distinguerla dalla sifilide, denominata great pox[3].
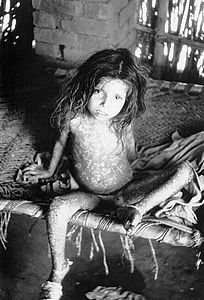
Il virus del vaiolo si localizza a livello della piccola circolazione della cute, del cavo orale e della faringe. A livello cutaneo si manifesta con un'eruzione maculo-papulare e, successivamente, con vescicole sollevate piene di liquido. La Variola maior è causa di manifestazioni cliniche più rilevanti ed è caratterizzata da una letalità del 30-35%[4][5]. Le complicanze a lungo termine includono cicatrici caratteristiche, soprattutto al volto, nel 65–85% di coloro che riescono a sopravvivere[6]; possono inoltre manifestarsi, seppure con una minore prevalenza stimabile nel 2-5% dei casi, cecità, come conseguenza di ulcere corneali e successivi esiti cicatriziali, e deformità degli arti, a causa di episodi di artrite e osteomielite. La Variola minor causa una forma di malattia più lieve, nota anche come alastrim, che può condurre al decesso nell'1% dei casi[4].
Si ritiene che il vaiolo sia emerso nella popolazione umana circa nel II millennio a.C.[3], e la prima prova fisica si può far risalire al rash pustoloso rilevato sulla mummia del faraone Ramses V[7]. Si è stimato che la malattia abbia ucciso circa 400 000 europei ogni anno durante il XVIII secolo[8] e sia stato responsabile di un terzo di tutti i casi di cecità[4][9]; fra le persone infettate, la mortalità variava dal 20% al 60% per gli adulti e arrivava fino all'80% dei bambini[10]. Nel XX secolo il vaiolo ha causato circa 300-500 milioni di decessi nel mondo[11][12][13], e nel solo 1967, secondo i dati dell'Organizzazione mondiale della sanità, quindici milioni di persone contrassero la malattia e di questi due milioni morirono[14].
Dopo una massiccia campagna di vaccinazione portata avanti dal XIX secolo e condotta con un imponente sforzo congiunto fra il 1958 e il 1977, l'OMS ha dichiarato nel 1979 la malattia eradicata dopo che l'ultimo caso di vaiolo contratto in natura, e causato da Variola minor, era stato diagnosticato in Somalia il 26 ottobre 1977[14]: l'eradicazione del vaiolo ha rappresentato uno dei massimi successi nella storia della medicina e un precedente inedito nella storia dell'umanità[15]. Il vaiolo è stata per decenni l'unica malattia eradicata fino al 2011, quando la peste bovina ha subito lo stesso destino[16][17][18].
Eziologia
[modifica | modifica wikitesto]| Variola virus | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Varidnaviria |
| Regno | Bamfordvirae |
| Phylum | Nucleocytoviricota |
| Classe | Pokkesviricetes |
| Ordine | Chitovirales |
| Famiglia | Poxviridae |
| Sottofamiglia | Chordopoxvirinae |
| Genere | Orthopoxvirus |
| Specie | Variola virus |
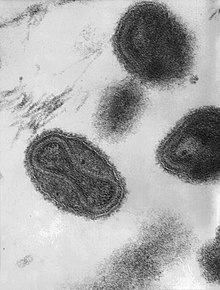
Il vaiolo è causato dall'infezione da Variola virus che appartiene al genere Orthopoxvirus della famiglia dei Poxviridae. Il virus è largo, a forma di mattone e misura approssimativamente 302-350 nm per 244-270 nm[19] con un DNA singolo lineare a doppio filamento e un genoma di 186 kbp caratterizzato da un terminatore stem-loop a ciascuna estremità[20][21]. Esiste in due forme: Variola maior e Variola minor.
I quattro orthopoxvirus che possono causare infezioni negli esseri umani sono, oltre al Variola virus, il Vaccinia virus, il virus del vaiolo bovino e quello del vaiolo delle scimmie. Il Variola virus infetta in natura solamente l'uomo, sebbene primati e altri animali siano stati infettati in laboratorio[22].
La comprensione del ciclo vitale dei poxvirus è complicata dal fatto che esistono numerose forme infettive con diversi meccanismi di accesso alla cellula. Il virus replica nel citoplasma della cellula, a differenza degli altri virus a DNA che normalmente replicano nel nucleo. Esso produce inoltre numerose proteine specifiche, la più importante delle quali è una RNA polimerasi DNA-dipendente. Sono infettivi sia i virioni dotati di envelope, sia quelli privi; questo è sintetizzato a livello dell'apparato di Golgi della cellula e include diversi polipeptidi virali specifici, tra cui un'emoagglutinina[20]. L'infezione con uno dei due Variola virus conferisce un'immunità nei confronti dell'altro[5].
Modalità di trasmissione
[modifica | modifica wikitesto]Il virus si trasmette per via aerea, mediante l'inalazione di goccioline contenenti i virioni, prodotte dalla mucosa orale, nasale o faringea di un individuo infetto. Si trasmette da una persona all'altra soprattutto per contatto diretto, solitamente entro due metri, ma anche tramite oggetti contaminati. Raramente si trasmette portato dall'aria all'interno di luoghi chiusi[23]. Il virus può passare attraverso la placenta, ma l'incidenza di vaiolo connatale è relativamente bassa[5].
Il vaiolo non è particolarmente contagioso durante la fase prodromica e la trasmissione avviene di solito dopo l'inizio delle manifestazioni cutanee, spesso accompagnate da lesioni del cavo orale e della faringe. Il virus può essere trasmesso per tutta la durata della malattia, soprattutto durante la prima settimana di rash, quando la maggior parte delle lesioni cutanee è intatta[22]. La fase infettiva termina 7-10 giorni dopo la formazione delle croste, ma il malato rimane infettivo fintanto che l'ultima crosta non si stacca[24].
La malattia è estremamente contagiosa, ma generalmente si diffonde più lentamente e meno largamente rispetto ad altre malattie virali, forse perché la trasmissione richiede uno stretto contatto ed è possibile solo dopo l'insorgenza del rash. Il tasso d'infezione è inoltre ridotto dalla breve durata dello stadio infettivo. Nelle aree temperate l'infezione si manifesta soprattutto durante l'inverno e la primavera, mentre nelle aree tropicali la differenza stagionale è più sfumata e la malattia è presente tutto l'anno[22]. La distribuzione per età dipende dallo stato dell'immunità acquisita: l'immunità dovuta alla vaccinazione si è ridotta nel tempo ed è probabilmente scomparsa nella maggior parte della popolazione vaccinata[5]. Non risulta che il vaiolo possa essere trasmesso da insetti o altri animali[22].
Clinica
[modifica | modifica wikitesto]Classificazione
[modifica | modifica wikitesto]Esistono due forme cliniche di vaiolo. La Variola maior è la forma più comune e più grave, caratterizzata da rash esteso e febbre più alta. La Variola minor è meno comune e meno grave, con una letalità inferiore all'1%[23]. Infezioni asintomatiche sono state osservate, ma sono alquanto rare[22]. Inoltre, una forma denominata variola sine eruptione può essere osservata nelle persone vaccinate; questa forma è caratterizzata da febbre che insorge successivamente al normale periodo di incubazione del virus e può essere confermata solo con la rilevazione di anticorpi diretti contro il virus mediante tecniche sierologiche oppure, raramente, tramite isolamento del virus stesso[22].
Segni e sintomi
[modifica | modifica wikitesto]Il periodo di incubazione che intercorre tra l'entrata in contatto con il virus e l'insorgenza delle prime manifestazioni cliniche è di circa 12 giorni. Una volta inalato il virus invade la mucosa dell'orofaringe o dell'apparato respiratorio, migra nei linfonodi loco-regionali e inizia a moltiplicarsi. Nella fase iniziale di crescita il virus sembra muoversi da una cellula all'altra ma, dopo il 12º giorno, inizia la lisi delle cellule infettate e il virus riesce a entrare nel torrente circolatorio, in una fase di viremia, e inizia una nuova moltiplicazione a livello della milza, del midollo osseo e dei linfonodi. I sintomi iniziali sono simili ad altre malattie virali quali l'influenza e il raffreddore: febbre superiore ai 38,5 °C, dolore muscolare, malessere generale, cefalea e decubito prosternato. L'apparato gastrointestinale è spesso coinvolto e comuni sono nausea, vomito e mal di schiena. Lo stadio pre-eruttivo dura normalmente 2-4 giorni, mentre a partire dal 12º-15º giorno compaiono le prime lesioni enantematiche a livello della mucosa di bocca, lingua, palato e faringe e la temperatura corporea si normalizza. Le lesioni vanno incontro a un rapido allargamento e alla rottura, con rilascio di una grande quantità di virioni nella saliva[5].

Il virus del vaiolo attacca preferenzialmente le cellule della cute, causando le classiche lesioni associate alla malattia. Il rash si sviluppa 24-48 ore dopo la comparsa delle lesioni della mucosa, tipicamente in primo luogo alla fronte, per poi rapidamente localizzarsi a tutto il viso, alle aree prossimali degli arti, al tronco e infine a mani e piedi. L'intero processo dura non più di 24-36 ore, dopodiché nessuna nuova lesione appare[5]. A questo punto la Variola maior può svilupparsi secondo diverse modalità, originando quattro diversi tipi di vaiolo secondo la classificazione di Rao[25]: ordinario, modificato, maligno ed emorragico. Il vaiolo è caratterizzato da una letalità del 30%, tuttavia le forme maligne ed emorragiche sono normalmente fatali[26].
Forma ordinaria
[modifica | modifica wikitesto]Il 90% dei casi di vaiolo nelle persone non vaccinate è di tipo ordinario[22]. In questo caso a partire dal 2º giorno di rash le lesioni cutanee si sollevano in papule; a partire dal 3º-4º giorno si riempiono di un liquido opalescente trasformandosi in vescicole. Entro 24-48 ore questo fluido diventa opaco e torbido, dando alle lesioni l'aspetto di pustole che, a differenza delle pustole vere e proprie, non contengono pus ma residui tissutali[5]; dopo il 6º-7º giorno tutte le lesioni hanno questo aspetto, raggiungendo la loro massima dimensione in una decina di giorni. Queste pustole sono sollevate, rotonde, tese e dure al tatto. Sono localizzate profondamente nel derma, dando l'impressione come di piccole biglie. Il fluido fuoriesce lentamente dalle lesioni e, dopo due settimane dall'inizio del rash, si sgonfiano e si seccano, formando delle croste. Entro la terza settimana le croste si formano sopra tutte le lesioni, che iniziano a sfaldarsi lasciando cicatrici depigmentate[27].
La forma ordinaria di vaiolo produce generalmente un rash discreto con pustole non confluenti[28]. Il rash è localizzato soprattutto al volto, è meno denso al tronco rispetto alle estremità e più denso alle parti anatomiche distali rispetto a quelle prossimali. Il palmo delle mani e le piante dei piedi sono coinvolte nella maggior parte dei casi. Talvolta le vescicole diventano confluenti, staccando gli strati esterni della pelle dal tessuto sottostante; in questo caso il tasso di letalità osservato è stato del 62%[22].

Forma modificata
[modifica | modifica wikitesto]La forma modificata si manifesta soprattutto negli individui precedentemente vaccinati ed è chiamata così per le caratteristiche dell'eruzione cutanea e la rapidità del suo sviluppo. In questo caso i sintomi prodromici possono presentarsi ma sono generalmente meno gravi rispetto alla forma ordinaria. Non vi è normalmente febbre e le lesioni sono in minor numero e si risolvono rapidamente, sono più superficiali e non uniformi come nella forma ordinaria[27]. Questo tipo di vaiolo è raramente fatale e può essere facilmente confuso con la varicella[22].
Forma maligna
[modifica | modifica wikitesto]Nella forma maligna, anche chiamata forma piatta, le lesioni sono localizzate a filo con la pelle nello stesso periodo in cui, nella forma ordinaria, si manifestano le vescicole in rilievo. Il motivo per cui certi individui sviluppano questa forma è sconosciuto e rappresenta il 5-10% dei casi di vaiolo, manifestandosi soprattutto nei bambini (72% dei casi)[29]. Si suppone che si manifesti in relazione a disordini immunologici dell'individuo di tipo carenziale[30]. È caratterizzata da una sindrome prodromica molto importante della durata di 3-4 giorni, febbre elevata e di lunga durata e sintomi classici della setticemia. Il rash alla lingua e al palato è esteso e le lesioni cutanee maturano lentamente, rimanendo profonde nella cute e rimanendo piatte a partire dal settimo-ottavo giorno. A differenza della forma ordinaria le vescicole contengono poco fluido, sono soffici e vellutate al tatto e possono contenere sangue. Questa forma è quasi sempre fatale[22].
Forma emorragica
[modifica | modifica wikitesto]Il vaiolo emorragico è una forma grave, caratterizzata da estese emorragie della cute, delle mucose, delle membrane e del tratto gastrointestinale. Si sviluppa in circa il 2% dei casi, soprattutto negli adulti[22]. In questa forma non si sviluppano vescicole e la cute rimane liscia; l'emorragia si sviluppa nel derma profondo, facendo apparire la cute nera quasi fosse carbonizzata[22][31]. Si suppone che la forma sia dovuta a particolari condizioni dell'individuo, quali l'immunodepressione, oppure a un particolare ceppo del virus; i dati relativi sono tuttavia carenti[30].

All'inizio, durante il 2º-3º giorno, si presenta con emorragia sottocongiuntivale. Il vaiolo emorragico presenta anche eritema, petecchie, emorragia della milza, del rene, del peritoneo, dei muscoli e, più raramente, dell'epicardio, del fegato, dei testicoli, delle ovaie e della colecisti. Nella forma precoce il decesso avviene rapidamente intorno al 5º-7º giorno di malattia, quando solo un minimo numero di lesioni cutanee è presente, mentre la forma tardiva conduce a morte il paziente in 8-10 giorni. Le emorragie si manifestano precocemente e il rash cutaneo rimane piatto, senza raggiungere la fase vescicolare[22].
I pazienti con la forma precoce mostrano una rapida riduzione dei fattori della coagulazione, delle piastrine, delle globuline e della protrombina e un innalzamento dell'antitrombina circolante. La forma tardiva mostra una minor carenza dei fattori della coagulazione, una piastrinopenia marcata e un innalzamento dell'antitrombina[5]. Questa forma, normalmente mortale[22], rappresenta dal 3 al 25% dei casi fatali di vaiolo in relazione alla virulenza del ceppo virale[26].
Diagnostica
[modifica | modifica wikitesto]Nella sua definizione clinica il vaiolo è considerato una malattia caratterizzata da esordio acuto di febbre superiore ai 38,3 °C, seguito da un rash con vescicole o pustole profonde e solide allo stesso stadio di sviluppo, in assenza di altre cause apparenti[22]. La conferma è data dalla diagnosi di laboratorio.
Al microscopio si possono osservare le classiche inclusioni citoplasmatiche dei poxvirus, le più importanti delle quali sono denominate corpi di Guarnieri, che rappresentano dei siti di replicazione virale. Queste inclusioni possono essere facilmente identificate in biopsie cutanee colorate con ematossilina eosina come bolle rosa e sono presenti in tutte le infezioni da poxvirus; tuttavia, la loro assenza non può escludere la diagnosi di malattia[32]. La diagnosi infezione da orthopoxvirus può essere anche ottenuta rapidamente tramite microscopia elettronica del fluido contenuto nelle pustole o delle croste, ma i virioni sono identici tra tutti gli orthopoxvirus[5].

La diagnosi definitiva avviene sottoponendo il virus a crescita nella membrana corio-allantoidea, una parte dell'embrione di pulcino ed esaminando le lesioni a definite condizioni di temperatura[33]. I diversi genotipi del virus possono essere distinti mediante la reazione a catena della polimerasi (PCR) e l'analisi del polimorfismo da lunghezza dei frammenti di restrizione (RFLP). I test sierologici e il test ELISA, che misurano le immunoglobuline specifiche dirette verso antigeni del Variola virus, possono risultare utili nella diagnosi[34].
La varicella era facilmente confondibile con il vaiolo prima della sua eradicazione ed entrava quindi in diagnosi differenziale. Le due malattie possono essere distinte con vari metodi. A differenza del vaiolo, la varicella normalmente non si localizza al palmo delle mani e alla pianta dei piedi; inoltre, la pustole varicellose hanno una dimensione variabile a seconda del momento in cui vengono a crearsi, mentre le pustole vaiolose sono tutte all'incirca della stessa dimensione. Oltre alla clinica sono disponibili numerosi esami di laboratorio per determinare se si tratta di varicella nella valutazione di casi sospetti di vaiolo[22].
Trattamento e prevenzione
[modifica | modifica wikitesto]La prima procedura utilizzata nella prevenzione del vaiolo è stata la variolizzazione. Praticata in India nel I millennio a.C., questa consisteva nell'inoculazione, tramite insufflazione nasale, di croste vaiolose polverizzate o di materiale ottenuto dal grattamento delle lesioni cutanee di malati lievi[35][36].
Tuttavia, il fatto che la variolizzazione sia nata in India è stato messo in discussione dal fatto che solo alcuni degli antichi testi di medicina scritti in sanscrito descrivono il processo[37]. Questa tecnica di prevenzione era utilizzata in Cina già negli ultimi anni del X secolo ed era ampiamente diffusa e praticata nel XVI secolo, durante la dinastia Ming[38]. Se ha successo, la variolizzazione genera un'immunità al vaiolo, tuttavia, dal momento che la persona viene infettata con il virus, questa può andare incontro a una grave infezione e può trasmettere la malattia ad altri. La variolizzazione ha un tasso di letalità dello 0,5-2%, sensibilmente inferiore al 20-30% della malattia stessa[22].
Durante il suo soggiorno nell'Impero ottomano, Lady Mary Wortley Montagu osservò il processo di variolizzazione, descrivendone in modo particolareggiato la tecnica e promuovendone entusiasticamente l'introduzione nel Regno Unito al suo ritorno nel 1718[39]. Nel 1721 Cotton Mather e i suoi colleghi provocarono aspre polemiche inoculando centinaia di persone a Boston. Nel 1748 ad Amsterdam Théodore Tronchin fu il primo medico europeo a eseguire la variolizzazione sul proprio figlio, e successivamente restò un convinto sostenitore della metodica praticandola a molti altri pazienti e promuovendola sulla Encyclopédie. Poi, nel 1796, Edward Jenner scoprì che l'immunità al vaiolo poteva essere ottenuta anche inoculando al paziente materiale ricavato da lesioni di vaiolo bovino, malattia animale causata da un virus della stessa famiglia di quello del vaiolo. Jenner chiamò il materiale utilizzato "vaccino", da "vacca", termine in lingua latina per mucca. La procedura era di gran lunga più sicura della variolizzazione e non comportava il rischio di trasmissione della malattia, pertanto si diffuse rapidamente in tutto il mondo. Durante il XIX secolo il virus del vaiolo bovino venne sostituito con il Vaccinia virus, sempre della stessa famiglia del Variola virus ma geneticamente diverso. La sua origine e il motivo per cui iniziò a essere utilizzato nella vaccinazione sono sconosciuti[22].
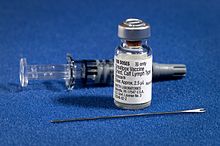
L'attuale formulazione del vaccino antivaioloso è data da un preparato di Vaccinia virus vivo e infettivo. Viene somministrato con un ago biforcato, che viene prima immerso nella soluzione vaccina e poi utilizzato per pungere la cute, solitamente del braccio, un diverso numero di volte in pochi secondi. Qualora la vaccinazione sia efficace, si sviluppa nel sito di iniezione un rigonfiamento rosso e pruriginoso nel giro di 3-4 giorni. Nella prima settimana questo diventa un'ampia vescica che si riempie di pus e comincia a essiccarsi. La seconda settimana si inizia a formare una crosta, che cade durante la terza, lasciando una piccola cicatrice[40].
Gli anticorpi prodotti in seguito alla vaccinazione sono protettivi nei confronti di tutti gli orthopoxvirus e sono ancora rilevabili dieci anni dopo la prima vaccinazione e sette giorni dopo la rivaccinazione. Secondo i dati statistici conferiscono una protezione efficace nel 95% dei soggetti vaccinati[41]. La copertura è elevata nei primi 3-5 anni e decresce in quelli successivi, mentre nel caso di rivaccinazione la copertura è ancora più duratura. In Europa, durante gli anni cinquanta e sessanta, la mortalità nei soggetti vaccinati da meno di dieci anni al momento dell'esposizione al virus era dell'1,3%, mentre era del 7% nei soggetti vaccinati da oltre 10 anni e dell'11% in quelli vaccinati da oltre vent'anni. Di contrasto la letalità nei non vaccinati era del 52%[42]. La vaccinazione entro i primi tre giorni dall'esposizione al virus previene o diminuisce sensibilmente la gravità della malattia nella grande maggioranza della popolazione; la vaccinazione eseguita tra il 4º e il 7º giorno dall'esposizione può garantire una protezione parziale e può modificare la gravità della malattia[41].
Ci sono effetti collaterali e rischi associati alla vaccinazione antivaiolosa. Nel passato circa lo 0,1% dei vaccinati per la prima volta mostrava effetti seri ma non pericolosi per la vita, tra cui reazioni allergiche nel sito di iniezione con eritema multiforme e dispersione del Vaccinia virus nelle altre parti del corpo. Effetti potenzialmente letali si manifestavano in 14-500 persone ogni milione di vaccinati e si stima che 1-2 persone ogni milione siano morte, in conseguenza soprattutto di encefalite post-vaccinica o necrosi progressiva del sito di vaccinazione[41].

Una volta eradicato il vaiolo, i casi di malattia secondaria a vaccinazione superarono quelli di contagio naturale e la vaccinazione dei bambini venne interrotta nel 1972 negli Stati Uniti e nei primi anni settanta nella maggior parte dei Paesi europei[14][43]. A partire dal 1986 la vaccinazione antivaiolosa è cessata in tutti i Paesi[14] ed è raccomandata solo per chi, lavorando in laboratori biologici, è a rischio di esposizione professionale[22].
All'infuori della vaccinazione, il trattamento del vaiolo è solamente di supporto e si basa sull'idratazione, il monitoraggio dell'infezione ed eventualmente sulla ventilazione artificiale. Le forme emorragiche e maligne sono trattate con le terapie per lo shock settico e, in caso di pustole confluenti, il trattamento è simile a quello instaurato per pazienti con ustioni estese[44].
Nessun farmaco è approvato per il trattamento del vaiolo, dal momento che i farmaci antivirali sono stati sviluppati solo successivamente all'eradicazione della malattia. Gli studi suggeriscono che il cidofovir somministrato per via endovenosa possa essere efficace nella terapia, sebbene sia caratterizzato da tossicità renale[45].
Prognosi
[modifica | modifica wikitesto]Il tasso di letalità per la forma ordinaria di vaiolo è circa del 30%, ma varia a seconda delle lesioni cutanee: se confluenti la letalità è del 50-75%, mentre se sono semi-confluenti scende al 25-50%, per passare a meno del 10% nel caso di un rash discreto. La letalità nei bambini di età inferiore a un anno è invece del 40%–50%. Le forme maligne ed emorragiche hanno il tasso di letalità più alto, rispettivamente del 90% e del 100%. La Variola minor è invece caratterizzata da una letalità inferiore all'1%[27]. Non ci sono prove che la malattia possa cronicizzare o recidivare[27].
Nei casi mortali di vaiolo, il decesso avviene generalmente tra il 10º e il 16º giorno di malattia. La causa della morte da vaiolo non è nota, ma è risaputo che la malattia coinvolge numerosi organi; la formazione di immunocomplessi circolanti, la massiccia viremia e la risposta immune incontrollata vi possono contribuire[22]. Nella forma emorragica precoce la morte sopraggiunge circa sei giorni dopo l'inizio della febbre, generalmente per scompenso cardiaco associato a edema polmonare, mentre nella forma emorragica tardiva la causa è da attribuire alla grave piastrinopenia, alla viremia e alla scarsa risposta immunitaria[29]. Nella forma maligna la morte è da imputarsi alla disidratazione, con perdita di proteine ed elettroliti, e alla sepsi, come avviene generalmente nelle ustioni gravi[44].
Il vaiolo può complicarsi a livello del sistema respiratorio, con manifestazioni che vanno dalla bronchite semplice alla polmonite fatale. Le complicanze respiratorie si manifestano di solito intorno all'8º giorno di malattia e possono derivare anche da infezioni opportunistiche virali o batteriche. Le infezioni batteriche secondarie della cute sono relativamente rare, ma quando si presentano la febbre tende a rimanere elevata per tutta la durata della malattia[22].
Altre complicanze includono l'encefalite, che si manifesta in un paziente ogni 500 ed è più comune negli adulti, malattie oculari, nel 2% dei casi, e cicatrici permanenti, localizzate soprattutto al volto. Le pustole si possono formare sulla palpebra, sulla congiuntiva e sulla cornea, complicandosi con congiuntivite, cheratite, ulcera corneale, irite, iridociclite e atrofia ottica. La cecità sopraggiunge in circa il 35-40% dei pazienti con cheratite e ulcera corneale. Il vaiolo emorragico può provocare anche emorragia della congiuntiva e della retina. Nel 2-5% dei bambini malati, il virus può raggiungere le articolazioni e le ossa, causando una osteomielite. Le lesioni ossee sono simmetriche e coinvolgono soprattutto gomito, tibia e perone, causando una separazione dell'epifisi e una reazione periostale. Le lesioni articolari limitano i movimenti e l'artrite può portare a deformità degli arti, anchilosi e dita tozze[5].
Storia
[modifica | modifica wikitesto]
L'epoca della comparsa del vaiolo non è definita, ma si presume possa essersi evoluto a partire da un virus dei roditori[46][47]. L'ampia variabilità del periodo è dovuta ai differenti dati utilizzati per calibrare la frequenza molecolare. Un clado è quello del ceppo di Variola maior che si diffuse partendo dall'Asia tra 400 e 1 600 anni fa ed è responsabile della forma più grave di vaiolo. Un altro clado include entrambi i ceppi di Variola minor descritti nel continente americano e isolati in Africa occidentale, che si suppone si siano separati dal ceppo ancestrale tra i 1 400 e i 6 300 anni fa; questo clado si pensa possa essersi distinto in due subclado almeno 800 anni fa.
Una seconda stima è basata sull'ipotesi che il Variola virus si sia separato dal virus del vaiolo del gerbillo circa 3 000-4 000 anni fa[48]. Questa stima è coerente con le prove storiche e archeologiche che identificano il vaiolo come una malattia umana con un'origine relativamente recente. Tuttavia, supponendo che il tasso di mutazione genetica sia simile a quella dei virus della famiglia degli Herpesviridae, si stima che la separazione tra Variola virus e il virus del vaiolo del gerbillo sia avvenuta circa 50 000 anni fa. Questa stima è coerente con le altre stime pubblicate e suggerisce che le prove archeologiche e storiche siano decisamente incomplete. Sono quindi necessarie migliori stime dei tassi di mutazione di questi virus per poter uniformare i dati[48].
Il vaiolo sembra essere emerso come malattia endemica in India circa 2 500-3 000 anni fa[49], mentre il suo trasferimento dall'Africa orientale al Sud America è avvenuto nel XIX secolo.
La prima evidenza clinica attendibile di vaiolo è stata trovata nella mummia del faraone egiziano Ramses V, morto oltre 3 000 anni fa[7], mentre archivi storici asiatici descrivono una malattia simile al vaiolo in India[50] e in Cina nei secoli successivi[51]. Si è ipotizzato che i commercianti egiziani abbiano importato la malattia in India nel I millennio a.C., dove è rimasta endemica per oltre 2 000 anni; il vaiolo sembra poi essere stato introdotto in Cina nel I secolo a.C. dai territori a sud-ovest e da qui in Giappone nel VI secolo[29]. In Giappone si stima che l'epidemia del 735-737 abbia ucciso un terzo della popolazione dell'arcipelago[8][52]. Almeno sette divinità sono state specificatamente associate al vaiolo, tra i quali Sopona della religione del popolo Yoruba e Shitala Devi dell'induismo[53].
L'arrivo del vaiolo in Europa e nel Sud-est asiatico è invece meno chiaro. La malattia non è descritta nell'Antico e nel Nuovo Testamento della Bibbia e nemmeno nella letteratura greca e romana e gli studiosi concordano che molto difficilmente una tale malattia possa essere sfuggita a una descrizione da parte di Ippocrate se si fosse manifestata nell'area mediterranea[54].
Mentre la peste antonina, che dilagò attraverso l'Impero romano tra il 165 e il 180, si pensa possa essere stata causata da un'epidemia di vaiolo[55][56], altri storici ipotizzano che siano state le truppe arabe a portare per prime la malattia dall'Africa all'Europa sud-orientale nel VII-VIII secolo[29]. Nel IX secolo il medico persiano Abu Bakr Mohammad Ibn Zakariyya al-Razi compì una delle osservazioni più importanti sul vaiolo e fu il primo a distinguerlo dal morbillo e dalla varicella nella sua opera Kitab fi al-jadari wa-al-hasbah, in italiano Il libro del vaiolo e del morbillo[57].

Durante il Medioevo il vaiolo si presentò con epidemie periodiche, ma non divenne endemico finché la popolazione non crebbe, aiutato anche dai grandi movimenti di persone che caratterizzarono il periodo delle crociate. A partire dal XVI secolo il vaiolo era presente in quasi tutta Europa, infettando soprattutto i bambini e causando la morte di oltre il 30% degli individui infetti[29]. Le successive esplorazioni e colonizzazioni europee favorirono la diffusione della malattia in tutto il mondo conosciuto e il vaiolo divenne una delle più importanti cause di morbilità e mortalità[29].
Non esistono descrizioni attendibili di casi di vaiolo nel continente americano prima della colonizzazione europea del XV secolo[47]. Nel 1507 fu introdotto sull'isola di Hispaniola e nel 1520 sulla terraferma, quando i coloni spagnoli si spostarono in Messico. Il vaiolo decimò la popolazione nativa amerinda e rese più rapida e facile la conquista degli imperi azteco e inca[29]. Nel 1633, alla fondazione delle colonie nella costa orientale del Nord America seguì una devastante epidemia presso le popolazioni native americane[58] e, successivamente, per i coloni nati nel Nuovo Mondo[11]. Le stime parlano di un tasso di letalità della malattia presso i nativi americani dell'80-90%[59]. In Australia il vaiolo fu introdotto prima nel 1789 e di nuovo nel 1829[29], diventando la prima causa di morte per gli aborigeni australiani tra il 1780 e il 1870[60].
A partire dalla metà del XVIII secolo il vaiolo era la maggior malattia endemica in tutto il mondo, con l'eccezione dell'Australia e di altre piccole isole; in Europa rappresentava la prima causa di morte, con 400 000 decessi l'anno[9].
Il vaiolo rappresentava il 10% delle cause di mortalità infantile in Svezia[8] e il tasso si stima fosse ancora più elevato in Russia[51]. L'uso della variolizzazione in alcuni Paesi, come in Cina, nel Regno Unito e nelle sue colonie nordamericane, ridusse l'impatto della malattia nei confronti delle classi agiate durante l'ultimo periodo del XVIII secolo, ma una vera riduzione dell'incidenza si ebbe solo quando la vaccinazione divenne prassi comune alla fine del XIX secolo. I vaccini e la pratica della rivaccinazione portarono a una riduzione dei casi solamente in Europa e in Nord America, mentre il vaiolo rimaneva incontrollato nel resto del mondo. Negli ultimi anni del XIX secolo fu identificata, negli Stati Uniti e in Sudafrica, la variola minor, che nella prima metà del XX secolo si espanse in molte parti del continente africano. Questa malattia, che causa una forma molto più lieve di vaiolo ed è caratterizzata da una minore letalità, garantisce l'immunità alla variola maior. Pertanto, nel giro di pochi anni, divenne la forma principale di vaiolo, soprattutto negli Stati Uniti, in Canada, in Sud America e nel Regno Unito, riducendo ulteriormente i tassi di mortalità[29].
Eradicazione
[modifica | modifica wikitesto]
Sin dalla dimostrazione di Jenner dell'efficacia della vaccinazione nel 1796, furono fatti numerosi tentativi per eliminare il vaiolo su scala regionale. Nel 1803 il Regno di Spagna organizzò una missione per trasportare il vaccino nelle colonie dell'Impero spagnolo in America e nelle Filippine e vi creò un massiccio programma di vaccinazione[61], e lo stesso fu fatto dal governo inglese in India[62]. Tuttavia, le campagne di vaccinazione britanniche in India e in Birmania furono ostacolate dalla testarda preferenza indigena per la variolizzazione e la diffidenza nei confronti della vaccinazione, nonostante le dure leggi, il miglioramento dell'efficacia della conservazione locale del vaccino e l'educazione sanitaria[63]. A partire da 1832 il Governo federale degli Stati Uniti d'America introdusse un programma di vaccinazione per i nativi americani[64]. Nel 1842 il Regno Unito bandì la pratica della variolizzazione, introducendo la vaccinazione obbligatoria nel 1853[65]. Lo stesso avvenne negli Stati Uniti tra il 1843 e il 1855, a partire dallo Stato del Massachusetts; nonostante l'avversione di alcuni per questa misura[51], nel 1897 il vaiolo era quasi scomparso dal Paese[66]. In molti Paesi dell'Europa settentrionale la malattia era stata debellata agli inizi del XIX secolo e, nel 1914, l'incidenza nei Paesi industrializzati si era ridotta a valori relativamente bassi. La vaccinazione venne mantenuta fino ai tardi anni settanta per evitare la possibile reintroduzione del vaiolo da Paesi ancora endemici. L'Australia e la Nuova Zelanda furono invece un caso a parte, in quanto non introdussero mai un programma di vaccinazione preferendo la quarantena rigorosa, in quanto le grandi distanze e la bassa densità abitativa rendevano difficile il contagio[67].
Il primo grande sforzo per eradicare il vaiolo dall'emisfero occidentale fu la campagna lanciata nel 1950 dalla Pan American Health Organization[68] ed ebbe successo nell'eliminare la malattia in tutti i Paesi americani, con l'eccezione dell'Argentina, del Brasile, della Colombia e dell'Ecuador[67]. Nel 1958 il ministro della sanità dell'Unione Sovietica, Viktor Ždanov, fece un appello all'Assemblea mondiale della sanità dell'Organizzazione mondiale della sanità per intraprendere un'iniziativa mondiale finalizzata all'eradicazione globale della malattia, proposta che fu accettata, con la risoluzione WHA 11.54, nel 1959, anno in cui ancora due milioni di persone ogni anno morivano per il vaiolo[69].

Nel complesso, tuttavia, i progressi verso l'eliminazione furono deludenti, soprattutto in Africa e nel subcontinente indiano. Nel 1967 l'OMS intensificò gli sforzi, contribuendo con 2,4 milioni di dollari annui e introducendo il metodo della sorveglianza sanitaria, una metodica epidemiologica che permette il monitoraggio della diffusione della malattia al fine di stabilire i modelli di progressione[70].
Si stima che i casi di vaiolo annui fossero, nei primi anni cinquanta, oltre 50 milioni[14]. Per sradicare il vaiolo, si doveva impedire a ogni focolaio di diffondersi, attraverso l'isolamento dei malati e la vaccinazione di tutti coloro che vivevano nelle vicinanze. La chiave strategica è stata il monitoraggio di tutti casi di una comunità e il contenimento. Il problema iniziale che l'OMS si trovò di fronte era l'inadeguata segnalazione dei casi di vaiolo, in quanto molti casi non venivano denunciati alle autorità sanitarie, pertanto fu creata una rete di consulenti che aiutassero i Paesi nella creazione di strutture di sorveglianza e di contenimento. Il fatto che gli esseri umani fossero l'unico serbatoio del virus e che non esistessero portatori sani, giocò un ruolo fondamentale nell'eradicazione del vaiolo. All'inizio le dosi di vaccino furono fornite principalmente da Unione Sovietica e Stati Uniti, ma, nel 1973, oltre l'80% della produzione avveniva nei Paesi in via di sviluppo[67].
L'ultimo focolaio di vaiolo in Europa avvenne in Jugoslavia nel 1972, a causa di un pellegrino del Kosovo ritornato dal Medio Oriente, dove aveva contratto il virus, e causò l'infezione di 175 persone, delle quali 35 morirono. Le autorità decisero di instaurare la legge marziale, forzando la quarantena, intraprendendo una massiccia campagna di rivaccinazione e richiedendo l'aiuto dell'OMS. In due mesi l'epidemia terminò[71]. Precedentemente a questa ci fu un focolaio a Stoccolma, tra il maggio e il luglio del 1963, causato da un marinaio svedese di ritorno dall'Estremo Oriente. Anche in questo caso l'epidemia fu tenuta sotto controllo da misure di quarantena e vaccinazione della popolazione locale[72].
Alla fine del 1975 il vaiolo resisteva solo nel Corno d'Africa, in Etiopia e Somalia. Le condizioni erano difficili per via della guerra civile, della carestia, dei profughi e della carenza di strade e altre vie di comunicazione. Un programma di sorveglianza intensiva, di contenimento e di vaccinazione fu avviato in questi Paesi nella prima metà del 1977[73]. L'ultimo caso di contagio naturale con il virus, nella variante variola minor, fu diagnosticato in Somalia il 26 ottobre 1977 al cuoco 23enne Ali Maow Maalin[22]. L'ultimo caso di variola maior contratta naturalmente risale all'ottobre del 1975, in una bambina bengalese di due anni[31].
L'eradicazione mondiale del vaiolo fu certificata da una commissione di eminenti scienziati, dopo intense attività di verifica nei vari Paesi, il 9 dicembre 1979 e successivamente approvata con una risoluzione dell'Assemblea mondiale della sanità dell'OMS l'8 maggio 1980[14][74]. Le prime due frasi della risoluzione riportano:
«Having considered the development and results of the global program on smallpox eradication initiated by WHO in 1958 and intensified since 1967 … Declares solemnly that the world and its peoples have won freedom from smallpox, which was a most devastating disease sweeping in epidemic form through many countries since earliest time, leaving death, blindness and disfigurement in its wake and which only a decade ago was rampant in Africa, Asia and South America[75].»
«Dopo aver considerato lo sviluppo e i risultati del programma globale di eradicazione del vaiolo avviato dall'OMS nel 1958 e intensificato a partire dal 1967 [...] dichiara solennemente che il mondo e i suoi popoli hanno ottenuto la libertà dal vaiolo, una delle malattie più devastanti a manifestarsi con epidemie in molti paesi sin dai tempi più remoti, lasciando morte, cecità e deturpazione nella sua scia e che solo un decennio fa era dilagante in Africa, Asia e Sud America.»
Dopo l'eradicazione
[modifica | modifica wikitesto]
Gli ultimi due casi di vaiolo al mondo si sono verificati a Birmingham, nel Regno Unito, nel 1978, quando due dipendenti della Facoltà di Medicina dell'Università di Birmingham contrassero il virus e uno dei due morì, l'11 settembre 1978[75]. Dopo questo fatto Henry Bedson, responsabile scientifico dell'Università per la ricerca contro il vaiolo, si suicidò[3]. Alla luce di questo incidente, tutte le riserve conosciute di vaiolo furono distrutte o trasferite in uno dei due laboratori di riferimento dell'OMS dotati di un livello di sicurezza adeguato: il CDC di Atlanta e il Centro nazionale di ricerca in virologia e biotecnologie VEKTOR di Kol'covo, in Russia[76].
È del 1986 la prima raccomandazione dell'OMS riguardo alla distruzione del virus, con data fissata il 30 dicembre 1993 e poi posposta al 30 giugno 1999[77]. A causa della resistenza da parte degli Stati Uniti e Russia, nel 2002 l'Assemblea mondiale della sanità dell'OMS ha deciso di consentire il mantenimento temporaneo degli stock di virus a scopo di ricerca[78]. La distruzione delle scorte esistenti potrebbe ridurre il rischio che comporta la ricerca in corso sul vaiolo e le scorte non sono necessarie per rispondere a un'eventuale epidemia di vaiolo[79], tuttavia alcuni scienziati sostengono che le scorte possano essere utili nello sviluppo di nuovi vaccini, farmaci antivirali e test diagnostici[80]. Una pubblicazione del 2010 di una squadra di esperti di salute pubblica, nominati dall'OMS, ha concluso che non vi sia alcuna essenziale questione di sanità pubblica che giustifichi Stati Uniti e Russia a mantenere riserve di virus[81] e questa opinione è generalmente condivisa dalla comunità scientifica, in particolare tra gli ex responsabili del programma dell'OMS per l'eradicazione del vaiolo[82].
Il vaiolo come arma biologica
[modifica | modifica wikitesto]Gli inglesi considerarono di utilizzare il vaiolo come arma biologica nell'assedio di Fort Pill durante la guerra franco-indiana (1754-1763) contro i francesi e i loro alleati nativi americani[83][84][85][86], mentre è stato ipotizzato che lo stesso agente patogeno sia stato utilizzato come arma durante la guerra d'indipendenza americana (1775-1783)[87][88].
Durante la seconda guerra mondiale gli scienziati del Regno Unito, degli Stati Uniti e del Giappone sono stati coinvolti nella ricerca per produrre un'arma biologica dal vaiolo[89]. Tuttavia non furono mai attuati piani per una produzione in larga scala, poiché si ritenne che, in presenza di un vaccino efficace, l'arma non avrebbe avuto l'efficacia sperata[90].
Nel 1947 l'Unione Sovietica costruì una fabbrica per la creazione di armi biologiche basate sul vaiolo nella città di Zagorsk, 75 km a nord di Mosca[91] e si suppone si sia verificata un'epidemia causata da alcuni test negli anni settanta[92]. In seguito a pressioni internazionali, il governo sovietico autorizzò nel 1991 un'ispezione da parte di un team anglo-americano di quattro dei più importanti impianti bellici. Gli ispettori ricevettero risposte evasive e smentite da parte dagli scienziati sovietici e alla fine furono allontanati dalla struttura[93]. Nel 1992, Ken Alibek, un disertore russo, sostenne che il programma sovietico di armi biologiche a Zagorsk abbia prodotto una scorta di venti tonnellate di virus da usare eventualmente come arma e testate refrigerate per il loro trasporto[94]. Nel 1997, il governo russo annunciò che tutti i suoi campioni di vaiolo rimanenti sarebbero stati trasferiti al Centro di ricerca statale di virologia e biotecnologia VECTOR di Kol'covo[93]. Dopo il crollo dell'Unione Sovietica e la disoccupazione di molti degli scienziati responsabili del programma bellico, i funzionari del governo degli Stati Uniti hanno espresso la preoccupazione di come il vaiolo e la competenza per ottenerne un'arma possa permettere ad altri governi o a gruppi terroristici di utilizzare il virus come mezzo di guerra biologica[95]. Accuse specifiche mosse contro l'Iraq a tale proposito, tuttavia, si sono rivelate false[96]. Alcuni hanno espresso la preoccupazione che la sintesi genetica artificiale possa essere utilizzata per ricreare il virus a partire da genomi già esistenti per utilizzarlo come arma biologica, dal momento che è teoricamente fattibile l'inserimento del DNA del virus del vaiolo all'interno di strutture virali simili, come altri Orthopoxvirus[97].
Dopo gli attacchi terroristici dell'11 settembre 2001, il governo degli Stati Uniti si allertò contro il rischio di un attacco bioterroristico. Fu prodotto un gran numero di dosi di vaccino per essere in grado di immunizzare la popolazione americana nel caso di una nuova epidemia di vaiolo e, nel dicembre 2002, un programma speciale del governo ha offerto la possibilità, a qualunque cittadino lo desiderasse, di vaccinarsi contro il virus del vaiolo. Tra il dicembre 2002 e il marzo 2003 sono stati vaccinati oltre 25 000 civili e oltre 325 000 militari americani[98].
L'Italia possiede cinque milioni di dosi di vaccino che, in caso di necessità, possono essere diluite con la possibilità di vaccinare 25 milioni di persone[98].
Note
[modifica | modifica wikitesto]- ^ (EN) Ryan KJ, Ray CG (editors), Sherris Medical Microbiology, 4th, McGraw Hill, 2004, pp. 525–8, ISBN 0-8385-8529-9.
- ^ vaiolo, in Treccani.it – Vocabolario Treccani on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ a b c (EN) Barquet N, Domingo P, Smallpox: the triumph over the most terrible of the ministers of death [collegamento interrotto], in Ann. Intern. Med., vol. 127, 8 Pt 1, 15 ottobre 1997, pp. 635–42, PMID 9341063.
- ^ a b c (EN) Behbehani AM, The smallpox story: life and death of an old disease, in Microbiol Rev, vol. 47, n. 4, 1º dicembre 1983, pp. 455–509, PMC 281588, PMID 6319980.
- ^ a b c d e f g h i j (EN) Smallpox, su afip.org, Armed Forces Institute of Pathology: Department of Infectious and Parasitic Diseases, 9 ottobre 2007. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 9 ottobre 2007).
- ^ (EN) Jezek Z, Hardjotanojo W, Rangaraj AG, Facial scarring after varicella. A comparison between variola major and variola minor, in Am. J. Epidemiol., vol. 114, n. 6, 1981, pp. 798–803, PMID 7315828.
- ^ a b (EN) Donald Hopkins, Ramses V:Earliest known victim? (PDF), su whqlibdoc.who.int, WHO. URL consultato il 6 luglio 2012 (archiviato dall'url originale il 19 settembre 2007).
- ^ a b c (EN) J. N. Hays, Epidemics and pandemics: their impacts on human history, ABC-CLIO, 2005, pp. 151, ISBN 1-85109-658-2.
- ^ a b (EN) Donald A. Henderson and Bernard Moss, Vaccines, Filadelfia, Saunders, 1999.
- ^ (EN) Riedel S, Edward Jenner and the history of smallpox and vaccination, in Proc (Bayl Univ Med Cent), vol. 18, n. 1, 2005, pp. 21–5, PMC 1200696, PMID 16200144.
- ^ a b Koplow.
- ^ (EN) UC Davis Magazine, Summer 2006: Epidemics on the Horizon, su ucdavismagazine.ucdavis.edu. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 30 maggio 2012).
- ^ (EN) How Poxviruses Such As Smallpox Evade The Immune System, su sciencedaily.com, ScienceDaily, 1º febbraio 2008. URL consultato il 7 luglio 2012.
- ^ a b c d e f (EN) Smallpox, su WHO Factsheet. URL consultato il 6 luglio 2012 (archiviato dall'url originale il 23 ottobre 2012).
- ^ (EN) History of smallpox vaccination, su World Health Organization. URL consultato il 4 luglio 2023.
- ^ (EN) De Kevin M. Cock, (Book Review) The Eradication of Smallpox: Edward Jenner and The First and Only Eradication of a Human Infectious Disease, in Nature Medicine, vol. 7, n. 1, 2001, pp. 15–6, DOI:10.1038/83283.
- ^ (EN) Tognotti E., The eradication of smallpox, a success story for modern medicine and public health: What lessons for the future? (PDF), in J Infect Dev Ctries, vol. 4, n. 5, giugno 2010, pp. 264–266, PMID 20539058. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 2 aprile 2015).
- ^ (EN) The world is free of rinderpest, su mg.co.za, The Mail and Guardian, 25 maggio 2011. URL consultato il 7 luglio 2012.
- ^ (EN) Dubochet J, Adrian M, Richter K, Garces J, Wittek R, Structure of intracellular mature vaccinia virus observed by cryoelectron microscopy, in J. Virol., vol. 68, n. 3, 1994, pp. 1935–41, PMC 236655, PMID 8107253.
- ^ a b Fields, Knipe e Howley, pp. 2905–2946.
- ^ Fields, Knipe e Howley, pp. 2947–2976.
- ^ a b c d e f g h i j k l m n o p q r s t u v (EN) Atkinson W, Hamborsky J, McIntyre L, Wolfe S (eds.), Smallpox (PDF), in Epidemiology and Prevention of Vaccine-Preventable Diseases (The Pink Book), 9ª ed., Washington DC, Public Health Foundation, 2005, pp. 281–306 (archiviato dall'url originale il 9 aprile 2010).
- ^ a b (EN) CDC Smallpox, su Smallpox Overview. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 2 aprile 2013).
- ^ (EN) Henderson DA, Parker G, Perl T, Inglesby TV, Bartlett JC et al., Smallpox as a biological weapon: medical and public health management. Working Group on Civilian Biodefense, in JAMA, vol. 281, n. 22, 1999, pp. 2127–37, DOI:10.1001/jama.281.22.2127, PMID 10367824.
- ^ (EN) Ayyagari Ramachandra Rao, Smallpox, Bombay, Kothari Book Depot, 1972.
- ^ a b (EN) Hogan CJ, Harchelroad F, CBRNE – Smallpox, su eMedicine. URL consultato il 7 luglio 2012.
- ^ a b c d (EN) Smallpox Disease and Its Clinical Management (PDF), su dal corso di formazione denominato "Smallpox: Disease, Prevention, and Intervention". URL consultato il 7 luglio 2012 (archiviato dall'url originale il 10 maggio 2016).
- ^ Si tratta di pustole confluenti quando la loro dimensione e numerosità è tale che queste si toccano tra loro, convergendo e apparendo come un liquido che cola.
- ^ a b c d e f g h i Fenner.
- ^ a b Vassil St. Georgiev, National Institute of Allergy and Infectious Diseases, NIH: Impact on Global Health, 2º, Springer, 2009, pp. 229, ISBN 978-1-60327-296-4.
- ^ a b (EN) Richard Preston, A reporter at large: Demon in the Freezer, su cryptome.org, The New Yorker, 12 luglio 1999. URL consultato il 7 luglio 2012.
- ^ (EN) Riedel S, Smallpox and biological warfare: a disease revisited, in Proc (Bayl Univ Med Cent), vol. 18, n. 1, gennaio 2005, pp. 13–20, PMC 1200695, PMID 16200143.
- ^ (EN) Smallpox: Current, comprehensive information on pathogenesis, microbiology, epidemiology, diagnosis, treatment, and prophylaxis, su cidrap.umn.edu, Center for Infectious Disease Research & Policy. URL consultato il 7 luglio 2012.
- ^ (EN) LeDuc JW, Jahrling PB, Strengthening national preparedness for smallpox: an update, in Emerging Infect. Dis., vol. 7, n. 1, 2001, pp. 155–7, DOI:10.3201/eid0701.010125, PMC 2631676, PMID 11266310.
- ^ (EN) Bourzac K, Smallpox: Historical Review of a Potential Bioterrorist Tool, in Journal of Young Investigators, vol. 6, n. 3, 2002. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 1º novembre 2012).
- ^ (EN) Pankhurst R., The history and traditional treatment of smallpox in Ethiopia. (PDF), in Med Hist., vol. 9, n. 4, ottobre 1965, pp. 343-55, PMID 5323754. URL consultato il 6 novembre 2010.
- ^ (EN) Dominik Wujastyk, "Medicine in India" in Oriental Medicine: An Illustrated Guide to the Asian Arts of Healing, Londra, Serindia Publications, 1995, pp. 29, ISBN 0-906026-36-9.
- ^ (EN) Robert Temple, The Genius of China: 3,000 Years of Science, Discovery, and Invention, New York, Simon and Schuster, Inc., 1986, pp. 135–7, ISBN 0-671-62028-2.
- ^ (EN) Modern History Sourcebook: Lady Mary Wortley Montagu (1689–1762): Smallpox Vaccination in Turkey, su fordham.edu. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 4 dicembre 2010).
- ^ (EN) Frequently Asked Questions About Smallpox Vaccine, su bt.cdc.gov, Centers for Disease Control and Prevention, Ultima revisione del 7 febbraio 2007. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 16 novembre 2015).
- ^ a b c (EN) Vaccine Overview (PDF), su Smallpox Fact Sheet. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 2 gennaio 2008).
- ^ (EN) Mack TM, Smallpox in Europe, 1950–1971, in J. Infect. Dis., vol. 125, n. 2, 1972, pp. 161–9, DOI:10.1093/infdis/125.2.161, PMID 5007552.
- ^ (EN) Pütz MM, Alberini I, Midgley CM, Manini I, Montomoli E, Geoffrey L. Smith, Prevalence of antibodies to Vaccinia virus after smallpox vaccination in Italy, in J. Gen. Virol., vol. 86, n. 11, 2005, pp. 2955–60, DOI:10.1099/vir.0.81265-0, PMID 16227216. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 12 febbraio 2009).
- ^ a b Fenner, pp. 31, 125.
- ^ (EN) Bray M, Roy CJ, Antiviral prophylaxis of smallpox, in J. Antimicrob. Chemother., vol. 54, n. 1, 2004, pp. 1–5, DOI:10.1093/jac/dkh286, PMID 15163655.
- ^ (EN) Esposito JJ, Sammons SA, Frace AM, et al., Genome sequence diversity and clues to the evolution of variola (smallpox) virus, in Science, vol. 313, n. 5788, agosto 2006, pp. 807–12, DOI:10.1126/science.1125134, PMID 16873609.
- ^ a b (EN) Li Y, Carroll DS, Gardner SN, Walsh MC, Vitalis EA, Damon IK, On the origin of smallpox: correlating variola phylogenics with historical smallpox records, in Proc Natl Acad Sci USA, vol. 104, n. 40, 2007, pp. 15787-15792.
- ^ a b (EN) Spaeth GL, Reversibility of optic disc cupping. A phenomenon that may change the management of glaucoma, in Arch. Ophthalmol., vol. 107, n. 11, novembre 1989, pp. 1583–4, PMID 2818276.
- ^ (EN) Shchelkunov SN, Emergence and reemergence of smallpox: the need for development of a new generation smallpox vaccine, in Vaccine, 29 Suppl 4, dicembre 2011, pp. D49–53, DOI:10.1016/j.vaccine.2011.05.037, PMID 22185833.
- ^ (EN) Herbert M. Shelton, Vaccine and Serum Evils, Health Research Books, 1996, p. 5, ISBN 1-85810-029-1.
- ^ a b c (EN) Hopkins DR, The Greatest Killer: Smallpox in history, University of Chicago Press, 2002, ISBN 0-226-35168-8. originariamente pubblicato come Princes and Peasants: Smallpox in History (1983), ISBN 0-226-35177-7
- ^ (EN) Horst R. Thieme, Mathematics in population biology, Princeton University Press, 2003, ISBN 0-691-09291-5.
- ^ (EN) Donald Henderson, Richard Preston, Smallpox- the Death of a Disease: The Inside Story of Eradicating a Worldwide Killer, 1ª ed., Prometheus Books, 23 giugno 2009, pp. 334, ISBN 1-59102-722-5.
- ^ (EN) Cyril William Dixon, Smallpox, Londra, Churchill, 1962, ISBN 0-7000-1124-2.
- ^ Conclusione di H. Haeser, in Lehrbuch der Geschichte der Medicin und der epidemischen Krankenheiten III:24–33 (1882), seguita da Zinsser 1996.
- ^ (EN) Past pandemics that ravaged Europe, su news.bbc.co.uk, BBC News, 7 novembre 2005. URL consultato l'8 luglio 2012.
- ^ (EN) Harminder S. Dua, Ahmad Muneer Otri, Arun D. Singh, Abu Bakr Razi, in British Journal of Ophthalmology, vol. 92, BMJ Group, 2008, p. 1324.
- ^ (EN) Frederick E. Hoxie, Encyclopedia of North American Indians[collegamento interrotto], 1996, pp. 164, ISBN 0-395-66921-9.
- ^ (EN) Arthur C. Aufderheide, Conrado Rodríguez-Martín, Odin Langsjoen, The Cambridge encyclopedia of human paleopathology, Cambridge University Press, 1998, pp. 205, ISBN 0-521-55203-6.
- ^ (EN) Ian Glynn, Jenifer Glynn, The life and death of smallpox, Cambridge University Press, 2004, pp. 145, ISBN 0-521-84542-4.
- ^ (EN) Rafael E. Tarrago, The Balmis-Salvany Smallpox Expedition: The First Public Health Vaccination Campaign in South America, su paho.org, 2001. URL consultato l'8 luglio 2012.
- ^ (EN) Smallpox History: Other histories of smallpox in South Asia, su smallpoxhistory.ucl.ac.uk, 18 luglio 2006. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 16 aprile 2012).
- ^ Naono.
- ^ (EN) Indian Health Program - Capitolo 3, su ihs.gov, Indian Health Service. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 14 luglio 2015).
- ^ (EN) Nadja Durbach, Bodily Matters: The Anti-Vaccination Movement in England, 1853–1907, Duke University Press, ISBN 0-8223-3423-2.
- ^ (EN) C.V. Chapin, Variation in type of infectious disease as shown by the history of smallpox in the United States 1895–1912, in Infect Dis, vol. 13, n. 2, 1913, pp. 171–196, DOI:10.1093/infdis/13.2.171.
- ^ a b c (EN) Walter A. Orenstein, Stanley A. Plotkin, Vaccines, Philadelphia, W.B. Saunders Co, 1999, ISBN 0-7216-7443-7.
- ^ (EN) Rodrigues BA, Smallpox eradication in the Americas, in Bull Pan Am Health Organ, vol. 9, n. 1, 1975, pp. 53–68, PMID 167890.
- ^ Fenner, pp. 366–418.
- ^ (EN) Holland WW, Karel Raska: The development of modern epidemiology. The role of the IEA (PDF), in Cent. Eur. J. Public Health, vol. 18, n. 1, marzo 2010, pp. 57–60, PMID 20586233. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 29 marzo 2013).
- ^ (EN) BBC History - Smallpox: Eradicating the Scourge, su bbc.co.uk. URL consultato l'8 luglio 2012.
- ^ (EN) Centers for Disease Control and Prevention (CDC), International Notes: Quarantine Measures Smallpox—Stockholm, Sweden, 1963, in MMWR, vol. 45, n. 25, 1996, pp. 538–45, PMID 9132571.
- ^ (EN) William Grimes, Frank Fenner Dies at 95, su NYTimes.com, 8 luglio 2012. URL consultato il 27 novembre 2010.
- ^ (EN) Frank Fenner, Nature, Nurture and Chance: The Lives of Frank and Charles Fenner, Canberra, Australian National University Press, 2006, ISBN 1-920942-62-9.
- ^ a b (EN) Pennington H, Smallpox and bioterrorism, in Bull. World Health Organ., vol. 81, n. 10, 2003, pp. 762–7, DOI:10.1590/S0042-96862003001000014, PMC 2572332, PMID 14758439.
- ^ (EN) World Health Organization, WHO establishing smallpox vaccine reserve, su who.int, 25 maggio 2005. URL consultato l'8 luglio 2012.
- ^ (EN) Lawrence Altman, Final Stock of the Smallpox Virus Now Nearer to Extinction in Labs, su nytimes.com, New York Times, 25 gennaio 1996. URL consultato l'8 luglio 2012.
- ^ (EN) Debora MacKenzie, Stay of execution, su newscientist.com, New Scientist, 26 gennaio 2002. URL consultato l'8 luglio 2012.
- ^ (EN) Edward Hammond, Should the US and Russia destroy their stocks of smallpox virus?, in BMJ, vol. 334, n. 7597, 2007, p. 774, DOI:10.1136/bmj.39155.695255.94, PMC 1851992, PMID 17431261.
- ^ (EN) John O. Agwunobi, Should the US and Russia destroy their stocks of smallpox virus?, in BMJ, vol. 334, n. 7597, 2007, p. 775, DOI:10.1136/bmj.39156.490799.BE, PMC 1851995, PMID 17431262.
- ^ (EN) Advisory Group of Independent Experts to review the smallpox research program (AGIES), Comments on the Scientific Review of Variola Virus Research, 1999‐2010, su who.int. URL consultato l'8 luglio 2012.
- ^ (EN) Michael J. Lane, Gregory A. Poland, Why not destroy the remaining smallpox virus stocks? (PDF), in Vaccine, vol. 29, n. 16, Elsevier, 2011, pp. 2823–2824, DOI:10.1016/j.vaccine.2011.02.081, PMID 21376120.
- ^ (EN) Howard Henry Peckham, Pontiac and the Indian Uprising, Wayne State University Press, 1947, pp. 226, ISBN 0-8143-2469-X.
- ^ Fred Anderson, Crucible of War: The Seven Years' War and the Fate of Empire in British North America, 1754-1766, Vintage Books, id=ISBN 0-375-70636-4, pp. 542.
- ^ (EN) (EN) John Grenier, The First Way of War, Cambridge University Press, 2005, pp. 144, ISBN 978-0-521-84566-3.
- ^ (EN) William Nester, Haughty Conquerors: Amherst and the Great Indian Uprising of 1763, Greenwood Publishing Group, 2000, pp. 114–15, ISBN 0-275-96770-0.
- ^ (EN) BBC History: Silent Weapon: Smallpox and Biological Warfare, su bbc.co.uk. URL consultato l'8 luglio 2012.
- ^ (EN) Elizabeth A. Fenn, Biological Warfare in Eighteenth-Century North America: Beyond Jeffery Amherst, in The Journal of American History, vol. 86, n. 4, marzo 2000, pp. 1552–1580 (archiviato dall'url originale il 3 aprile 2015).
- ^ (EN) USAMRIID's Medical Management of Biological Casualties Handbook (PDF), su usamriid.army.mil. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 9 febbraio 2015).
- ^ (EN) BBC History: Silent Weapon: Smallpox and Biological Warfare, su bbc.co.uk. URL consultato l'8 luglio 2012.
- ^ (EN) Kenneth Alibek, Handelman S, Biohazard: The Chilling True Story of the Largest Covert Biological Weapons Program in the World Told from Inside by the Man Who Ran It, New York, Delta, 1999, ISBN 0-385-33496-6.
- ^ (EN) Shoham D, Wolfson Z, The Russian biological weapons program: vanished or disappeared?, in Crit. Rev. Microbiol., vol. 30, n. 4, 2004, pp. 241–61, DOI:10.1080/10408410490468812, PMID 15646399.
- ^ a b Preston, pp. 105–115.
- ^ (EN) Ken Alibek, Steven Handelman, Biohazard: The Chilling True Story of the Largest Covert Biological Weapons Program in the World - Told from Inside by the Man Who Ran It, Random House, 1999, ISBN 0-385-33496-6.
- ^ (EN) History and Epidemiology of Global Smallpox Eradication (PDF), su bt.cdc.gov. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 15 luglio 2007).
- ^ (EN) Oliver Burkeman, No evidence of smallpox, su guardian.co.uk, 19 settembre 2003. URL consultato l'8 luglio 2012.
- ^ (EN) The Genetic Engineering of Smallpox. WHO’s Retreat from the Eradication of Smallpox Virus and Why it Should be Stopped (PDF), su biosafety-info.net, 2002. URL consultato l'8 luglio 2012 (archiviato dall'url originale il 3 marzo 2016).
- ^ a b Vaiolo - Portale dell'epidemiologia per la sanità pubblica a cura del Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute, su epicentro.iss.it. URL consultato l'8 luglio 2012.
Bibliografia
[modifica | modifica wikitesto]- (EN) Sanjoy Bhattacharya, Expunging variola: the control and eradication of smallpox in India, 1947–1977, Hyderabad, Orient Longman, 2006, ISBN 81-250-3018-2.
- (EN) Frank Fenner, Smallpox and its Eradication (History of International Public Health, No. 6) (PDF), Geneva, World Health Organization, 1988, ISBN 92-4-156110-6.
- (EN) B. N. Fields, D. M. Knipe, P. M. Howley (a cura di), Fields Virology, Vol. 2, 5ª ed., Filadelfia, Lippincott-Raven, 2006, ISBN 0-7817-6060-7.
- T. R. Harrison, Principi di medicina interna, 16ª ed., Milano, McGraw-Hill, 2005, ISBN 88-386-2999-4.
- (EN) David A. Koplow, Smallpox: the fight to eradicate a global scourge, Berkeley, University of California Press, 2003, ISBN 0-520-24220-3.
- (EN) William Hardy McNeill, Plagues and Peoples, Oxford, Basil Blackwell, 1977, ISBN 0-385-12122-9.
- Patrick R. Murray, Ken S. Rosenthal e Michael A. Pfaller, Microbiologia, Napoli, EdiSES, 2007, ISBN 88-7959-262-9.
- (EN) Atsuko Naono, State of Vaccination: The Fight Against Smallpox in Colonial Burma, Hyderabad, Orient Blackswan, 2009, ISBN 978-81-250-3546-6.
- (EN) Richard Preston, The Demon in the Freezer: A True Story, New York, Random House, 2003, ISBN 0-345-46663-2.
- R. L. Robbins, R. S. Cotran, V. Eusebi, A. K. Abbas, V. Kumar, J. A. Perkins, N. Fausto, Le basi patologiche delle malattie, Milano, Elsevier Italia, 2006, ISBN 88-85675-53-0.
- (EN) Jonathan B. Tucker, Scourge: The Once and Future Threat of Smallpox, New York, Grove Press, 2001, ISBN 0-8021-3939-6.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni sul vaiolo
Wikiquote contiene citazioni sul vaiolo Wikizionario contiene il lemma di dizionario «vaiolo»
Wikizionario contiene il lemma di dizionario «vaiolo» Wikimedia Commons contiene immagini o altri file sul vaiolo
Wikimedia Commons contiene immagini o altri file sul vaiolo Wikispecies contiene informazioni sul vaiolo
Wikispecies contiene informazioni sul vaiolo
Collegamenti esterni
[modifica | modifica wikitesto]- (IT, DE, FR) Vaiolo, su hls-dhs-dss.ch, Dizionario storico della Svizzera.
- (EN) smallpox, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN, FR) Vaiolo, su Enciclopedia canadese.
- La storia del vaiolo, su pediatria.it.
- Immagini di vaiolo e sinossi diagnostica, su logicalimages.com. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 29 luglio 2008).
- Genoma del Variola Virus, su poxvirus.org. URL consultato il 7 luglio 2012 (archiviato dall'url originale il 12 settembre 2015).
- Poxviridae sul Virus Pathogen Database and Analysis Resource (ViPR), su viprbrc.org.
| Controllo di autorità | Thesaurus BNCF 43162 · LCCN (EN) sh85123612 · GND (DE) 4135714-0 · BNF (FR) cb11962556k (data) · J9U (EN, HE) 987007548512305171 · NDL (EN, JA) 00573369 |
|---|


