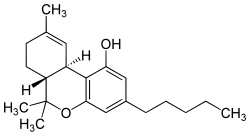
Delta-9-tetraidrocannabinolo

| Delta-9-tetraidrocannabinolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| (6aR,10aR)-6,6,9-trimetil-3-pentil-6a,7,8,10a-tetraidro-6H-benzo[c]cromen-1-olo | |
| Abbreviazioni | |
| THC | |
| Nomi alternativi | |
| Tetraidrocannabinolo Δ⁹-THC | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H30O2 |
| Massa molecolare (u) | 314.47 |
| Aspetto | olio viscoso marroncino sotto forma di cristalli |
| Numero CAS | |
| Numero EINECS | 625-153-6 |
| PubChem | 16078 |
| DrugBank | DB00470 |
| SMILES | CCCCCC1=CC2=C(C3C=C(CCC3C(O2)(C)C)C)C(=C1)O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 0.0028 g/L a 23 °C |
| Temperatura di ebollizione | 180 °C circa (453,15 K) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1270 |
| Indicazioni di sicurezza | |
Il delta-9-tetraidrocannabinolo (detto comunemente THC, Δ⁹-THC o tetraidrocannabinolo) è uno dei maggiori e più noti principi attivi della cannabis e può essere considerato il capostipite della famiglia dei fitocannabinoidi.
Sono noti vari isomeri del THC, due dei quali presenti naturalmente nella cannabis. Il più rilevante è l'isomero (-)-trans, noto farmacologicamente come dronabinol.[1][2][3][4]
È una sostanza psicotropa prodotta dai fiori di cannabis, può essere ingerito, fumato o inalato grazie ad un vaporizzatore. Presenta effetti analgesici, stimolanti e psichedelici, soprattutto se assunta ad un dosaggio superiore ai 100mg inalata per combustione. Le sostanze psicoattive affini ai recettori cannabinoidi come il JWH-018 presentano un più marcato effetto psichedelico rispetto al THC. Per via della sua struttura simile ad una triptammina come per antonomasia la dimetiltriptamina. Con proprietà antidolorifiche (Es: farmaci contenenti THC come il Sativex o il Bedrocan, sono usati per il trattamento del dolore), euforizzante, antinausea, antiemetico, anticinetosico, stimolante l'appetito, che abbassa la pressione endooculare.[5]
È stato isolato da Raphael Mechoulam, Yechiel Gaoni, e Habib Edery dall'istituto Weizmann, Israele, nel 1964. In forma pura, a basse temperature, è un solido cristallino, di color leggermente rosa[6], con una transizione vetrosa che lo rende viscoso e appiccicoso se riscaldato. Commercialmente il THC si presenta in soluzione come un liquido oleoso giallo/marrone.[7][8] Il THC ha una bassissima solubilità in acqua, ma buona solubilità nella maggior parte dei solventi organici.
Biosintesi nella cannabis[modifica | modifica wikitesto]
Il THC non è biosintetizzato nella cannabis. Nella pianta è presente soprattutto come artefatto prodotto dalla decarbossilazione non enzimatica dell'acido tetraidrocannabinolico (Δ⁹-THCA) accelerata dalla essicazione dei tricomi ghiandolari delle inflorescenze.[9]
Il percorso anabolico che porta alla formazione del tetraidrocannabinolo nella cannabis sativa è in gran parte in comune con quello del cannabidiolo (CBD). Il cannabigerolato è il precursore, attraverso una diversa reazione enzimatica, dell'acido cannabinolico (CBDa) da cui deriva il CBD.
La decarbossilazione di CBDa e THCa viene spontaneamente accelerata per azione della luce e/o del calore.
CBDa e THCa, provenendo dallo stesso intermedio, sono complementari; pertanto nelle varietà di cannabis a basso tenore di THC il cannabidiolo è il principale cannabinoide estraibile, al contrario delle varietà ad alto tenore di THC dove il THC è il cannabinoide principale.[10]
| Enzima | Precursore, intermedio e reazione | |
|---|---|---|
| 3,5,7-triossododecanoil-CoA sintasi | malonil-CoA | |
| ↘ | ↓ | |
| 3 malonil-CoA + esanoil-CoA 3 CoA + 3,5,7-triossodecanoil-CoA + 3 CO2 | ||
| ↓ | ||
| ciclasi dell'acido olivetolico | 3,5,7-triossodecanoil-CoA | |
| ↘ | ↓ | |
| 3,5,7-triossodecanoil-CoA ⇔ CoA + 2,4-diidrossi-6-pentilbenzoato | ||
| ↓ | ||
| geranil-difosfato:olivetolato geraniltransferasi | 2,4-diidrossi-6-pentilbenzoato (acido olivetolico) | |
| ↘ | ↓ | |
| Geranil difosfato + 2,4-diidrossi-6-pentilbenzoato ⇔ difosfato + cannabigerolato | ||
| ↓ | ||
| sintasi dell'acido tetraidrocannabidiolico | Cannabigerolato (acido cannabigerolico) | |
| ↘ | ↓ | |
| Cannabigerolato + O2 ⇔ Acido tetraidrocannabidiolico + H2O2 | ||
| ↓ | ||
| Acido teraidrocannabidiolico | ||
| ↓ | ||
| Acido tetraidrocannabidiolico ⇔ Tetraidrocannabidiolo + CO2 | ||
| ↓ | ||
| Tetraidrocannabidiolo |
I cannabinoidi condividono un percorso iniziale comune: la tetraketide sintasi (TKS)[11], una polichetide sintasi (PKS) di tipo III, catalizza la condensazione sequenziale dell'esanoil-CoA con tre molecole di malonil-CoA per produrre 3 ,5,7-triossododecaneoil-CoA . Questo viene ciclizzato e aromatizzato, con la perdita del coenzima A, ad opera dell'acido olivetolico ciclasi (OAC), in acido olivetolico (OLA).[12] La preniltransferasi aromatica inserisce quindi il gruppo prenilico nella posizione altamente nucleofila del 2-resorcinolo per fornire acido cannabigerolico (CBGa).[13] Questo intermedio centrale poi diverge per fornire gli acidi cannabinolici (THCa, CBDa e CBCa) che procedono, esposti a calore, a THC, CBD e CBC mediante decarbossilazione non enzimatica.[14][15]
Il cannabinolo è un ulteriore artefatto prodotto dalla degradazione del THC.[16] Dalla concentrazione di cannabinolo alcuni studi ritengono si possa stimare l'età delle inflorescenze di cannabis.[17]
Farmacologia[modifica | modifica wikitesto]
Le azioni farmacologiche del THC risultano dal suo legame con i recettori cannabinoidi CB1, e CB2, che si trovano principalmente nel sistema nervoso centrale, e nel sistema immunitario. Esso agisce come un parziale ligando agonista su entrambi i recettori, cioè, li attiva ma non per intero. La presenza di questi recettori specializzati nel cervello fece presupporre agli scienziati che cannabinoidi endogeni vengono prodotti naturalmente dal corpo umano, si scoprirono infatti numerosi endocannabinoidi tra cui l'Anandamide, l'Arachidonoilglicerolo (2-AG) la Virodamina e molti altri.

Meccanismo d'azione[modifica | modifica wikitesto]
Il THC ha un'alta affinità come agonista del recettore cannabinoide cb1 e cb2. L'attivazione del primo suddetto, che si trova espresso in grande quantità nel SNC, anche e soprattutto nel circuito mesolimbico causa il rilascio di dopamina nel nucleus accumbens e genera la tipica sensazione di piacere cannabinoide. Può provocare nella persona sensazioni di euforia, rilassamento, percezione spazio-temporale alterata; alterazioni uditive, olfattive e visive, ansia, disorientamento, stanchezza, e stimolazione dell'appetito. Il legame dei cannabinoidi ai recettori CB1 causa una inibizione presinaptica della ricaptazione di vari neurotrasmettitori (in particolare dopamina e glutammato), e una stimolazione delle aree della sostanza grigia periacqueduttale (PAG) e del midollo rostrale ventromediale (RVM), che a loro volta inibiscono le vie nervose ascendenti del dolore. A livello del midollo spinale il legame dei cannabinoidi ai recettori CB1 causa una inibizione delle fibre afferenti a livello del corno dorsale, e a livello periferico il legame dei cannabinoidi con i recettori CB1 e CB2 causa una riduzione della secrezione di vari prostanoidi e citochine proinfiammatorie, l'inibizione della sostanza P e pertanto del segnale doloroso. Il meccanismo per la stimolazione dell'appetito si crede sia il risultato di attività del THC nell'asse ipotalamico-gastroenterico. L'attività del CB1 nei centri della fame dell'ipotalamo aumenta l'appetibilità del cibo quando i livelli dell'ormone della fame grelina aumentano in seguito all'entrata di cibo nello stomaco.
Aspetti tossicologici[modifica | modifica wikitesto]
Fino ad oggi, non vi è mai stata una fatalità umana documentata da sola overdose di tetraidrocannabinolo o cannabis.[18] La valutazione della pericolosità del THC nei confronti dell'uomo è largo oggetto di dispute non solo scientifiche, ma anche politiche e ideologiche. Secondo il Merck[19], la LD50 del tetraidrocannabinolo è di 1270 mg/Kg di peso vivo se somministrata per via orale (veicolato in olio di sesamo) nei ratti maschi e di 730 mg/Kg nei ratti femmine; la dose scende a 482 mg/Kg di peso vivo se somministrato per inalazione[20]. Tale valore è ritenuto molto alto, tale da considerare la tossicità acuta del THC molto bassa rispetto ad altre sostanze psicotrope o farmaci, se non altro anche solo per la impraticabilità di una tale somministrazione attraverso cannabis: si pensi che la media della concentrazione di principio attivo nelle sostanze di consumo diffuse oggi è di 15%,[senza fonte] con picchi attorno ai 30%: 10 grammi di prodotto contengono quindi in media 1,5 g di THC, ovvero 1500 mg. Considerando un umano di 70 kg, servirebbero 482x70=33740 mg di principio attivo, dunque più o meno 225 grammi di prodotto. Uno "spinello" si prepara normalmente con 0,5 grammi di sostanza:[senza fonte] servirebbero 450 spinelli per raggiungere l'assunzione della Dose Letale, ma il tempo necessario all'assunzione di una tale spropositata quantità comporterebbe una metabolizzazione del principio attivo assunto in precedenza, rendendo impossibile[21] una overdose. Per questo motivo le legislazioni dei diversi Paesi valutano i fitocannabinoidi con approcci differenti, con conseguenti divergenze in sede normativa. Alcuni studi condotti, relativi all'assimilazione del THC, concludono che la sostanza induca la perdita di neuroni nell'ippocampo, area del cervello responsabile della fissazione della memoria da breve a lungo termine[22][23]; numerosi altri studi hanno dimostrato le capacità neuroprotettive e antinfiammatorie del THC[24][25][26][27][28]
A favore della prima tesi (cioè quella che sostiene provochi danni all'ippocampo), in uno studio in vivo[29] ratti esposti a THC ogni giorno per 8 mesi (approssimativamente 30% della loro aspettativa di vita), esaminati a 11 o 12 mesi di età, dimostravano una perdita di cellule nervose equivalente ad animali con il doppio della loro età.[30]
Vi sono inoltre alcuni studi clinici che dimostrano la correlazione tra la presenza di significativi danni cerebrali e cognitivi e l'assunzione di THC, senza però potere, in via definitiva, postulare una causalità, data la presenza di numerosi effetti di interazione con altri fattori, che sovrastano l'effetto semplice del solo THC.[22][31][32][33][34][35]
A favore della seconda tesi uno studio in vitro, effettuato su neuroni di ratto, ha mostrato che il cannabinoide HU210 è immunoreattivo col recettore CB1 per i cannabinoidi, portando gli autori ad ipotizzare che possa avere un ruolo nella proliferazione neuronale. Tale ipotesi è supportata dall'osservazione che il cannabinoide HU210 stimola la proliferazione (ma non la differenziazione) di cellule neuronali embrionali di ratto in vitro.[36] Un altro studio ha dimostrato in maniera precisa come il CBD e il THC abbiano effetti neuroprotettivi su cellule neuronale corticali[37]. Ulteriori studi hanno portato all'attenzione degli ambienti scientifici l'effetto del THC su umani, in relazione a malattie neurodegenerative come Alzheimer e Parkinson[38][39], come illustrato nella sezione successiva.
Utilizzo terapeutico[modifica | modifica wikitesto]


Al di là delle accese discussioni e controversie sociali e politiche sull'uso della canapa come stupefacente, va considerato che essa è stata per migliaia di anni un'importante pianta medicinale.[40] Sono oggi in commercio in diversi paesi farmaci a base di THC, di altri fitocannabinoidi o di cannabinoidi sintetici.
Potenziali campi di utilizzo terapeutico dei derivati della cannabis:[41]
- nausea e vomito in chemioterapia
- stimolazione appetito nell'AIDS
- sclerosi multipla
- terapia del dolore
- traumi cerebrali / ictus
- sindrome di Tourette
- cancro al cervello, alla prostata, al seno, ai polmoni
- leucemia
- artrite reumatoide
- malattie infiammatorie croniche intestinali (malattia di Crohn, colite ulcerosa)
- glaucoma
- epilessia
Altre indicazioni potenziali:
- allergie
- anti-tumorale
- asma bronchiale
- malattie autoimmuni (lupus eritematoso, ...)
- malattie neurodegenerative (malattia di Alzheimer, corea di Huntington, malattia di Parkinson)
- patologie cardiovascolari (aterosclerosi, ipertensione arteriosa)
- sindromi ansioso-depressive
- sindromi da astinenza nelle dipendenze da sostanze
- spasticità nelle lesioni midollari (tetraplegia, paraplegia)
Si stanno testando nel mondo farmaci che contengono una versione sintetica di alcuni dei principi attivi della cannabis (dronabinol, HU-210, levonantradolo, nabilone, SR 141716 A, Win 55212-2).
Il Dronabinol è il termine registrato INN della variante stereochimica del THC. È un prodotto della Unimed Pharmaceuticals, Inc.[42] ed è commercializzato negli USA come Marinol, ma è disponibile anche nell'Unione europea come farmaco generico (Dronabinol). Il farmaco è registrato, a partire dal 1985, per il trattamento della nausea e del vomito nei pazienti in chemioterapia antitumorale e per la stimolazione dell'appetito nei pazienti con sindrome da deperimento da AIDS.
Il Canada, il 20 giugno 2005, è stato il primo paese ad autorizzare la messa in commercio di un estratto totale di Cannabis sotto forma di spray sublinguale Sativex standardizzato per THC e CBD, per il trattamento del dolore neuropatico dei malati di sclerosi multipla e cancro. Nel 2006 il Sativex è stato approvato negli Stati Uniti per essere sottoposto a studi clinici di Fase III per dolore intrattabile in pazienti con tumore.
In Italia nel 2010 il Senato ha concesso l'autorizzazione per una produzione di farmaci a base di cannabinoidi. Fino ad allora tutti i farmaci a base di cannabis venivano comprati da stati esteri.[43][44][45] Nel 2014, l'azienda Farmalabor è stata autorizzata dal Ministero della Salute al commercio all'ingrosso di preparazioni vegetali a base di cannabis. I prodotti sono venduti a farmacie private e ospedaliere per l'allestimento di preparazioni magistrali su prescrizione del medico[46].
Farmaci cannabinoidi[modifica | modifica wikitesto]
- Dronabinol, cannabinoide sintetico, variante stereochimica del THC
- CP 47,497, cannabinoide sintetico
- HU-210, cannabinoide sintetico
- HU-308, cannabinoide sintetico
- JWH-018, cannabinoide sintetico
- Levonantradolo, cannabinoide sintetico
- Nabilone, cannabinoide sintetico, variante del THC
- Sativex, Spray orale a base alcolica contenente THC e CBD
- Cannabidiolo, (CBD), prodotto naturalmente nel fiore di cannabis
- Tetraidrocannabinolo, (THC), prodotto naturalmente nel fiore di cannabis
Presenza del THC[modifica | modifica wikitesto]
Il contenuto di THC nella marijuana (Cannabis sativa) è nell'ordine di 0,5-1% nelle foglie grandi, 1-3% nelle foglie piccole, variabile nei fiori dal 10 al 27%, 5-10% nelle brattee, 10-60% nell'hashish, oltre il 60% fino a 99% nell'olio di hashish. Come si può notare, esso è presente all’interno dei tricomi, per cui la concentrazione è maggiore, per quanto riguarda la pianta viva, nell’area delle infiorescenze ed è ancora più elevata nel caso di prodotti a base di estrazione della resina.
Il contenuto di THC di hashish e marijuana tende a diminuire con il tempo, un processo accelerato dal calore e dalla luce. Le foglie e la resina di canapa conservate in condizioni normali perdono rapidamente la loro attività e possono diventare completamente inattive dopo 2 anni.
- Struttura stereochimica del THC
- Animazione tridimensionale del THC
Note[modifica | modifica wikitesto]
- ^ UNODC - Bulletin on Narcotics - 1968 Issue 2 - 009, su unodc.org. URL consultato il 23 gennaio 2019.
- ^ (EN) Leo E. Hollister, Tetrahydrocannabinol Isomers and Homologues: Contrasted Effects of Smoking, in Nature, vol. 227, n. 5261, 1970-08, pp. 968–969, DOI:10.1038/227968a0. URL consultato il 23 gennaio 2019.
- ^ (EN) Pubchem, Dronabinol, su pubchem.ncbi.nlm.nih.gov. URL consultato il 23 gennaio 2019.
- ^ (EN) G. Mazzoccanti, O. H. Ismail e I. D’Acquarica, Cannabis through the looking glass: chemo- and enantio-selective separation of phytocannabinoids by enantioselective ultra high performance supercritical fluid chromatography, in Chemical Communications, vol. 53, n. 91, 2017, pp. 12262–12265, DOI:10.1039/C7CC06999E. URL consultato il 2 maggio 2019.
- ^ Cannabis: Proprietà chimico-farmacologiche
- ^ Compositions comprising crystalline trans-(+/-)-delta-9-tetrahydrocannabinol, 14 giugno 2006. URL consultato il 23 gennaio 2019.
- ^ Michael Williams, The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 15th Edition Edited by M.J.O'Neil, Royal Society of Chemistry, Cambridge, UK ISBN 9781849736701; 2708 pages. April 2013, $150 with 1-year free access to The Merck Index Online., in Drug Development Research, vol. 74, n. 5, 3 luglio 2013, pp. 339–339, DOI:10.1002/ddr.21085. URL consultato il 23 gennaio 2019.
- ^ 1-TRANS-DELTA-9-TETRAHYDROCANNABINOL | CAMEO Chemicals | NOAA, su cameochemicals.noaa.gov. URL consultato il 23 gennaio 2019.
- ^ M. Nazir Tahir, Fred Shahbazi e Simon Rondeau-Gagné, The biosynthesis of the cannabinoids, in Journal of Cannabis Research, vol. 3, n. 1, 15 marzo 2021, p. 7, DOI:10.1186/s42238-021-00062-4. URL consultato il 29 dicembre 2023.
- ^ M. Nazir Tahir, Fred Shahbazi e Simon Rondeau-Gagné, The biosynthesis of the cannabinoids, in Journal of Cannabis Research, vol. 3, 15 marzo 2021, p. 7, DOI:10.1186/s42238-021-00062-4. URL consultato il 29 dicembre 2023.
- ^ Lewis J. Kearsey, Nicole Prandi e Vijaykumar Karuppiah, Structure of the Cannabis sativa olivetol‐producing enzyme reveals cyclization plasticity in type III polyketide synthases, in The Febs Journal, vol. 287, n. 8, 2020-4, pp. 1511–1524, DOI:10.1111/febs.15089. URL consultato il 29 dicembre 2023.
- ^ Steve J. Gagne, Jake M. Stout e Enwu Liu, Identification of olivetolic acid cyclase from Cannabis sativa reveals a unique catalytic route to plant polyketides, in Proceedings of the National Academy of Sciences of the United States of America, vol. 109, n. 31, 31 luglio 2012, pp. 12811–12816, DOI:10.1073/pnas.1200330109. URL consultato il 29 dicembre 2023.
- ^ M. Fellermeier e M. H. Zenk, Prenylation of olivetolate by a hemp transferase yields cannabigerolic acid, the precursor of tetrahydrocannabinol, in FEBS letters, vol. 427, n. 2, 8 maggio 1998, pp. 283–285, DOI:10.1016/s0014-5793(98)00450-5. URL consultato il 29 dicembre 2023.
- ^ Monika Fellermeier, Wolfgang Eisenreich e Adelbert Bacher, Biosynthesis of cannabinoids Incorporation experiments with 13C-labeled glucoses, in European Journal of Biochemistry, vol. 268, n. 6, 2001-03, pp. 1596–1604, DOI:10.1046/j.1432-1033.2001.02030.x. URL consultato il 23 gennaio 2019.
- ^ (EN) Judith K. Booth, Jonathan E. Page e Jörg Bohlmann, Terpene synthases from Cannabis sativa, in PLOS ONE, vol. 12, n. 3, 29 marzo 2017, pp. e0173911, DOI:10.1371/journal.pone.0173911. URL consultato il 29 dicembre 2023.
- ^ United Nations Office on Drugs and Crime., Recommended methods for the identification and analysis of cannabis and cannabis products : manual for use by national drug analysis laboratories (PDF), Rev. and updated, United Nations, 2009, ISBN 9789210555890, OCLC 589299598. URL consultato il 23 gennaio 2019.
- ^ Ross, S.A. Elsohly, M.A., CBN and ∆9-THC concentration ratio as an indicator of the age of stored marijuana samples, in Bulletin on Narcotics, XLIX, 1997, pp. 139-147.
- ^ Galileo - Giornale di Scienza | La cannabis? Un'erba benefica
- ^ (EN) ISBN 0-911910-12-3 S. Budavari, et al., The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals, Merck & Co., 1996.
- ^ (EN) Cannabis Chemistry, su The Vaults of Erowid. URL consultato il 28 novembre 2007 (archiviato dall'url originale il 2 dicembre 2007).
- ^ Thomas M. Nappe, Christopher O. Hoyte, Pediatric Death Due to Myocarditis After Exposure to Cannabis, in Clinical Practice and Cases in Emergency Medicine, vol. 1, n. 3, agosto 2017, pp. 168-170.
- ^ a b Ameri A, The effects of cannabinoids on the brain, in Prog Neurobiol, vol. 58, n. 4, luglio 1999, pp. 315-48, DOI:10.1016/S0301-0082(98)00087-2, PMID 10368032.
- ^ What are marijuana's long-term effects on the brain?, su National institut of drug Abuse.
- ^ (EN) A. J. Hampson, M. Grimaldi e J. Axelrod, Cannabidiol and (−)Δ9-tetrahydrocannabinol are neuroprotective antioxidants, in Proceedings of the National Academy of Sciences, vol. 95, n. 14, 7 luglio 1998, pp. 8268–8273. URL consultato il 25 gennaio 2017.
- ^ (EN) M. van der Stelt, W. B. Veldhuis e P. R. Bär, Neuroprotection by Δ9-Tetrahydrocannabinol, the Main Active Compound in Marijuana, against Ouabain-Induced In Vivo Excitotoxicity, in Journal of Neuroscience, vol. 21, n. 17, 1º settembre 2001, pp. 6475–6479. URL consultato il 25 gennaio 2017 (archiviato dall'url originale il 19 gennaio 2017).
- ^ Stephen Yazulla, Endocannabinoids in the retina: From marijuana to neuroprotection, in Progress in Retinal and Eye Research, vol. 27, n. 5, 1º settembre 2008, pp. 501–526, DOI:10.1016/j.preteyeres.2008.07.002. URL consultato il 25 gennaio 2017.
- ^ (EN) Tetsuya Nagayama, Amy D. Sinor e Roger P. Simon, Cannabinoids and Neuroprotection in Global and Focal Cerebral Ischemia and in Neuronal Cultures, in Journal of Neuroscience, vol. 19, n. 8, 15 aprile 1999, pp. 2987–2995. URL consultato il 25 gennaio 2017.
- ^ (EN) C. B. Carroll, M.-L. Zeissler e C. O. Hanemann, Δ9-tetrahydrocannabinol (Δ9-THC) exerts a direct neuroprotective effect in a human cell culture model of Parkinson's disease, in Neuropathology and Applied Neurobiology, vol. 38, n. 6, 1º ottobre 2012, pp. 535–547, DOI:10.1111/j.1365-2990.2011.01248.x. URL consultato il 25 gennaio 2017.
- ^ Chen JP, Paredes W, Li J, Smith D, Lowinson J, Gardner EL, Delta 9-tetrahydrocannabinol produces naloxone-blockable enhancement of presynaptic basal dopamine efflux in nucleus accumbens of conscious, freely-moving rats as measured by intracerebral microdialysis., in Psychopharmacology, vol. 102, n. 2, 1990, pp. 156-62, PMID 2177204.
- ^ Dronet :: Approfondimenti Per Operatori
- ^ Heishman SJ, Arasteh K, Stitzer ML, Comparative effects of alcohol and marijuana on mood, memory, and performance, in Pharmacol Biochem Behav, vol. 58, n. 1, settembre 1997, DOI:10.1016/S0091-3057(96)00456-X, PMID 9264076.
- ^ Fletcher JM, Page JB, Francis DJ, Copeland K, Naus MJ, Davis CM, Morris R, Krauskopf D, Satz P, Cognitive correlates of long-term cannabis use in Costa Rican men, in Arch Gen Psychiatry, vol. 53, n. 11, novembre 1996, pp. 1051-7, DOI:10.1001/archpsyc.1996.01830110089011, PMID 8911228.
- ^ Block RI, Ghoneim MM, Effects of chronic marijuana use on human cognition, in Psychopharmacology (Berl), vol. 110, n. 1-2, 1993, pp. 219-28, DOI:10.1007/BF02246977, PMID 7870889.
- ^ Patrick G, Straumanis JJ, Struve FA, Fitz-Gerald MJ, Leavitt J, Manno JE, Reduced P50 auditory gating response in psychiatrically normal chronic marihuana users: a pilot study, in Biol Psychiatry, n. 10, maggio 1999, pp. 1307-12, DOI:10.1016/S0006-3223(98)00155-3, PMID 10349037.
- ^ Patrick G, Struve FA, Reduction of auditory P50 gating response in marihuana users: further supporting data, in Clin Electroencephalogr, vol. 31, n. 2, aprile 2000, pp. 88-93, PMID 10840631.
- ^ Wen Jiang, Yun Zhang; Lan Xiao; Jamie Van Cleemput; Shao-Ping Ji; Guang Bai; Xia Zhang, Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects, in Journal of Clinical Investigation, vol. 115, n. 11, 1º novembre 2005, DOI:10.1172/JCI25509. URL consultato il 7 marzo 2011.
- ^ A. J. Hampson, M. Grimaldi e J. Axelrod, Cannabidiol and (−)Δ9-tetrahydrocannabinol are neuroprotective antioxidants, in Proceedings of the National Academy of Sciences of the United States of America, vol. 95, n. 14, 7 luglio 1998, pp. 8268–8273. URL consultato il 25 gennaio 2017.
- ^ (EN) C. B. Carroll, P. G. Bain e L. Teare, Cannabis for dyskinesia in Parkinson disease A randomized double-blind crossover study, in Neurology, vol. 63, n. 7, 12 ottobre 2004, pp. 1245–1250, DOI:10.1212/01.WNL.0000140288.48796.8E. URL consultato il 25 gennaio 2017.
- ^ Lisa M. Eubanks, Claude J. Rogers e Beuscher, A Molecular Link between the Active Component of Marijuana and Alzheimer's Disease Pathology, in Molecular Pharmaceutics, vol. 3, n. 6, 1º dicembre 2006, pp. 773–777, DOI:10.1021/mp060066m. URL consultato il 25 gennaio 2017.
- ^ Associazione Cannabis Terapeutica, Usi terapeutici della Cannabis - Cenni storici, su medicalcannabis.it. URL consultato il 5 novembre 2017.
- ^ Associazione Cannabis Terapeutica, Potenziali campi di utilizzo terapeutico dei derivati della cannabis, su medicalcannabis.it. URL consultato il 5 novembre 2017.
- ^ Copia archiviata, su unimed.com. URL consultato il 26 aprile 2010 (archiviato dall'url originale il 28 ottobre 2008).
- ^ ADUC - Articolo - Cure palliative. Italia garantisca diritto dei malati a non soffrire
- ^ ADUC - Droghe - Articolo - Cannabis terapeutica. Da Rovigo e Firenze parte la produzione italiana? Approvato ordine del giorno in Senato
- ^ ADUC - Articolo - Cure palliative. Si ha paura della responsabilità del medico e della parola cannabis. Intervento al Senato
- ^ Cannabis in farmacia, Farmalabor riceve l'autorizzazione del Ministero della Salute, su farmalabor.it.
Bibliografia[modifica | modifica wikitesto]
- Grotenhermen F., Russo E., Cannabis and cannabinoids. Pharmacology, Toxicology and Therapeutic potential. Binghamton, NY: Haworth Press 2002
- Dewick M., Chimica, biosintesi e bioattività delle sostanze naturali, Ed. Piccin
- Ethan B Russo, Cannabis and Cannabinoids: Pharmacology, Toxicology, and Therapeutic Potential, Routledge, 3 aprile 2013, ISBN 978-1-136-61493-4.
- Leslie L. Iversen Professor of Pharmacology University of Oxford, The Science of Marijuana, Oxford University Press, 6 novembre 2007, ISBN 978-0-19-979598-7.
Voci correlate[modifica | modifica wikitesto]
- Droga leggera
- Cannabis
- Cannabis indica
- Cannabis sativa
- Marijuana
- Hashish
- Teoria del 16 percento
- Teoria del passaggio
- Effetti della cannabis sulla salute
- Canapa (tessile)
- Skunk (cannabis)
- White widow (cannabis)
- Haze (cannabis)
- Antiproibizionismo
- Legalità della cannabis
- Endocannabinoidi
- Recettori cannabinoidi
- Cannabidiolo
- Cannabinoidi
- Anandamide
- Dronabinol
- Nabilone
- Sativex
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Δ-9-tetraidrocannabinolo
Wikimedia Commons contiene immagini o altri file su Δ-9-tetraidrocannabinolo
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) tetrahydrocannabinol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.



