Acido iodoacetico

| Acido iodoacetico | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
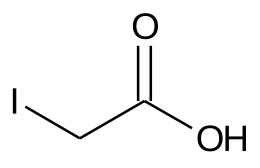
| Formula bruta o molecolare | C2H3O2I |
| Massa molecolare (u) | 185,96 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 200-590-1 |
| PubChem | 5240 |
| SMILES | C(C(=O)O)I |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 600 g/l (20 °C) |
| Temperatura di fusione | 80 °C (353 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  | |
| pericolo | |
| Frasi H | 301 - 314 |
| Consigli P | 260 - 301+310 - 303+361+353 - 305+351+338 - 405 - 501 [1][2] |
L'acido iodoacetico è un acido carbossilico. La sua struttura è assimilabile a quella di una molecola di acido acetico in cui uno degli atomi di idrogeno del gruppo metile è stato sostituito da un atomo di iodio. A temperatura ambiente si presenta come un solido bianco dall'odore pungente. È un composto tossico e corrosivo.
Nella determinazione della sequenza amminoacidica delle proteine bisogna rompere i ponti disolfuro (che si formano tra due residui di cisteina) per separare una catena polipeptidica dall'altra e per permettere alla catena polipeptidica di essere completamente lineare. Infatti, i residui di un polipeptide che si trovano tra due residui di Cys uniti da un ponte disolfuro possono risultare inaccessibili agli enzimi ed ai reagenti usati per il sequenziamento.
L'acido iodoacetico viene spesso usato come alchilante per proteggere i residui amminoacidici di cisteina che si sono così venuti a formare. La reazione è chiamata di "carbossi-metilazione" ed è covalente, quindi irreversibile:
In tal modo si impedisce che l'ossidazione da parte dell'ossigeno riformi i ponti disolfuro.
Tuttavia, la proteina acquisisce una carica negativa in più per ogni cisteina che viene alchilata. In studi di biochimica o in biologia molecolare, trattando campioni biologici freschi (colture cellulari, tessuti omogenati, siero, ecc.) in apposite soluzioni tampone e/o denaturanti con una concentrazione finale di acido iodoacetico nell'ordine di 10-50 millimolare (mM), ed incubando successivamente a 37C per 1 o 2 ore, è possibile ottenere l'alchilazione completa di tutti i gruppi tiolicili liberi delle proteine.
Tramite questo processo è possibile stabilire la proporzione di substrati ridotti ed ossidati, e lo stato ossido-riduttivo delle proteine nei campioni biologici. Infatti, tramite l'elettroforesi nativa (senza aggiunta di sodio dodecilsolfato o SDS) in gel di poli-acrilammide (PAGE), è possibile separare tutte le specie con il loro rispettivo stato redox. L'elettroforesi PAGE, infatti, separa le proteine a seconda del numero delle cariche elettriche totali delle proteine. La normale elettroforesi (SDS-PAGE), invece, separa le proteine in base alla massa molecolare dato che l'SDS (detergente) maschera le cariche elettriche.
Un'altra applicazione biochimica dell'acido iodoacetico è quello di veleno della glicolisi. Infatti, alchila il residuo di cisteina nel sito catalitico della gliceraldeide-3-fosfato deidrogenasi (GAPDH) e porta al blocco dell'utilizzazione del glucosio dentro la cellula.
Note[modifica | modifica wikitesto]
- ^ scheda dell'acido iodoacetico su IFA-GESTIS
- ^ Smaltire prodotto e contenitore in accordo alle leggi vigenti.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido iodoacetico
Wikimedia Commons contiene immagini o altri file su acido iodoacetico
