ジンギパイン

| Zingibain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
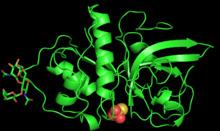 ジンギバインの立体構造 | |||||||||
| 識別子 | |||||||||
| EC番号 | 3.4.22.67 | ||||||||
| CAS登録番号 | 246044-91-7 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
ジンギパイン(英: zingipain)、ジンギバイン(英: zingibain)またはショウガプロテアーゼ(英: ginger protease、略称: GP、EC 3.4.22.67)は、ショウガ(Zingiber officinale)の地下茎に含まれるシステインプロテアーゼである[1][2][3]。P2位にプロリン残基を持つペプチドの選択的切断を触媒する。GP-I、GP-IIという2つのアイソザイムが存在する[4]。
システインプロテアーゼのパパインファミリーのメンバーであるため、パパイン、ブロメライン、アクチニジンなどのより研究が進んだ酵素との構造的・機能的類似性がみられる。これらのペプチダーゼの中心には活性部位となるシステイン残基が存在し、加水分解によるペプチド結合の切断を触媒する。ジンギバインはプロテイナーゼやコラゲナーゼとしての活性も記されている[1]。
ジンギバインは日本女子大学の市川芳江らによって1973年に最初に単離、精製と報告が行われ、クロマトグラフィーによる単離によって、ジンギバインはGP-IとGP-IIという約22,500 Daの2つのアイソザイムとして存在することが判明した[5]。
機構[編集]
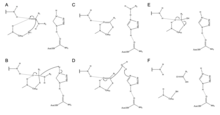
ジンギバインはペプチド結合を加水分解するために、活性部位のCys、His、Asnの触媒三残基を利用する。Asn175の存在はHisのイミダゾール環を安定化し、加水分解の触媒に最適な配置を保証する。
触媒機構はCys25からHis159へのプロトン転移で開始される[6]。その後、スルフィドアニオンがアミノ酸のα炭素を攻撃してアミン基を置換し、アミンはHis159に結合する[6]。安定化されたアミノ酸のα炭素は水分子による攻撃を受け、Cys25のスルフィドが置換されてカルボン酸に変換され、酵素の活性部位から放出される[6]。
チオール基を保護するジチオトレイトールを実験的に加えることでタンパク質分解活性が改善することから、酵素活性における中心のシステイン残基の重要性は確証されている[7]。
ジンギバインは60°Cで最大のターンオーバー数を示し、70°Cで速やかに変性する[8]。パパインやフィカインの至適温度はジンギバインよりも高いが、ブロメラインはわずかに低い範囲で作用する[7]。
ジンギバインが最も高いタンパク質分解活性を示すpHは6.0であるが、肉のマリネに適したpH 4.5から6.0の間で活性がある[7]。
より酸性度の高いアイソザイムであるGP-IIのpIは4.82、GP-Iは5.05または5.16である[1]。GP-Iに複数のpI値が存在することは、GP-Iが2つのタンパク質の混合物であるという仮説を支持している。
構造[編集]
ジンギバインは2000年にボストン大学の研究者らによってX線結晶構造解析が行われた[1]。
酵素は221アミノ酸からなり、Asn96とAsn154の2か所でN-結合型グリコシル化が行われている[3]。ジンギバインのポリペプチド鎖はほぼ同じ大きさの2つのドメインへとフォールディングし、1つ目のドメインは主にαヘリックスからなり、2つ目のドメインには逆平行βシ-トが含まれる[3]。両者の間には中性の溝が存在し、活性部位もここに位置する[3]。活性部位にはCys25、His159、Asn175の触媒三残基が含まれ、協働的に酸塩基触媒を行う。溝の深さは5.5 Å、長さは9.5 Åであり、中性であることで広い範囲の基質との相互作用が可能となっている[3]。
ジンギバインは、P2位にプロリンを持つペプチド基質に対して結合特異性を示す[1]。P2位を認識するS2 subsiteと呼ばれる領域にはTrp67、Met68、Asn69、Thr133、Ala157が含まれ、パパインファミリーの他の酵素で好まれる大きな疎水性芳香族残基はこの部位に入れなくなっている[1]。一方で、プロリンは複数の非共有結合的相互作用によって安定化される。
酵素の構造は水素結合とともに、3対のシステイン残基の間のジスルフィド結合(Cys22-Cys63、Cys56-Cys95、Cys153-Cys200)によって安定化されている。これはパパインファミリーの他の酵素の多くと類似している[1]。
酵素は溶液中では単量体として存在するが、結晶化したジンギバインは各サブユニットの糖鎖によって連結された四量体、より正確には二量体どうしが二量体化したdimer of dimersを形成していた。ジンギバインの2つの残基には複合型のN-結合型糖鎖が存在する[1]。糖鎖は5–13単位の長さで、N-アセチルグルコサミン、フコース、マンノース、キシロースから構成される。ジンギバインの糖鎖は、エンジュSophora japonicaの種子のレクチンやセイヨウカジカエデAcer pseudoplatanusのラッカーゼA、アブラナBrassica campestrisのS糖タンパク質に同定されているものとほぼ同一である[1]。
生物学的意義[編集]
ショウガの地下茎では、ジンギバインは植物細胞の機能維持に関する複数の機能的役割を担っている。
ジンギバインは大部分のシステインプロテアーゼと同様、細胞質の膜結合型ポリソームで40–50 kDaの前駆体タンパク質として合成され、小胞体へ分泌される[9]。KDEL小胞体保持シグナルを持つこのタンパク質は、KDEL小胞と呼ばれる大きな小胞へ輸送され、タンパク質を貯蔵する液胞と融合する[9]。
ジンギバインは種子または植物組織でタンパク質貯蔵に関与しており、ただし主に貯蔵タンパク質の分解と可動化に関与している考えられている。また、熱ショック、低温、脱水などの生物的・非生物的ストレスにも応答し、誤ったフォールディングを行ったり変性したりしたタンパク質を除去している[9]。
利用[編集]
食肉軟化剤[編集]
パパイヤ由来のパパイン、パイナップル由来のブロメラインと同様、ジンギバインは食肉軟化剤として利用される[10][11]。
肉の調理の際に生または乾燥ショウガとして加えることで、肉の柔軟性が増すことが示されている[8][12]。肉の軟化はジンギバインが主要な筋肉タンパク質、特にアクトミオシンや、関節に存在するI型コラーゲンを迅速に分解するためである[8]。
肉の軟化にはパパイン、フィカイン、ブロメラインなど他のパパイン酵素がより一般的に利用されているが、ジンギバインも同等またはそれ以上のタンパク質分解活性を示す[11]。また、ジンギバインは、コラーゲン分解活性を有することが報告されている唯一の植物性プロテアーゼである。ジンギバインは、処理後の肉の食感の点で、パパインよりも好ましい食肉軟化剤である可能性がある。パパインはアクトミオシンを加水分解することができるが、他の主要な組織タンパク質も分解してしまうため、肉の食感はどろどろとしたものとなる[11]。ジンギバインはその結合特異性のため、主にアクトミオシンとI型コラーゲンの加水分解が行われる。
また、ジンギバインはソーセージや焼き菓子の風味付けにも利用される[8]。
レンネットの代用品[編集]
過去100年以上にわたって、ジンジャープロテアーゼは牛乳を凝固させて生姜牛乳プリンを作る際に伝統的に利用されてきた。生姜牛乳プリンは、ホットミルクとショウガ汁から作られる広東料理である。ジンジャープロテアーゼの凝乳能とκ-カゼインのタンパク質分解に対する特異性から、この酵素はチーズの製造時のレンネットの植物性代替品として期待されている。
乳の凝固は伝統的に、レンネットなどから抽出した凝固酵素を用いて行われてきた。レンネットでは、キモシンの3つのアイソザイムが乳の主要なタンパク質であるκ-カゼインをPhe105とMet106の間で加水分解する。これによってκ-カゼインの親水的領域が切り離され、主に疎水的な凝集体が残される。このように、酵素はκ-カゼインのミセルを不安定化し、タンパク質の疎水性残基の凝集を促進することで凝乳を引き起こす。
レンネットの主な産業的欠点は、供給量が限られていること、高価であること、菜食主義者や特定の宗教集団では利用できないこと、そして近年ヨーロッパのいくつかの国では組換えウシレンネットの使用が禁止されたことである[13]。菌類のプロテアーゼの多くはレンネットの代替品としては不適当であり、多くの植物由来の酵素はチーズの収率が低く、質感が悪く、苦味が出る[13]。
商業的欠点[編集]
しかしながら、ショウガエキスから粗抽出されたショウガプロテアーゼは不安定であり、5°Cで保存した際の活性の半減期は約2日である。そのため、商業的応用は困難なものとなっている[14]。酵素の半減期は調理時の効率に影響を与えるものではないが、この保存安定性の低さは商業化に際して改善が必要である。
大規模生産のための酵素の安定化の試みでは、酵素の活性部位に位置するスルフヒドリル基を不活性化させる方法が検討されている。可能性のある機構としては、スルフヒドリル基の酸化、ジスルフィド結合への交換、キノン-チオール付加体の形成、重金属イオンとの結合などがある。0.2%アスコルビン酸ナトリウムは5°Cで14日間までジンギバインを安定化させることが判明したが、同等の濃度のEDTAやCaCl2は安定性にほとんど影響を与えなかった[14]。
ジンギバインは自己分解によって不活性化することが観察されているが、活性スルフヒドリル基をシスチンやPCMBと反応させることで未然に防ぐことができる[14]。
アセトン粉末処理は、ジンギバインの安定化のための現実的な商業的手法である。粗ショウガエキスから疎水性の植物性ポリフェノールを除去した後、脱水のために低温でアセトン粉末処理する。水分活性の低下、植物性色素の濃度の低下、そして低温でのより強固な三次構造の形成によって、酵素は安定化される[14]。
出典[編集]
- ^ a b c d e f g h i “Amino-acid sequence and glycan structures of cysteine proteases with proline specificity from ginger rhizome Zingiber officinale”. Eur. J. Biochem. 267 (5): 1516–26. (2000). doi:10.1046/j.1432-1327.2000.01152.x. PMID 10691991.
- ^ “Purification of ginger proteases by DEAE-Sepharose and isoelectric focusing”. Biochim. Biophys. Acta 1243 (2): 181–4. (1995). doi:10.1016/0304-4165(94)00145-n. PMID 7873561.
- ^ a b c d e “The 2.1 A structure of a cysteine protease with proline specificity from ginger rhizome, Zingiber officinale”. Biochemistry 38 (36): 11624–33. (1999). doi:10.1021/bi990651b. PMID 10512617.
- ^ “Purification, characterization, and milk coagulating properties of ginger proteases”. J. Dairy Sci. 94 (5): 2259–69. (2011). doi:10.3168/jds.2010-4024. PMID 21524515.
- ^ 喜美代, 道、初世, 佐々、芳江, 市川「ショウガたん白分解酵素の分離精製」『栄養と食糧』第26巻第6号、1973年、377–383頁、doi:10.4327/jsnfs1949.26.377、ISSN 1883-8863。
- ^ a b c “Modes of inhibition of cysteine proteases”. Acta Biochimica Polonica 51 (4): 861–73. (2004). PMID 15625558.
- ^ a b c “Ginger Rhizome: A New Source of Proteolytic Enzyme”. J. Food Sci. 38 (4): 652–655. (1973). doi:10.1111/j.1365-2621.1973.tb02836.x.
- ^ a b c d “Tenderization of Meat with Ginger Rhizome Protease”. J. Food Sci. 51 (6): 1558–1559. (1986). doi:10.1111/j.1365-2621.1986.tb13860.x.
- ^ a b c “Multifunctional role of plant cysteine proteinases”. Acta Biochimica Polonica 51 (3): 609–24. (2004). doi:10.18388/abp.2004_3547. PMID 15448724.
- ^ “Characterisation of commercial papain, bromelain, actinidin and zingibain protease preparations and their activities toward meat proteins”. Food Chem. 134 (1): 95–105. (2012). doi:10.1016/j.foodchem.2012.02.071.
- ^ a b c “Plant collagenase: unique collagenolytic activity of cysteine proteases from ginger”. Biochim. Biophys. Acta 1770 (12): 1627–35. (2007). doi:10.1016/j.bbagen.2007.08.003. PMID 17920199.
- ^ “Effect of Proteolytic Enzymes and Ginger Extract on Tenderization of M. pectoralis profundus from Holstein Steer”. Korean Journal for Food Science of Animal Resources 38 (1): 143–151. (2018). doi:10.5851/kosfa.2018.38.1.143. PMC 5932962. PMID 29725232.
- ^ a b “Ginger rhizome as a potential source of milk coagulating cysteine protease”. Phytochemistry 72 (6): 458–64. (2011). doi:10.1016/j.phytochem.2010.12.002. PMID 21353685.
- ^ a b c d “Stabilization and Partial Purification of a Protease from Ginger Rhizome (Zingiber offinale Roscoe)”. J. Food Sci. 70 (3): C231–C234. (2005). doi:10.1111/j.1365-2621.2005.tb07130.x.
関連項目[編集]
外部リンク[編集]
- Zingipain - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)