Suboxyde de bore

| Suboxyde de bore | |
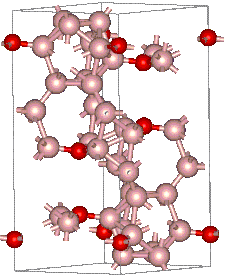 | |
| __ B __ O Structure cristalline d'un suboxyde de bore non stœchiométrique[1] | |
| Propriétés chimiques | |
|---|---|
| Formule | B6O |
| Masse molaire[2] | 80,865 ± 0,042 g/mol B 80,22 %, O 19,79 %, |
| Propriétés physiques | |
| T° fusion | 2 000 °C[3] |
| Masse volumique | 2,56 g·cm-3[4] |
| Cristallographie | |
| Système cristallin | trigonal, orthorhombique |
| Classe cristalline ou groupe d’espace | B6O α : R3m (no 166) [5] B6O β : Cmcm (no 63) [5] |
| Paramètres de maille | B6O α : a = b = c = 515,3 pm, α = 63,10°[5] ; B6O β : a = 539,3 pm, b = 877,7 pm, c = 873,6 pm, α = β = γ = 90°[5]. |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le suboxyde de bore est un composé chimique de formule B6O. Il se présente comme un solide cristallisé dans le système trigonal avec le groupe d'espace R3m (no 166) ou dans le système orthorhombique avec le groupe d'espace Cmcm (no 63), selon deux polymorphes du B6O notés respectivement α et β[5]. Ces structures sont formées de huit icosaèdres aux sommets d'une maille élémentaire rhomboédrique. Chaque icosaèdre est constitué de 12 atomes de bore. Deux atomes d'oxygène se placent dans les interstices le long de la direction rhomboédrique [111]. En raison de ses liaisons chimiques courtes et fortement covalentes, ce matériau présente des propriétés physiques et chimiques remarquables, notamment une dureté Vickers de 45 GPa mesurée sur des monocristaux[6],[7], proche de celle du nitrure de bore BN cubique, une masse volumique de 2,56 g/cm3[4] plutôt faible, une conductivité thermique élevée, de l'ordre de 284,9 W m−1 K−1 et 207,1 W m−1 K−1 pour le B6O α et β respectivement[8], une grande inertie chimique et une très bonne résistance à l'usure[6].
On peut produire du suboxyde de bore en réduisant du sesquioxyde de bore B2O3 avec du bore ou en oxydant du bore avec de l'oxyde de zinc ZnO ou d'autres oxydants[4]. Les matériaux obtenus à pression voisine de 1 atm sont du suboxyde de bore généralement déficitaire en oxygène et non stœchiométrique B6O1–δ, avec δ > 0,1. Ils forment des grains petits (moins de 5 µm) et mal cristallisés. Le suboxyde de bore déficitaire en oxygène peut former des particules icosaédriques qui ne sont ni des monocristaux ni des quasicristaux mais des macles de vingt cristaux tétraédriques[3],[9]. L'application de pression élevée pendant la synthèse du B6O peut améliorer significativement la cristalliné du matériau obtenu, ainsi que sa stœchiométrie en oxygène et la taille de ses cristaux. Les méthodes de production de B6O publiées dans la littérature utilisent généralement des mélanges de poudre de bore et de B2O3[6].
Le suboxyde de bore du type du bore rhomboédrique α est étudié pour sa nature céramique — grande dureté, point de fusion élevé, bonne stabilité chimique, faible masse volumique — comme nouveau matériau structurel. Il présente des liaisons particulières qui ne sont pas faciles à décrire par la théorie de la liaison de valence. La position des atomes d'oxygène n'a pu être précisée que par la méthode de Rietveld sur des poudres de B6O[4].
Préparation[modifier | modifier le code]

Le suboxyde de bore peut être obtenu par trois méthodes[11] :
- réaction à l'état solide entre le bore et le sesquioxyde de bore B2O3 : la pression de vapeur élevée du B2O3 aux températures élevées conduit à l'excès de bore lors de cette réaction ;
- réduction du B2O3, par exemple par le silicium et le magnésium, qui demeurent dans le B6O sous forme d'impuretés ;
- oxydation du bore, par exemple par l'oxyde de zinc ZnO, qui contaminent le B6O lors du processus.
Propriétés physiques[modifier | modifier le code]
Le suboxyde de bore est fortement covalent et se forme facilement au-dessus de 1 873 K[11]. Il est caractérisé par sa grande dureté, son point de fusion élevé, sa bonne stabilité chimique et sa faible masse volumique ; des calculs ab initio préliminaires sur les propriétés structurelles du suboxyde de bore suggèrent que la force des liaisons dans le matériau peut être augmentée par la présence d'atomes très électronégatifs dans sa structure[12].
Applications[modifier | modifier le code]
Le suboxyde de bore a fait l'objet d'intenses recherches pour des applications comme revêtement contre l'usure des outils de tour à grande vitesse ou comme abrasif. Le principal obstacle à son utilisation industrielle est sa ténacité limitée et surtout les grandes difficultés pratiques à compacter un B6O stœchiométrique avec une bonne cristallinité. De surcroît, de nombreuses propriétés mécaniques de ce matériau n'ont été comprises que récemment[12].
Références[modifier | modifier le code]
- (en) Malin Olofsson et Torsten Lundström, « Synthesis and structure of non-stoichiometric B6O », Journal of Alloys and Compounds, vol. 257, nos 1-2, , p. 91-95 (DOI 10.1016/S0925-8388(97)00008-X, lire en ligne)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Paul F. McMillan, Hervé Hubert, Andrew Chizmeshy, William T. Petuskey, Lawrence A. J. Garvie et Bertrand Devouard, « Nucleation and Growth of Icosahedral Boron Suboxide Clusters at High Pressure », Journal of Solid State Chemistry, vol. 147, no 1, , p. 281-290 (DOI 10.1006/jssc.1999.8272, Bibcode 1999JSSCh.147..281M, lire en ligne)
- (en) M. Kobayashi, I. Higashi, C. Brodhag et F. Thévenot, « Structure of B6O boron-suboxide by Rietveld refinement », Journal of Materials Science, vol. 28, no 8, , p. 2129-2134 (DOI 10.1007/BF00367573, Bibcode 1993JMatS..28.2129K, lire en ligne)
- (en) Huafeng Dong, Artem R. Oganov, Qinggao Wang, Sheng-Nan Wang, Zhenhai Wang, Jin Zhang, M. Mahdi Davari Esfahani, Xiang-Feng Zhou, Fugen Wu et Qiang Zhu, « Prediction of a new ground state of superhard compound B6O at ambient conditions », Scientific Reports, vol. 6, , article no 31288 (PMID 27498718, PMCID 4976382, DOI 10.1038/srep31288, Bibcode 2016NatSR...631288D, arXiv 1604.00586, lire en ligne)
- (en) Duanwei He, Yusheng Zhao, L. Daemen, J. Qian, T. D. Shen et T. W. Zerda, « Boron suboxide: As hard as cubic boron nitride », Applied Physics Letters, vol. 81, no 4, , p. 643-645 (DOI 10.1063/1.1494860, Bibcode 2002ApPhL..81..643H, lire en ligne)
- (en) M. Herrmann, I. Sigalas, M. Thiele, M. M. Müller, H.-J. Kleebe et A. Michaelis, « Boron suboxide ultrahard materials », International Journal of Refractory Metals and Hard Materials, vol. 39, , p. 53-60 (DOI 10.1016/j.ijrmhm.2012.02.009, lire en ligne)
- (en) Jinghang Dai et Zhiting Tian, « Large thermal conductivity of boron suboxides despite complex structures », Applied Physics Letters, vol. 118, no 4, , article no 041901 (DOI 10.1063/5.0034906, Bibcode 2021ApPhL.118d1901D, lire en ligne)
- (en) Dennis Durband, « Making the Hard Stuff »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) [PDF], sur asu.edu, Université d'État de l'Arizona, (consulté le ).
- (en) Qi An, K. Madhav Reddy, Jin Qian, Kevin J. Hemker, Ming-Wei Chen et William A. Goddard III, « Nucleation of amorphous shear bands at nanotwins in boron suboxide », Nature Communications, vol. 7, , article no 11001 (PMID 27001922, PMCID 4804168, DOI 10.1038/ncomms11001, Bibcode 2016NatCo...711001A, lire en ligne)
- (en) Takaya Akashi, Tsuyoshi Itoh, Itaru Gunjishima, Hiroshi Masumoto et Takashi Goto, « Thermoelectric Properties of Hot-pressed Boron Suboxide (B6O) », Materials Transactions, vol. 43, no 7, , p. 1719-1723 (DOI 10.2320/matertrans.43.1719, lire en ligne)
- (en) Ronald Machaka, Bonex W. Mwakikunga, Elayaperumal Manikandan, Trevor E. Derry, Iakovos Sigalas et Mathias Herrmann, « Mechanical and Structural Properties of Fluorine-Ion-Implanted Boron Suboxide », Advances in Materials Science and Engineering, vol. 2012, , article no 792973 (DOI 10.1155/2012/792973, lire en ligne)





