Омолодження

| Омолодження | |
| |
Омолодження або ревіталізація, реювенація (лат. rejuvenatio) — звернення процесу старіння організму. Базується на комплексному, системному, персоналізованому, впливі на 10 основних механізмів старіння[1][2][3][4].
Історія[ред. | ред. код]
Пошуки засобів омолодження тривають з глибокої давнини («молодильні яблука» та інші сюжети в казках) і з античної епохи; середньовічні алхіміки шукали еліксир безсмертя і омолодження, конкістадори (наприклад, Понсе де Леон) шукали в Америці «фонтан вічної юності», графиня Єлизавета Баторі купалася в крові вбитих нею дівчат (схожі експерименти робили й інші могутні люди).
Проблематика фізіалогічного омолодження була почалася досліджуватся у медицині з 1910-1920-х років, цим займався, зокрема, відомий фізіолог Ойген Штейнах у Відні (він пов'язував омолодження з клітинами Лейдіга в статевих залозах, а чоловікам робив операцію вазектомії з метою збільшення не тільки потенції, але життєвої сили взагалі; робив він також пересадку статевих залоз тварин людям).
Починаючи з 2000-х років у науковому товаристві був узгоджений цілісний холістичний підхід до потенційного омолодження організму. 2013 року вийшла стаття "Механізми старіння"[1], в якій описуються всі ключові механізми старіння і, з іншого боку, сфери впливу для омолодження організму.

В даний час вважається, що омолодження можливе шляхом репарації (відновлення) структур молекул (включаючи геном та епігеном), органел, клітин і тканин людського організму, оптимізації міжклітинної взаємодії, очищення організму від сенесцентних (старих) клітин та відновлення стовбурових клітин.
Наукові дисципліни[ред. | ред. код]
Проблематикою старіння та дослідженнями методик для омолодження займається геронтологія, превентивна медицина, регенеративна медицина та група суміжних дисциплін та сфер: молекулярна, клітинна та системна біологія, епігенетика та генетика, нейронаука, біоінформатика та біокібернетика, персоналізована медицина, інтегративна медицина, нутрігенетика й нутрігеноміка, наномедицина, генотерапія, біоінженерія (молекулярна, генна, клітинна, тканинна), біохакінг та інші.
Механізми старіння[ред. | ред. код]

Механізми (ознаки) старіння і, як наслідок, погіршення здоров"я[1][2][3][4]:
Основні механізми[ред. | ред. код]
- Геномна нестабільність: накопичення пошкоджень ДНК у клітинах, що може призвести до геномної нестабільності та підвищеного ризику патологій.
- Епігенетичні зміни: епігеномні зміни, які впливають на експресію генів. Вони можуть накопичуватися з віком і сприяти процесу старіння.[6]
- Вкорочення теломер: теломери — це захисні кришки на кінцях хромосом, які коротшають у міру поділу клітин, і їх втрата пов’язана зі старінням клітин.
- Втрата протеостазу: протеостаз – це гомеостатичний процес підтримки всіх білків, необхідних для функціонування клітини, у належній формі, структурі та чисельності.
Антагоністичні механізми[ред. | ред. код]
- Дерегульоване визначення поживних речовин (англ. nutrient sensing): зниження здатності клітин сприймати та реагувати на зміни в доступності поживних речовин, що може призвести до метаболічного дисбалансу та підвищеного ризику захворювань, пов’язаних із віком.
- Мітохондріальна дисфункція: мітохондрії є джерелом енергії клітин, і їхня дисфункція пов’язана зі старінням і віковими захворюваннями.
- Клітинне старіння (сенесценція): клітинне старіння — це накопичення старих (сенесцентних) клітин, які припинили поділ і можуть сприяти запаленню й пошкодженню тканин, та старінню інших клітин.
Інтегративні механізми[ред. | ред. код]
- Виснаження стовбурових клітин: стовбурові клітини відповідають за підтримку та відновлення тканин, і їх старіння та зменшення з віком може призвести до зниження регенераційної здатності.
- Змінений міжклітинний зв’язок: зниження здатності клітин спілкуватися одна з одною, що може призвести до порушення функції тканин і підвищення ризику захворювань, пов’язаних із віком.
Додаткові механізми[ред. | ред. код]
Перші три були запропоновані багатьма вченими на основі нових наукових досліджень і, зокрема, додані авторами статті 2013 року[1] про 9 механізмів старіння в оновленну статті 2023 року[4]. Четвертий запропонований іншими вченими, включно з Обрі де Греєм.[7]
- Відключена макроаутофагія
- Хронічне запалення[8]
- Дизбіоз
- Порушення міжклітинного матриксу
Наукові дослідження[ред. | ред. код]
Рандомізоване клінічне дослідження 2021 року 43 здорових людей у віці від 50 до 72 років показало, що 8 тижнів здорового способу життя — рослинна дієта, достатній та якісний сон, фізичні вправи та активне розслаблення, а також прийом пробіотиків та фітонутрієнтів — омолодили біологічний (епігенетичний) вік людей у середньому на 3.2 роки (p=0.018).[9]
Також у 2021 році було задокументовано омолодження епігенетичного віку людини на 5 років всього за 7 місяців, за допомогою щоденної різноманітної рослинної дієти (особливо горіхи, овочі, насіння, ягоди та несолодкі фрукти), великої кількості різних дієтичних добавок (колаген, креатин, спермідин, лецитин, амінокислоти, вітаміни[10], поліфеноли, глюкозамін та інші).[11][12][13]
Крім того є багато досліджень на тваринах, які показують значне зменшення біологічного віку у тварин.[14][15][16][17][18][19][20][21]
Мультиоміка[ред. | ред. код]
Мультиоміка — це підхід до біологічного аналізу, спрямований на використання та інтеграцію великої кількості даних, наданої дослідженнями «омами», такими як геном, протеом, транскриптом, епігеном, епітранскриптом, метаболом, інтерактом, мікробіом (метагеном, метатранскриптом, метапротеом) та інші, щоб розвинути комплексне та цілісне розуміння біологічних систем.[22][23][24]
У дослідженні 2023 року, опублікованому в Nature Communications, дослідники використовували транскриптомні асоційовані дослідження (TWAS) і аналіз менделівської рандомізації (MR), щоб ідентифікувати сигнатури експресії генів і генетичні мішені ліків, пов’язані зі старінням на рівні епігеному та комплексним підходом до довголіття та омолодження. Вони ідентифікували 22 асоціації з високим ступенем достовірності з епігенетичним старінням і 7 з багатофакторним довголіттям, з кількома генами, пов’язаними з передачею сигналів інсуліну, функцією мітохондрій, клітинною реакцією на стрес і метаболізмом. Дослідження також виявило вплив імунних клітин на прискорення епігенетичного старіння, що передбачає потенційні можливі мішені для терапевтичних втручаннь. Подільші дослідження в цій сфері допоможуть визначити конкретні препарати чи втручання для терапії проти старіння. Інтеграція мультиоміки в точні стратегії омолодження є багатообіцяючою у визначенні лікарських цілей для продовження здорових років життя.[24]
Інструменти омолодження[ред. | ред. код]
Відповідно до сфери впливу (див. механізми старіння) існують різні методики впливу на біологічний вік організму. Наприклад, терапія стовбуровими клітинами, відновлення епігенетичних та генетичних пошкоджень, відновлення структури (подовження) теломер, відновлення здорової структури білків в клітинах та тканинах, оптимізація міжклітинних комунікацій, покращення функціонування мітохондрій, омолодження стовбурових клітин, клітинне репрограмування та інші.
Є кілька способів, якими люди можуть спробувати омолодити своє тіло, зокрема:
- Дотримуватись здорового харчування[25][26] та регулярно займайтись фізичною активністю[25][27][28], щоб підтримувати здорову вагу та належне функціонування організму (див. – Здоровий спосіб життя).
- Висипатися достатньо, щоб тіло відпочило та відновилося.
- Уникати шкідливих речовин, таких як тютюн, алкоголь і наркотики, які можуть пошкодити організм і втручатися в його природні процеси.
- Управляти стресом[29] і застосувати техніки релаксації для підтримки балансу між тілом і розумом.
- Використання препаратів і методів лікування, призначених для уповільнення процесу старіння та сприяння регенерації клітин, таких як терапія стовбуровими клітинами та ін’єкції збагаченої тромбоцитами плазми.
- Цілісний підхід, який передбачає турботу про тіло, розум і енергію.
Здорове харчування[ред. | ред. код]
Основні статті — Здорове харчування, Раціональне харчування, Нутриціологія, Нутрігеноміка, Супер'їжа.
Дослідження показують, що дотримання середземноморської дієти[30][31] та окінавської дієти пов’язані з покращенням здоров’я та тривалості життя, й зниженням загальної смертності та смертності від багатьох хронічних хвороб.[32][33][34][35] Регулярне споживання фруктів та овочів[36], горіхів[37], цільнезернових[38], клітковини[39], жирної морської риби[40], рослинного протеїну[41], оливкової олії[42] знижує ризики багатьох хронічних захворювань та смертності від них.
Дослідження показують, що характер харчування є основною причиною порівняно великої сереньої тривалості життя в Японії[43].
Велику роль також відіграє здоров'я мікробіоти кишківника. Дослідження показують, що мікробіота кишківника бере участь у сприятливих ефектах для покращення здоров'я та продовження тривалості життя[44][45][46]. Різноманіття раціону також необхідно для формування та збереження різноманітної мікробіоти кишківника. Різноманіття складу мікробіоти є однією з основних умов для здоров'я кишківника та організма в цілому. Тому для здоров'я мікробіоти кишківника доцільним є вживання якомога більшої кількості різних продуктів з високим вмістом рослинних харчових волокон (клітковини), особливо фруктів, овочів, спецій та ферментованих продуктів.[47][48][49]
Обмеження калорій[ред. | ред. код]
Див. також — Інтервальне голодування, Гормезис, Схуднення.
Відповідно до двох наукових оглядів, опублікованих у 2021 році, накопичені дані свідчать про те, що дієтичне обмеження – головним чином інтервальне голодування та обмеження калорійності – призводить до багатьох тих самих корисних змін у дорослих людей, що й у досліджуваних організмів, потенційно збільшуючи здоров’я та тривалість життя [50].
Сенолітики та ліки від старіння (геропротеткори)[ред. | ред. код]
Сенолітики (від слів senescence і -lytic, «руйнівний») належать до класу малих молекул, які можуть вони вибірково індукувати загибель старіючих клітин (сенесцентних) і покращувати здоров’я людей.[51] Сенолітики усувають старіючі клітини, тоді як сеноморфні препарати (апігенін, еверолімус і рапаміцин тощо) – модулюють властивості старіючих клітин, не знищуючи їх, пригнічуючи фенотипи старіння, включаючи SASP.[52][53][20] Також препаратами-кандидатами є метформін, акарбоза, спермідин та препарати NAD+.[54][55]
Нутрицевтики та БАДи[ред. | ред. код]
Багато препаратів для продовження життя є синтетичними альтернативами або потенційними доповненнями до існуючих нутрицевтиків (БАДів), таких як різні досліджувані сполуки, що активують шляхи сиртуїну (SRT2104).[56] У деяких випадках фармацевтична препарати поєднується з нутрицевтиками — наприклад, у випадку гліцину в поєднанні з NAC.[57]
Споживання достатньої кількості білку, омега-3 жирних кислот, вітамінів та мікроелементів є життєво важливим для підтримки м'язової маси та сили з віком. Без достатнього харчування люди похилого віку піддають себе підвищеному ризику розвитку саркопенії. Таким чином, на додаток до фізичних вправ, харчові добавки можуть бути важливими для забезпечення хорошого фізичного здоров'я людей похилого віку.[58]
Дякі препарати можуть також впливати на рівень гормонів, відповідальних за омолодження та регенерацію організму, таких як тестостерон, гормон росту та інші. Такі добавки, як мононуклеотид нікотинаміду (NMN), рибозид нікотинаміду (NR), куркумін і омега-3 жирні кислоти, часто використовуються для омолодження, щоб відновити життєві сили та функціональність організму. Дослідження показують, що ці сполуки можуть уповільнювати процес старіння та покращувати здоров'я та благополуччя за допомогою різних механізмів, таких як регулювання тривалості життя, відновлення рівня клітинного коферменту NAD+, зменшення запалення та підтримка здоров'я мозку. Однак їх використання має відбуватися під керівництвом лікаря та доповнювати здоровий спосіб життя. Існують занепокоєння щодо регулювання та якості харчових добавок, що робить тестування третьою стороною необхідним. Майбутні напрямки досліджень включають вивчення складних взаємодій між різними добавками, генетичними факторами, мультиомікою та втручаннями у спосіб життя.
Регенеративна медицина[ред. | ред. код]
Стовбурові клітини[ред. | ред. код]
Основні статті — Епігенетичне перепрограмування, Стовбурові клітини, Лікування стовбуровими клітинами.
Активною областю досліджень омолодження є роботи зі стовбуровими клітинами, їх омолодженням або їх використанням[14]. Стовбурові клітини, на відміну від диференційованих клітин, здатні до тривалого поділу і відновлення структури тканин організму.
Перспективним є використанні індукованих плюрипотентних стовбурових клітин. Індуковані плюрипотентні ембріональні стовбурові клітини (induced pluripotent stem cells — iPSC, або iPS) вдалося отримати з клітин різних тканин (у першу чергу фібробластів) за допомогою їх перепрограмування у стовбурові клітини методами генетичної інженерії, зазвичай, за допомогою комбінації факторів Яманаки[59] — Oct4, Klf4, Sox2 та c-Myc — названих на честь Сін'я Яманака, або за допомогою РНК[60], або малих молекул[61].
Тканинна інженерія[ред. | ред. код]
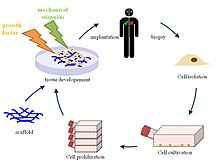
Основні статті — Тканинна інженерія, Інженерія нервової тканини, Органоїд, Друк органів.
Тканинна інженерія — це біомедична інженерна дисципліна, яка використовує комбінацію клітин, інженерії, матеріалознавства і відповідних біохімічних і фізико-хімічних факторів для відновлення, підтримки, покращення або заміни різних типів біологічних тканин[62][63][64][65].
Генотерапія[ред. | ред. код]
Основні статті — Генотерапія, Редагування генома.
Групою вчених у 2020 році була проведена генотерапія для омолодження та відновлення нервового волокна сітківки. Старим мишам ввели за допомогою аденовірусної генотерапії гени, які синтезують фактори Яманакі, які епігенетично омолоджують гангліозні клітини сітківки миші, що сприяє регенерації аксонів після пошкодження, і усуває втрату зору на мишачій моделі глаукоми та у літніх мишей. Сприятливий вплив OSK-індукованого перепрограмування регенерації аксонів і зору потребує ДНК-деметилаз TET1 і TET2. Ці дані вказують на те, що тканини ссавців зберігають запис епігенетичної інформації молодості, частково закодованої метилюванням ДНК, до якої можна отримати доступ для покращення функції тканини та сприяння регенерації in vivo. Таке омолодження клітин дозволило відновити штучно пошкоджений оптичний нерв — нервові волокна виросли виросли знову. Вчені досягли х2 збільшення кількості клітин сітківки і х5 прискорення росту оптичного нерва.[66]
В 2021 році було проведено невелике спонсороване інтервенційне нерандомізоване дослідження без контрольної групи з використанням нового запатентованого методу передачі генів центральної нервової системи для доставки генів AAV hTert і Klotho п’яти пацієнтам із легкою або помірною деменцією для першочергової оцінки безпеки. Дані клінічної відповіді були зібрані як вторинний інтерес. Терапія продемонструвала дуже високий профіль безпеки без виявлення серйозних побічних ефектів. Клінічне обстеження пацієнтів протягом одного року спостереження дало значні результати: у всіх п’яти пацієнтів було продемонстровано явне зменшення симптомів деменції, наприклад, стійке когнітивне покращення, виміряне за допомогою обстеження Фольштейна. Теломерний аналіз проводили до і після терапії. Було виявлено вимірне подовження теломер учасників, і зменшення біологіяного віку зі збільшенням хронологічного.[67]
Омолодження мозку[ред. | ред. код]
«120-річна межа» тривалості життя встановлюється насамперед через нездатність тканини мозку до регенерації та неможливість трансплантації мозку.
Але три нові стратегії для омолодження старіючого людського мозку, можливо, зможуть вирішити унікальні проблеми, пов’язані з зупинкою старіння мозку[68][69].
Зменшення самопригнічення мозку[ред. | ред. код]
Лабораторія доктора Пітера Волтера в Каліфорнійському університеті в Сан-Франциско виявила, що мозкова тканина регулярно відчуває, коли деякі нейрони мають проблеми, наприклад вірусні інфекції, і за допомогою механізму під назвою Інтегративна відповідь на стрес (ISR) активно пригнічує активність (синтез білка) хворих нейронів, щоб запобігти подальшому порушенню функції мозку. Коли ми старіємо, а функціонування нейронів головного мозку гіршає, наприклад, через запалення, активність ISR зростає, пригнічуючи дедалі більше і більше нейронних функцій. Уолтер і його співавтор, доктор Сусанна Розі, нещодавно виявили, що пригнічення активності ISR (яка сама по собі пригнічує функцію мозку) може неймовірно швидко повернути назад зниження когнітивних функцій у старих мишей. Наприклад, старим мишам набагато важче навчитися орієнтуватися в лабіринтах, ніж молодим мишам, але коли команда Каліфорнійського університету в Сан-Франциско обробила старших мишей інгібітором ISR лише за кілька днів, старі миші працювали так само добре, як і молоді миші. завдання лабіринт[70][71].
Це майже миттєве покращення когнітивних здібностей означає, що вікове погіршення розумового розвитку не пов’язане лише з відмиранням нейронів чи іншими постійними втратами, а частково через активні оборотні метаболічні процеси. Команди Каліфорнійського університету в Сан-Франциско вважають, що такі методи лікування, як інгібітори ISR, колись можуть відновити функції, втрачені не лише через старіння, але й після інсульту та травми.
Див. також — Молекулярна нейронаука, Нейрохімія.
Реактивація росту та розвитку нейронів[ред. | ред. код]
Основні статті — Нейрогенез, Нейропластичність.
Доктор Саул Вілледа (також працює в Каліфорнійському університеті в Сан-Франциско) досліджував нейрогенез (утворення нових нейронів) у гіпокампі. Досліджуючи, чому одні частини мозку регенерують, а інші – ні, команда доктора Вілледи виявила низку сигнальних молекул, таких як сполуки, знайдені в юнацькій крові, які можуть «обманути» старі нейрони і створити нові — навіть у тих областях мозку, яких зазвичай немає нейрогенезу у дорослому мозку. Ці молекули також допомагають новоутвореним дорослим клітинам розвивати дендрити та аксони. Старі тварини, яких лікували такими омолоджуючими молекулами, справді демонстрували покращення когнітивних функцій.[72]
Подальші дослідження цієї команди дослідників, опубліковані в Nature в серпні 2023 року, показали, що системне введення екзогенного тромбоцитарного фактору 4 (PF4) послаблювало пов'язане з віком нейрозапалення в гіпокампі, викликало молекулярні зміни, пов’язані з синаптичною пластичністю, і покращувало процеси пізнання у літніх мишей.[73][74]
Введення нових клітин для відновлення втрачених нейронів[ред. | ред. код]

Основна стаття — Інженерія нервової тканини.
У Клінічному центрі регенеративної медицини Мейо, дослідницька робота групи вченихзосереджена на введенні в мозок стовбурових клітин (ембріоноподібних клітин, які можуть ділитися та диференціюватися на "дорослі" типи клітин), які викликають ріст нових кровоносних судин у мозку, живлення та пожвавлення старих нейронів і, можливо, допомагають у вирощуванні нових.
Вчені з Медичної школи Університету Чжецзян у Китаї також досягають успіхів у введенні стовбурових клітин і змушенні цих клітин мігрувати до пошкоджених регіонів і почати диференціюватись у нейрони, які замінять ті, що були втрачені внаслідок черепно-мозкової травми[75]. Поки що неясно, скільки втрачених функцій може відновити ця нова техніка, але нейробіологи сподіваються, що скоро вона може допомогти зменшити когнітивні та моторні порушення при нейродегенеративних захворюваннях, таких як деменція та хвороба Паркінсона.
Дослідження 2023 року показало, що органоїди людського мозку успішно інтегруються із зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини зорової кори. Транссинаптичне відстеження на основі вірусів виявило полісинаптичний шлях між трансплантованими людськими органоїдними нейронами та сітківкою щура-господаря, та взаємний зв’язок між трансплантатом та іншими регіонами зорової системи. Візуальна стимуляція тварин-господарів викликає відповіді в органоїдних нейронах, включаючи вибірковість орієнтації. Ці результати демонструють здатність органоїдів людського мозку приймати складні функції після введення у великі порожнини травми, пропонуючи трансляційну стратегію для відновлення функції після пошкодження кори.[76]
Транскриптомне перепрограмування[ред. | ред. код]
Щоб боротися з нагальною проблемою захворювань, пов’язаних зі старінням, і покращити здоров’я людини, існує пропозиція щодо терапії омолодження, зосередженої на перепрограмуванні транскриптомів старіючих клітин до більш молодого стану. Цей підхід передбачає використання транскриптомних даних з первинних людських клітин для визначення цілей омолодження, особливо зосереджуючись на нейронних клітинах, включаючи глутаматергічні нейрони, нейрональні стовбурові клітини та олігодендроцити, через їх значну роль у вирішенні проблеми вікової нейродегенерації. Експериментальні плани для широкомасштабних аналізів старіння та скринінгу збурень пропонуються як багатообіцяючі стратегії для розробки методів лікування, які потенційно можуть повернути процес старіння та покращити загальне самопочуття.[77]
Також, хронічне введення канабіноїдів в дослідженнях in vivo на тваринних моделях показало омолодження транскприптомів нейронів старих мишей до стану транскриптомів молодих мишей, та відновлення когнітивних функцій.[78] Крім того, вплив препаратів канабісу сприяв омолодженню мозку через інші механізми, зокрема, через стимуляцію нейрогенезу.[79][80][81] (див. Медичний канабіс)
Біомолекулярна електроніка[ред. | ред. код]
Біоелектрика та біохімічні градієнти відіграють важливу роль у фізіологічних процесах і можуть впливати на фізіологічні процеси на молекулярному, клітинному та організмовому рівнях. Наприклад, мембранний потенціал спокою є вирішальним фактором у клітинних процесах, включаючи мітотичний поділ, що має потенційно вагомі наслідки для досліджень старіння. Міжклітинні сигнальні механізми та їхній вплив на епігенетичні модифікації дають змогу по-новому зрозуміти процес старіння та розробку цілеспрямованих втручань.[82]
Клінічне омолодження[ред. | ред. код]
Рандомізоване клінічне дослідження 2021 року показало, що 8 тижнів здорового способу життя — рослинно-орієнтована дієта + вітаміни + регулярна фізична активність — омолоджують біологічний (епігенетичний) вік людей у середньому на 3.2 роки (p=0.018)[25].
Також у 2021 році було задокументовано омолодження епігенетичного віку людини на 5 років всього за 7 місяців, за допомогою щоденної різноманітної рослинної дієти (особливо горіхи, овочі, насіння, ягоди та несолодкі фрукти), великої кількості різних дієтичних добавок (колаген, креатин, спермідин, лецитин, амінокислоти, вітаміни[10], поліфеноли, глюкозамін та інші)[11].
Дослідження 2020 року 35 дорослих здорових осіб від 65 років і старше показало, що 30 сеансів гіпербаричної терапії збільшуєть довжину теломер влітин крові на 20-30%, та зменшують кількість сенесцентних (старих) Т-лімфоцитів на 10-37%.[83]
Біологічний вік[ред. | ред. код]
Біологічний вік означає стан організму людини та його різноманітних систем і функцій. На відміну від хронологічного віку, який є просто показником тривалості життя людини, біологічний вік враховує низку факторів, які можуть впливати на загальний стан здоров’я та самопочуття організму. Ці фактори можуть включати вибір способу життя, наприклад, дієту та фізичні вправи, а також генетичні фактори та вплив токсинів навколишнього середовища.
Біологічний вік часто використовується як спосіб оцінки загального стану здоров’я людини та ризику вікових захворювань. Загалом біологічний вік людини вважається більш точним показником загального стану здоров’я, ніж її хронологічний вік. Це пояснюється тим, що хронологічний вік не враховує різні фактори, які можуть впливати на здоров’я людини, наприклад спосіб життя та вплив навколишнього середовища.
Вимірювання біологічного віку може бути складним, оскільки воно передбачає оцінку різноманітних факторів. Однак існує кілька методів, які зазвичай використовуються для оцінки біологічного віку, включаючи вимірювання біомаркерів у крові, оцінку фізіологічних функцій і використання алгоритмів для аналізу кількох факторів одночасно. Ці методи можуть надати точнішу картину загального стану здоров’я людини та ризику вікових захворювань.
Епігенетичний вік[ред. | ред. код]
Епігенетичний вік є мірою того, наскільки на ДНК людини вплинули різноманітні фактори навколишнього середовища, такі як дієта та спосіб життя. Епігенетичний вік стосується віку ДНК індивідуума на основі моделей хімічних модифікацій (знаних як «епігенетичні мітки»), які відбулися на їхніх генах з часом. На ці епігенетичні ознаки можуть впливати різні фактори навколишнього середовища, і вони можуть дати уявлення про загальний стан здоров’я та самопочуття людини.
Штучне зістарення[ред. | ред. код]
Протягом 4 тижнів група дослідників на чолі з професором Кешавом Сінгхом додавала до їжі гризунів антибіотик доксициклін, що призвело до генної мутації та, як наслідок, мітохондріальної дисфункції. В результаті шкіра піддослідних покрилася зморшками, шерсть випала, а та, що залишилася, посивіла. Коли препарат перестав потрапляти до організмів мишей, то доволі швидко їхня шкіра розгладилася, а шерсть знову стала густою та природного кольору. Фактично, вчені змогли зістарити грузинів, а потім повернути до молодого стану.[84]
Див. також[ред. | ред. код]
- Здоровий спосіб життя
- Збільшення тривалості життя
- Удосконалення людини
- Біохакінг
- Трансгуманізм
- Технологічна сингулярність
- Постлюдина
- Біологічне безсмертя
- Біопанк
Література[ред. | ред. код]
Книги[ред. | ред. код]
- Преодоление старости / Микола Амосов —1996.
- The Longevity Code: Slow Down the Aging Process and Live Well for Longer / Kris Verburgh, The Experiment, New York, 2019. ISBN 1615194975 & ISBN 9781615194971.
- Життєвий план: Чому ми старіємо і як цього уникнути / Девід Сінклер, Метью Лаплент, вид. BookChef, 2021. ISBN 978-966-993-576-2
Журнали[ред. | ред. код]
- Nature Aging
- Aging Cell
- Aging Research Reviews
- GeroScience
- Age and Ageing
- The Journal of Gerontology
- Neurobiology of Aging
- Frontiers in Aging Neuroscience
- Mechanisms of Aging and Development
- Experimental Gerontology
- Biogerontology
- Aging Clinical and Experimental Research
- DNA Repair
Статті[ред. | ред. код]
- Hallmarks of aging: An expanding universe. / López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (19 січня 2023). Cell (English) 186 (2). с.243–278. doi:10.1016/j.cell.2022.11.001
- The Hallmarks of Aging. / López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido. (2013). Cell 153 (6). с.1194–1217. ISSN 0092-8674. doi:10.1016/j.cell.2013.05.039
- A complex systems approach to aging biology. / Cohen, A.A., Ferrucci, L., Fülöp, T. et al. Nat Aging 2, 580–591 (2022). doi: 10.1038/s43587-022-00252-6
- Відкриття, яке дозволило створити дієвий спосіб системного омолодження організму: [монографія] / В.А Монастирський; Львів. нац. мед. ун- ім. Данила Галицького.— Львів: Ліга-Прес, 2015.— 131 c.— Бібліогр.: с. 128—131.
Відео[ред. | ред. код]
Посилання[ред. | ред. код]
- Люди (науковці та дослідники), що займаються проблематикою старіння та омолодження
- Компанії, що займаються проблематикою старіння та омолодження
- Lifespan.io — некомерційна організація, яка займається сприянням подовженню здорової тривалості життя людини. Містить багато акутальних досліджень.
- SENS Foundation
Примітки[ред. | ред. код]
- ↑ а б в г д López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (6 червня 2013). The Hallmarks of Aging. Cell (English) . Т. 153, № 6. с. 1194—1217. doi:10.1016/j.cell.2013.05.039. ISSN 0092-8674. Процитовано 16 серпня 2022.
- ↑ а б Cohen, Alan A.; Ferrucci, Luigi; Fülöp, Tamàs; Gravel, Dominique; Hao, Nan; Kriete, Andres; Levine, Morgan E.; Lipsitz, Lewis A.; Olde Rikkert, Marcel G. M. (2022-07). A complex systems approach to aging biology. Nature Aging (англ.). Т. 2, № 7. с. 580—591. doi:10.1038/s43587-022-00252-6. ISSN 2662-8465. Процитовано 16 серпня 2022.
- ↑ а б Smith, Jasmine (25 березня 2022). 9+1 Hallmarks of Aging: The Rejuve Approach. Rejuve.AI (англ.). Процитовано 17 серпня 2022.
- ↑ а б в López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (3 січня 2023). Hallmarks of aging: An expanding universe. Cell (англ.). doi:10.1016/j.cell.2022.11.001. ISSN 0092-8674. Процитовано 13 січня 2023.
- ↑ The Nobel Prize in Physiology or Medicine 2012. NobelPrize.org (амер.). Процитовано 9 січня 2023.
- ↑ Yang, Jae-Hyun; Hayano, Motoshi; Griffin, Patrick T.; Amorim, João A.; Bonkowski, Michael S.; Apostolides, John K.; Salfati, Elias L.; Blanchette, Marco; Munding, Elizabeth M. (19 січня 2023). Loss of epigenetic information as a cause of mammalian aging. Cell (English) . Т. 186, № 2. с. 305—326.e27. doi:10.1016/j.cell.2022.12.027. ISSN 0092-8674. PMID 36638792. Процитовано 19 березня 2023.
- ↑ Garth, Eleanor (7 серпня 2020). Evidence for tenth hallmark of aging increases with new paper. Longevity.Technology - Latest News, Opinions, Analysis and Research (en-GB) . Процитовано 29 березня 2023.
- ↑ Baechle, Jordan J.; Chen, Nan; Makhijani, Priya; Winer, Shawn; Furman, David; Winer, Daniel A. (15 червня 2023). Chronic inflammation and the hallmarks of aging. Molecular Metabolism (англ.). с. 101755. doi:10.1016/j.molmet.2023.101755. ISSN 2212-8778. Процитовано 3 липня 2023.
- ↑ Fitzgerald, Kara N.; Hodges, Romilly; Hanes, Douglas; Stack, Emily; Cheishvili, David; Szyf, Moshe; Henkel, Janine; Twedt, Melissa W.; Giannopoulou, Despina (12 квітня 2021). Potential reversal of epigenetic age using a diet and lifestyle intervention: a pilot randomized clinical trial. Aging (англ.). Т. 13, № 7. с. 9419—9432. doi:10.18632/aging.202913. ISSN 1945-4589. PMID 33844651. Процитовано 29 листопада 2022.
- ↑ а б Baker, Laura D.; Manson, Joann E.; Rapp, Stephen R.; Sesso, Howard D.; Gaussoin, Sarah A.; Shumaker, Sally A.; Espeland, Mark A. (14 вересня 2022). Effects of cocoa extract and a multivitamin on cognitive function: A randomized clinical trial. Alzheimer's & Dementia (англ.). с. alz.12767. doi:10.1002/alz.12767. ISSN 1552-5260. Процитовано 29 листопада 2022.
- ↑ а б https://twitter.com/maxhertan/status/1595213398358171649. Twitter (англ.). Процитовано 26 листопада 2022.
- ↑ blueprint. blueprint.bryanjohnson.co (англ.). Процитовано 18 березня 2023.
- ↑ Burford, Alex (21 лютого 2023). How To Be 18 Again (According To A Millionaire). Gowing Life (en-GB) . Процитовано 18 березня 2023.
- ↑ а б Chang, Le; Fan, Weiwen; Pan, Xinghua; Zhu, Xiangqing (20 квітня 2022). Stem cells to reverse aging. Chinese Medical Journal (амер.). Т. 135, № 8. с. 901. doi:10.1097/CM9.0000000000001984. ISSN 0366-6999. PMC 9276428. PMID 35089883. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Macip, Carolina Cano; Hasan, Rokib; Hoznek, Victoria; Kim, Jihyun; Metzger, Louis E.; Sethna, Saumil; Davidsohn, Noah (5 січня 2023). Gene Therapy Mediated Partial Reprogramming Extends Lifespan and Reverses Age-Related Changes in Aged Mice (англ.). с. 2023.01.04.522507. doi:10.1101/2023.01.04.522507v1.full. Процитовано 19 березня 2023.
- ↑ Lu, Yuancheng; Brommer, Benedikt; Tian, Xiao; Krishnan, Anitha; Meer, Margarita; Wang, Chen; Vera, Daniel L.; Zeng, Qiurui; Yu, Doudou (2020-12). Reprogramming to recover youthful epigenetic information and restore vision. Nature (англ.). Т. 588, № 7836. с. 124—129. doi:10.1038/s41586-020-2975-4. ISSN 1476-4687. PMC 7752134. PMID 33268865. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Browder, Kristen C.; Reddy, Pradeep; Yamamoto, Mako; Haghani, Amin; Guillen, Isabel Guillen; Sahu, Sanjeeb; Wang, Chao; Luque, Yosu; Prieto, Javier (2022-03). In vivo partial reprogramming alters age-associated molecular changes during physiological aging in mice. Nature Aging (англ.). Т. 2, № 3. с. 243—253. doi:10.1038/s43587-022-00183-2. ISSN 2662-8465. Процитовано 19 березня 2023.
- ↑ Yang, Jae-Hyun; Hayano, Motoshi; Griffin, Patrick T.; Amorim, João A.; Bonkowski, Michael S.; Apostolides, John K.; Salfati, Elias L.; Blanchette, Marco; Munding, Elizabeth M. (19 січня 2023). Loss of epigenetic information as a cause of mammalian aging. Cell (English) . Т. 186, № 2. с. 305—326.e27. doi:10.1016/j.cell.2022.12.027. ISSN 0092-8674. PMID 36638792. Процитовано 19 березня 2023.
- ↑ Parker, Aimée; Romano, Stefano; Ansorge, Rebecca; Aboelnour, Asmaa; Le Gall, Gwenaelle; Savva, George M.; Pontifex, Matthew G.; Telatin, Andrea; Baker, David (29 квітня 2022). Fecal microbiota transfer between young and aged mice reverses hallmarks of the aging gut, eye, and brain. Microbiome. Т. 10, № 1. с. 68. doi:10.1186/s40168-022-01243-w. ISSN 2049-2618. PMC 9063061. PMID 35501923. Процитовано 19 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Juricic, Paula; Lu, Yu-Xuan; Leech, Thomas; Drews, Lisa F.; Paulitz, Jonathan; Lu, Jiongming; Nespital, Tobias; Azami, Sina; Regan, Jennifer C. (2022-09). Long-lasting geroprotection from brief rapamycin treatment in early adulthood by persistently increased intestinal autophagy. Nature Aging (англ.). Т. 2, № 9. с. 824—836. doi:10.1038/s43587-022-00278-w. ISSN 2662-8465. Процитовано 19 березня 2023.
- ↑ Offord, Catherine (20 січня 2023). Stem cell factors reverse signs of aging in mice. Science (англ.). Т. 379, № 6629. с. 224—224. doi:10.1126/science.adg7353. ISSN 0036-8075. Процитовано 18 березня 2023.
- ↑ Babu, Mohan; Snyder, Michael (2023-06). Multi-Omics Profiling for Health. Molecular & Cellular Proteomics. Т. 22, № 6. с. 100561. doi:10.1016/j.mcpro.2023.100561. ISSN 1535-9476. PMC 10220275. PMID 37119971. Процитовано 14 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Hasin, Yehudit; Seldin, Marcus; Lusis, Aldons (5 травня 2017). Multi-omics approaches to disease. Genome Biology. Т. 18, № 1. с. 83. doi:10.1186/s13059-017-1215-1. ISSN 1474-760X. PMC 5418815. PMID 28476144. Процитовано 11 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Mavromatis, Lucas A.; Rosoff, Daniel B.; Bell, Andrew S.; Jung, Jeesun; Wagner, Josephin; Lohoff, Falk W. (19 квітня 2023). Multi-omic underpinnings of epigenetic aging and human longevity. Nature Communications (англ.). Т. 14, № 1. с. 2236. doi:10.1038/s41467-023-37729-w. ISSN 2041-1723. PMC 10115892. PMID 37076473. Процитовано 12 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б в Fitzgerald, Kara N.; Hodges, Romilly; Hanes, Douglas; Stack, Emily; Cheishvili, David; Szyf, Moshe; Henkel, Janine; Twedt, Melissa W.; Giannopoulou, Despina (12 квітня 2021). Potential reversal of epigenetic age using a diet and lifestyle intervention: a pilot randomized clinical trial. Aging (англ.). Т. 13, № 7. с. 9419—9432. doi:10.18632/aging.202913. ISSN 1945-4589. PMID 33844651. Процитовано 24 листопада 2022.
- ↑ Dreher, Mark L. (2018). Dietary patterns and whole plant foods in aging and disease. Part of the book series: Nutrition and Health (NH). Cham, Switzerland. ISBN 978-3-319-59180-3. OCLC 1023426648.
- ↑ Barad, Zsuzsanna; Augusto, Joana; Kelly, Áine M. (8 грудня 2022). Exercise‐induced modulation of neuroinflammation in aging. The Journal of Physiology (англ.). с. JP282894. doi:10.1113/JP282894. ISSN 0022-3751. Процитовано 10 грудня 2022.
- ↑ Carapeto, Priscila Viana; Aguayo-Mazzucato, Cristina (13 травня 2021). Effects of exercise on cellular and tissue aging. Aging. Т. 13, № 10. с. 14522—14543. doi:10.18632/aging.203051. ISSN 1945-4589. PMC 8202894. PMID 34001677. Процитовано 19 березня 2023.
- ↑ Poganik, Jesse R.; Zhang, Bohan; Baht, Gurpreet S.; Tyshkovskiy, Alexander; Deik, Amy; Kerepesi, Csaba; Yim, Sun Hee; Lu, Ake T.; Haghani, Amin (21 квітня 2023). Biological age is increased by stress and restored upon recovery. Cell Metabolism (англ.). doi:10.1016/j.cmet.2023.03.015. ISSN 1550-4131. Процитовано 23 квітня 2023.
- ↑ Ventriglio, Antonio; Sancassiani, Federica; Contu, Maria Paola; Latorre, Mariateresa; Di Slavatore, Melanie; Fornaro, Michele; Bhugra, Dinesh (2020). Mediterranean Diet and its Benefits on Health and Mental Health: A Literature Review. Clinical practice and epidemiology in mental health: CP & EMH. Т. 16, № Suppl-1. с. 156—164. doi:10.2174/1745017902016010156. ISSN 1745-0179. PMC 7536728. PMID 33029192. Процитовано 17 листопада 2022.
- ↑ Romagnolo, Donato F.; Selmin, Ornella I. (2016). Mediterranean diet: dietary guidelines and impact on health and disease. Part of the book series: Nutrition and Health (NH). Cham. ISBN 978-3-319-27969-5. OCLC 944122518.
- ↑ Dominguez LJ, Di Bella G, Veronese N, Barbagallo M (June 2021). Impact of Mediterranean Diet on Chronic Non-Communicable Diseases and Longevity. Nutrients. 13 (6): 2028. doi:10.3390/nu13062028. PMC 8231595. PMID 34204683.
- ↑ Eleftheriou D, Benetou V, Trichopoulou A, La Vecchia C, Bamia C (November 2018). Mediterranean diet and its components in relation to all-cause mortality: meta-analysis. The British Journal of Nutrition. 120 (10): 1081—1097. doi:10.1017/S0007114518002593. PMID 30401007.
- ↑ Ekmekcioglu C (2020). Nutrition and longevity - From mechanisms to uncertainties. Critical Reviews in Food Science and Nutrition. 60 (18): 3063—3082. doi:10.1080/10408398.2019.1676698. PMID 31631676.
- ↑ What Do We Know About Healthy Aging? (англ.). Процитовано 1 червня 2022.
- ↑ Dagfinn Aune, Edward Giovannucci, Paolo Boffetta, Lars T Fadnes, NaNa Keum, Teresa Norat, Darren C Greenwood, Elio Riboli, Lars J Vatten, Serena Tonstad (Червень 2017). Fruit and vegetable intake and the risk of cardiovascular disease, total cancer and all-cause mortality—a systematic review and dose-response meta-analysis of prospective studies. https://doi.org/10.1093/ije/dyw319. International Journal of Epidemiology, Volume 46, Issue 3, June 2017, Pages 1029–1056. Процитовано 1 грудня 2022.
- ↑ Schincaglia, Raquel; Pimentel, Gustavo; Mota, João (2 грудня 2017). Nuts and Human Health Outcomes: A Systematic Review. Nutrients (англ.). Т. 9, № 12. с. 1311. doi:10.3390/nu9121311. ISSN 2072-6643. Процитовано 5 серпня 2022.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Guo-Chong Chen, Xing Tong, Jia-Ying Xu, Shu-Fen Han, Zhong-Xiao Wan, Jia-Bi Qin, Li-Qiang Qin (25 Травня 2016). Whole-grain intake and total, cardiovascular, and cancer mortality: a systematic review and meta-analysis of prospective studies. academic.oup.com (eng) . The American Journal of Clinical Nutrition, Volume 104, Issue 1, July 2016, Pages 164–172.
- ↑ Liu, Lihua; Wang, Shan; Liu, Jianchao (2015-01). Fiber consumption and all-cause, cardiovascular, and cancer mortalities: A systematic review and meta-analysis of cohort studies. Molecular Nutrition & Food Research (англ.). Т. 59, № 1. с. 139—146. doi:10.1002/mnfr.201400449. Процитовано 1 грудня 2022.
- ↑ ukas Schwingshackl, Carolina Schwedhelm, Georg Hoffmann, Anna-Maria Lampousi, Sven Knüppel, Khalid Iqbal, Angela Bechthold, Sabrina Schlesinger, Heiner Boeing (Червень 2017). Food groups and risk of all-cause mortality: a systematic review and meta-analysis of prospective studies. https://doi.org/10.3945/ajcn.117.153148 (eng) . The American Journal of Clinical Nutrition, Volume 105, Issue 6. Процитовано 1 грудня 2022.
- ↑ Song, Mingyang; Fung, Teresa T.; Hu, Frank B.; Willett, Walter C.; Longo, Valter D.; Chan, Andrew T.; Giovannucci, Edward L. (1 жовтня 2016). Association of Animal and Plant Protein Intake With All-Cause and Cause-Specific Mortality. JAMA Internal Medicine. Т. 176, № 10. с. 1453—1463. doi:10.1001/jamainternmed.2016.4182. ISSN 2168-6106. Процитовано 2 грудня 2022.
- ↑ Schwingshackl, Lukas; Hoffmann, Georg (1 жовтня 2014). Monounsaturated fatty acids, olive oil and health status: a systematic review and meta-analysis of cohort studies. Lipids in Health and Disease. Т. 13, № 1. с. 154. doi:10.1186/1476-511X-13-154. ISSN 1476-511X. PMC 4198773. PMID 25274026. Процитовано 1 грудня 2022.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Tsugane S (June 2021). Why has Japan become the world's most long-lived country: insights from a food and nutrition perspective. European Journal of Clinical Nutrition. 75 (6): 921—928. doi:10.1038/s41430-020-0677-5. PMC 8189904. PMID 32661353.
- ↑ DeJong EN, Surette MG, Bowdish DM (August 2020). The Gut Microbiota and Unhealthy Aging: Disentangling Cause from Consequence. Cell Host & Microbe. 28 (2): 180—189. doi:10.1016/j.chom.2020.07.013. PMID 32791111.
- ↑ Low DY, Hejndorf S, Tharmabalan RT, Poppema S, Pettersson S (2021). Regional Diets Targeting Gut Microbial Dynamics to Support Prolonged Healthspan. Frontiers in Microbiology. 12: 659465. doi:10.3389/fmicb.2021.659465. PMC 8116520. PMID 33995322.
- ↑ Warman DJ, Jia H, Kato H (February 2022). The Potential Roles of Probiotics, Resistant Starch, and Resistant Proteins in Ameliorating Inflammation during Aging (Inflammaging). Nutrients. 14 (4): 747. doi:10.3390/nu14040747. PMC 8879781. PMID 35215397.
- ↑ Xu, Zhenjiang; Knight, Rob (2015-01). Dietary effects on human gut microbiome diversity. British Journal of Nutrition (англ.). Т. 113, № S1. с. S1—S5. doi:10.1017/S0007114514004127. ISSN 0007-1145. Процитовано 17 листопада 2022.
- ↑ Lozupone, Catherine A.; Stombaugh, Jesse I.; Gordon, Jeffrey I.; Jansson, Janet K.; Knight, Rob (13 вересня 2012). Diversity, stability and resilience of the human gut microbiota. Nature. Т. 489, № 7415. с. 220—230. doi:10.1038/nature11550. ISSN 0028-0836. PMC 3577372. PMID 22972295. Процитовано 17 листопада 2022.
- ↑ Heiman, Mark L.; Greenway, Frank L. (5 березня 2016). A healthy gastrointestinal microbiome is dependent on dietary diversity. Molecular Metabolism. Т. 5, № 5. с. 317—320. doi:10.1016/j.molmet.2016.02.005. ISSN 2212-8778. PMC 4837298. PMID 27110483. Процитовано 17 листопада 2022.
- ↑ Green CL, Lamming DW, Fontana L (January 2022). Molecular mechanisms of dietary restriction promoting health and longevity. Nature Reviews. Molecular Cell Biology. 23 (1): 56—73. doi:10.1038/s41580-021-00411-4. PMC 8692439. PMID 34518687.
- ↑ Childs, Bennett G.; Durik, Matej; Baker, Darren J.; van Deursen, Jan M. (2015-12). Cellular senescence in aging and age-related disease: from mechanisms to therapy. Nature Medicine (англ.). Т. 21, № 12. с. 1424—1435. doi:10.1038/nm.4000. ISSN 1546-170X. Процитовано 4 березня 2023.
- ↑ Di Micco, Raffaella; Krizhanovsky, Valery; Baker, Darren; d’Adda di Fagagna, Fabrizio (2021-02). Cellular senescence in ageing: from mechanisms to therapeutic opportunities. Nature Reviews Molecular Cell Biology (англ.). Т. 22, № 2. с. 75—95. doi:10.1038/s41580-020-00314-w. ISSN 1471-0080. Процитовано 4 березня 2023.
- ↑ van Deursen, Jan M. (17 травня 2019). Senolytic therapies for healthy longevity. Science (англ.). Т. 364, № 6441. с. 636—637. doi:10.1126/science.aaw1299. ISSN 0036-8075. PMC 6816502. PMID 31097655. Процитовано 4 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Partridge, Linda; Fuentealba, Matias; Kennedy, Brian K. (2020-08). The quest to slow ageing through drug discovery. Nature Reviews Drug Discovery (англ.). Т. 19, № 8. с. 513—532. doi:10.1038/s41573-020-0067-7. ISSN 1474-1784. Процитовано 4 березня 2023.
- ↑ Soma, Mounica; Lalam, Satya Kumar (2022-10). The role of nicotinamide mononucleotide (NMN) in anti-aging, longevity, and its potential for treating chronic conditions. Molecular Biology Reports. Т. 49, № 10. с. 9737—9748. doi:10.1007/s11033-022-07459-1. ISSN 1573-4978. PMID 35441939. Процитовано 19 березня 2023.
- ↑ Bonkowski MS, Sinclair DA (November 2016). Slowing ageing by design: the rise of NAD+ and sirtuin-activating compounds. Nature Reviews. Molecular Cell Biology. 17 (11): 679—690. doi:10.1038/nrm.2016.93. PMC 5107309. PMID 27552971.
- ↑ Sekhar RV (December 2021). GlyNAC Supplementation Improves Glutathione Deficiency, Oxidative Stress, Mitochondrial Dysfunction, Inflammation, Aging Hallmarks, Metabolic Defects, Muscle Strength, Cognitive Decline, and Body Composition: Implications for Healthy Aging. The Journal of Nutrition. 151 (12): 3606—3616. doi:10.1093/jn/nxab309. PMID 34587244.
- ↑ Edwards, Hope; Jones, Huw; Moseley, Jamie; Marshall, Thomas; El-Khamisy, Sherif F.; Aung, Myo Nyein; Farrow, Matthew (2023-05). Nutritional Supplementation for the Prevention of Muscle Atrophy in Older People. Nutrition Today (англ.). Т. 58, № 3. с. 105—118. doi:10.1097/NT.0000000000000606. ISSN 1538-9839. Процитовано 15 червня 2023.
- ↑ Takahashi, Kazutoshi; Yamanaka, Shinya (25 серпня 2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell (English) . Т. 126, № 4. с. 663—676. doi:10.1016/j.cell.2006.07.024. ISSN 0092-8674. PMID 16904174. Процитовано 12 лютого 2023.
- ↑ Yoshioka, Naohisa; Gros, Edwige; Li, Hai-Ri; Kumar, Shantanu; Deacon, Dekker C.; Maron, Cornelia; Muotri, Alysson R.; Chi, Neil C.; Fu, Xiang-Dong (1 серпня 2013). Efficient Generation of Human iPSCs by a Synthetic Self-Replicative RNA. Cell Stem Cell (English) . Т. 13, № 2. с. 246—254. doi:10.1016/j.stem.2013.06.001. ISSN 1934-5909. PMID 23910086. Процитовано 12 лютого 2023.
- ↑ Hou, Pingping; Li, Yanqin; Zhang, Xu; Liu, Chun; Guan, Jingyang; Li, Honggang; Zhao, Ting; Ye, Junqing; Yang, Weifeng (9 серпня 2013). Pluripotent Stem Cells Induced from Mouse Somatic Cells by Small-Molecule Compounds. Science (англ.). Т. 341, № 6146. с. 651—654. doi:10.1126/science.1239278. ISSN 0036-8075. Процитовано 12 лютого 2023.
- ↑ Langer, Robert; Vacanti, Joseph P. (14 травня 1993). Tissue Engineering. Science (англ.). Т. 260, № 5110. с. 920—926. doi:10.1126/science.8493529. ISSN 0036-8075. Процитовано 12 лютого 2023.
- ↑ Tissue Engineering and Regenerative Medicine. National Institute of Biomedical Imaging and Bioengineering (англ.). Процитовано 12 лютого 2023.
- ↑ Caddeo, Silvia; Boffito, Monica; Sartori, Susanna (2017). Tissue Engineering Approaches in the Design of Healthy and Pathological In Vitro Tissue Models. Frontiers in Bioengineering and Biotechnology. Т. 5. doi:10.3389/fbioe.2017.00040/full. ISSN 2296-4185. Процитовано 12 лютого 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Moysidou, Chrysanthi-Maria; Barberio, Chiara; Owens, Róisín Meabh (2021). Advances in Engineering Human Tissue Models. Frontiers in Bioengineering and Biotechnology. Т. 8. doi:10.3389/fbioe.2020.620962/full. ISSN 2296-4185. Процитовано 12 лютого 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Lu, Yuancheng; Brommer, Benedikt; Tian, Xiao; Krishnan, Anitha; Meer, Margarita; Wang, Chen; Vera, Daniel L.; Zeng, Qiurui; Yu, Doudou (2020-12). Reprogramming to recover youthful epigenetic information and restore vision. Nature (англ.). Т. 588, № 7836. с. 124—129. doi:10.1038/s41586-020-2975-4. ISSN 1476-4687. Процитовано 7 грудня 2022.
- ↑ Sewell, Patrick E (8 листопада 2021). Safety Study of AAV hTert and Klotho Gene Transfer Therapy for Dementia. Journal of Regenerative Biology and Medicine (англ.). doi:10.37191/Mapsci-2582-385X-3(6)-097. ISSN 2582-385X. Процитовано 14 червня 2023.
- ↑ Jessberger, Sebastian (2016). Stem Cell-Mediated Regeneration of the Adult Brain. Transfusion Medicine and Hemotherapy (english) . Т. 43, № 5. с. 321—327. doi:10.1159/000447646. ISSN 1660-3796. PMID 27781019. Процитовано 7 грудня 2022.
- ↑ 3 Reasons Why Brain Aging Might Soon Be Reversible | Psychology Today. www.psychologytoday.com (амер.). Процитовано 7 грудня 2022.
- ↑ Krukowski, Karen; Nolan, Amber; Frias, Elma S; Boone, Morgane; Ureta, Gonzalo; Grue, Katherine; Paladini, Maria-Serena; Elizarraras, Edward; Delgado, Luz (1 грудня 2020). Kapahi, Pankaj (ред.). Small molecule cognitive enhancer reverses age-related memory decline in mice. eLife. Т. 9. с. e62048. doi:10.7554/eLife.62048. ISSN 2050-084X. Процитовано 7 грудня 2022.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Drug Reverses Age-Related Mental Decline Within Days | UC San Francisco. www.ucsf.edu (англ.). Процитовано 7 грудня 2022.
- ↑ Can Aging be Reversed in the Brain?. Simons Foundation (амер.). 23 березня 2021. Процитовано 7 грудня 2022.
- ↑ Schroer, Adam B.; Ventura, Patrick B.; Sucharov, Juliana; Misra, Rhea; Chui, M. K. Kirsten; Bieri, Gregor; Horowitz, Alana M.; Smith, Lucas K.; Encabo, Katriel (16 серпня 2023). Platelet factors attenuate inflammation and rescue cognition in ageing. Nature (англ.). с. 1—9. doi:10.1038/s41586-023-06436-3. ISSN 1476-4687. Процитовано 19 серпня 2023.
- ↑ Sidik, Saima May (16 серпня 2023). Older mouse brains rejuvenated by protein found in young blood. Nature (англ.). doi:10.1038/d41586-023-02563-z. Процитовано 19 серпня 2023.
- ↑ Zhou, Yunxiang; Shao, Anwen; Xu, Weilin; Wu, Haijian; Deng, Yongchuan (2019). Advance of Stem Cell Treatment for Traumatic Brain Injury. Frontiers in Cellular Neuroscience. Т. 13. doi:10.3389/fncel.2019.00301/full. ISSN 1662-5102. Процитовано 7 грудня 2022.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Jgamadze, Dennis; Lim, James T.; Zhang, Zhijian; Harary, Paul M.; Germi, James; Mensah-Brown, Kobina; Adam, Christopher D.; Mirzakhalili, Ehsan; Singh, Shikha (2 лютого 2023). Structural and functional integration of human forebrain organoids with the injured adult rat visual system. Cell Stem Cell (English) . Т. 30, № 2. с. 137—152.e7. doi:10.1016/j.stem.2023.01.004. ISSN 1934-5909. PMID 36736289. Процитовано 28 лютого 2023.
- ↑ Plesa, Alexandru M.; Shadpour, Michael; Boyden, Ed; Church, George M. (2023-08). Transcriptomic reprogramming for neuronal age reversal. Human Genetics (англ.). Т. 142, № 8. с. 1293—1302. doi:10.1007/s00439-023-02529-1. ISSN 0340-6717. PMC 10066999. PMID 37004545. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Bilkei-Gorzo, Andras; Albayram, Onder; Draffehn, Astrid; Michel, Kerstin; Piyanova, Anastasia; Oppenheimer, Hannah; Dvir-Ginzberg, Mona; Rácz, Ildiko; Ulas, Thomas (2017-06). A chronic low dose of Δ9-tetrahydrocannabinol (THC) restores cognitive function in old mice. Nature Medicine (англ.). Т. 23, № 6. с. 782—787. doi:10.1038/nm.4311. ISSN 1546-170X. Процитовано 9 жовтня 2023.
- ↑ Suliman, Noor Azuin; Taib, Che Norma Mat; Moklas, Mohamad Aris Mohd; Basir, Rusliza (1 лютого 2018). Delta-9-Tetrahydrocannabinol (∆9-THC) Induce Neurogenesis and Improve Cognitive Performances of Male Sprague Dawley Rats. Neurotoxicity Research (англ.). Т. 33, № 2. с. 402—411. doi:10.1007/s12640-017-9806-x. ISSN 1476-3524. PMC 5766723. PMID 28933048. Процитовано 9 жовтня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Schuele, Lena-Louise; Schuermann, Britta; Bilkei-Gorzo, Andras; Gorgzadeh, Sara; Zimmer, Andreas; Leidmaa, Este (12 січня 2022). Regulation of adult neurogenesis by the endocannabinoid-producing enzyme diacylglycerol lipase alpha (DAGLa). Scientific Reports (англ.). Т. 12, № 1. с. 633. doi:10.1038/s41598-021-04600-1. ISSN 2045-2322. Процитовано 9 жовтня 2023.
- ↑ Komorowska-Müller, Joanna Agnieszka; Gellner, Anne-Kathrin; Ravichandran, Kishore Aravind; Bilkei-Gorzo, Andras; Zimmer, Andreas; Stein, Valentin (25 січня 2023). Chronic low-dose Δ9-tetrahydrocannabinol (THC) treatment stabilizes dendritic spines in 18-month-old mice. Scientific Reports (англ.). Т. 13, № 1. с. 1390. doi:10.1038/s41598-022-27146-2. ISSN 2045-2322. Процитовано 9 жовтня 2023.
- ↑ Anderson, Benjamin (2 квітня 2023). Bioelectricity: A top-down control model to promote more effective aging interventions. doi:10.31219/osf.io/xjfmt. Процитовано 14 червня 2023.
- ↑ Hachmo, Yafit; Hadanny, Amir; Hamed, Ramzia Abu; Daniel-Kotovsky, Malka; Catalogna, Merav; Fishlev, Gregory; Lang, Erez; Polak, Nir; Doenyas, Keren (18 листопада 2020). Hyperbaric oxygen therapy increases telomere length and decreases immunosenescence in isolated blood cells: a prospective trial. Aging (англ.). Т. 12, № 22. с. 22445—22456. doi:10.18632/aging.202188. ISSN 1945-4589. PMID 33206062. Процитовано 29 березня 2023.
- ↑ Вчені зістарили мишу, а потім повернули їй молодість. Tokar.ua (uk-UA) . 2 серпня 2018. Архів оригіналу за 30 листопада 2018. Процитовано 30 листопада 2018.
| |||||||||||
|