Алкалоїди


Алкало́їди (з пізньолат. alkali — луг; араб. al-qali — рослинна зола; дав.-гр. εἶδος — вид, вигляд)[2] — складні органічні азотовмісні сполуки лужної реакції переважно рослинного походження, також є продуктом життєдіяльності грибів та деяких нижчих тварин (молюски, жаби). Назву — перекладається як «подібні до лугів» — отримали через лужну реакцію водних розчинів перших ізольованих представників.
Крім карбону (C), гідрогену (H) і нітрогену (N) молекули алкалоїдів можуть містити атоми сульфуру (S), рідше — хлору (Cl), брому (Br) або фосфору (P)[3]. Майже всі алкалоїди мають високу біологічну активність, що обумовлено їхньою захисною функцією в рослинах. Це нелеткі, гіркі на смак, фізіологічно[4] і фармакологічно дуже активні речовини, часом отруйні або діють як наркотики. До них також належать схожі за будовою сполуки, що не мають лужних властивостей, наприклад, кофеїн (кава, чай), теобромін (кава), ефедрин. При реакції з кислотами утворюють солі. Більшість алкалоїдів у чистому вигляді — кристали, а деякі — рідини.
Відомо понад 5000 різноманітних алкалоїдів.
Назва[ред. | ред. код]

Назва «алкалоїди» (нім. Alkaloide) введена в 1819 році німецьким фармацевтом Карлом Мейбнером[de], утворена від пізньолат. alkali — «луг» (яка в свою чергу походить від араб. al qualja — «попіл рослин») та дав.-гр. εἶδος — «схожий», «вид». В широке використання термін увійшов тільки після публікації оглядової статті Оскара Якобсена в хімічному словнику Альберта Ладенбурга (1880)[5][6].
Назва окремих алкалоїдів[ред. | ред. код]
Єдиного методу призначення алкалоїдам тривіальних назв не існує[7]. В багатьох випадках алкалоїдам привласнюють назви, утворюючи їх шляхом приєднання суфікса «-ін» до видових або родових назв алкалоїдоносів. Наприклад, атропін виділений із рослини Беладона звичайна (лат. Atropa belladonna L.), стрихнін отриманий із насіння дерева Чилібуха (лат. Strychnos nux-vomica L.). При виділенні декількох алкалоїдів із однієї рослини замість суфікса «-ін» часто використовують суфікси «-ідін», «-анін», «-алін», «-інін» і т. п. Така практика призвела до того, що існує, наприклад, не менше 86 алкалоїдів, які містять в назві корінь «він» (виділені з барвінка, лат. Vinca)[8].
Історія[ред. | ред. код]

Рослини, які містять алкалоїди, використовувалися людиною з давніх часів як в лікарських, так і в рекреаційних цілях. Так, в Месопотамії лікарські рослини були відомі уже за 2000 років до н. е.[9] В «Одісеї» Гомера згадується подароване Єлені єгипетською царицею зілля, яке дарує «забуття лих». Вважається, що йшлося про засіб, який містив опіум[10]. В I—III ст. до н. е. в Китаї була написана «Книга домашніх рослин», в якій згадувалося медичне використання ефедри і опійного маку[11]. Також з давніх часів індійці Південної Америки використовували листки коки[12].
Екстракти рослин, які містять отруйні алкалоїди, такі як аконітин і тубокурарин[en], в минулому використовувалися для виготовлення отруйних стріл[9].
Вивчення алкалоїдів почалося в XIX ст. В 1804 році німецький фармацевт Фрідріх Сертюрнер виділив із опіуму «сонливий принцип» (лат. principium somniferum), який він назвав «морфієм» на честь Морфея, давньогрецьго бога снів (сучасна назва «морфін» належить французькому фізику Гей-Люссаку).
Значний доробок у хімію алкалоїдів на зорі її розвитку зробили французькі дослідники П'єр Пеллетє[ru] і Жозеф Каванту[en], які відкрили, зокрема, хінін (1820) і стрихнін (1818). Також протягом декількох наступних десятиліть були виділені ксантин[ru] (1817), атропін (1819), кофеїн (1820), коніїн (1827), нікотин (1828), колхіцин (1833), спартеїн (1851), кокаїн (1860) та інші[13].
Повний синтез алкалоїда вперше здійснений в 1886 р. для коніїну німецьким хіміком Альбертом Ладенбургом шляхом взаємодії 2-метилпіридину[ru] з ацетальдегідом і відновлення отриманого 2-пропенилпіридину за допомогою натрію[14][15].
Поява в XX столітті спектроскопії і хроматографії стало поштовхом до прискореного розвитку хімії алкалоїдів. Станом на 2008 рік відомо близько 12000 алкалоїдів[16].
Класифікація[ред. | ред. код]
В порівнянні з більшістю інших класів природних сполук, клас алкалоїдів відрізняється великим структурним різноманіттям. Єдиної класифікації алкалоїдів не існує[17].
Історично перша класифікація алкалоїдів об'єднувала їх в групи за ознакою походження із спільного природного джерела, наприклад, із рослин одоного роду. Це було виправдано недостатніми знаннями про хімічну будову алкалоїдів. В наш час така класифікація є застарілою[18].
Більш сучасні класифікації використовують об'єднання алкалоїдів в класи за ознакою будови вуглецево-азотного скелета молекули (хінолінові, пуринові, імідазольні, піридинові, піперидинові, піролідиновіпо індольні, ізохінолінові[en], тощо) або за біогенетичним попередником (орнітин[ru], лізин, тирозин, триптофан, тощо). Однак, при використанні таких схем в деяких випадках доводиться йти на компроміси[17]: так, нікотин містить як пиридинове ядро, яке походить від нікотинової кислоти, так і піролідинове ядро від орнітина[19], і тому його можна віднести до обох класів[20].
Алкалоїди часто поділяють на наступні великі групи[21]:
- Справжні — мають атом азоту в гетероциклі і біосинтетично походять з амінокислот, або з кислот нікотинової чи антранілової[22]. Приклад: атропін, нікотин, морфін. До цієї групи також відносять деякі алкалоїди, які містять, крім азотистих гетероциклів, терпенінові частини (як евонін[23]) або мають пептидну будову (як ерготамін[en][24]). До даної групи також часто відносять піперидинові алкалоїди коніїн і коніцеїн[25], але їх попередники не є амінокислотами[26].
- Протоалкалоїди (біогенні аміни) — містять азот поза циклом, але утворюються з амінокислот[22]. Приклади мескалін, адреналін і ефедрин.
- Поліамінні алкалоїди (похідні путресцину, спермідину і сперміну[en].
- Пептидні (циклопептидні[27]) алкалоїди.
- Псевдоалкалоїди (ізопреноїдні) — сполуки, подібні до алкалоїдів. Утворюються без участі амінокислоти[28], але за участю мевалонової кислоти і об'єднуються в групу незалежно від наявності гетероциклу. До цієї групи відносяться, в першу чергу, терпеноїдні і стероїдні алкалоїди[29]. Пуринові алкалоїди, такі як кофеїн, теобромін і теофілін, іноді відносять до псевдоалкалоїдів у зв'язку з особливостями їх біосинтезу[30]. Деякі автори до даної групи відносять такі сполуки, як ефедрин і катинон, які, хоч і походять від амінокислоти фенілаланін, але атом азоту вони отримують не від неї, а в результаті реакції амінотрансферази[30][31].
Деякі сполуки, віднесені за аналогією до того або іншого класу, не мають відповідного елемента вуглецевого скелету. Так, галантамін і гомоапорфіни не містять ізохінолінового ядра, але зазвичай відносяться до ізохінолінових алкалоїдів[32].
Основні класи мономерних алкалоїдів перераховані в наступній таблиці:
| Клас | Основні групи | Основні шляхи біосинтезу | Представники |
|---|---|---|---|
| Алкалоїди з азотними гетероциклами (справжні алкалоїди) | |||
Похідні піролідину[33] 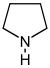 | Орнітин[en], або аргінін → путресцин → N-метилпутресцин → N-метил-Δ1-піролін[34] | Гігрин, гігролін, кускгігрін, стахідрін[33][35] | |
Похідні тропану[36]  | Група атропіну Замінники в позиціях 3, 6 або 7 | Орнітин, або аргінін → путресцин → N-метилпутресцин → N-метил-Δ1-піролін[34] | Атропін, скополамін, гіосціамін[33][36][37] |
| Група кокаїну Замінники в позиціях 2 і 3 | Кокаїн, екгонін[ru][36][38] | ||
Похідні піролізидину[ru][39]  | Неефірні | Орнітин, або аргінін → путресцин → гомоспермідин → ретронецин[34] | Ретронецин, геліотридин, лабурнін[39][40] |
| Складні ефіри монокарбонових кислот | Індицин, лінделофін, сарацин[39] | ||
| Макроциклічні диефіри | Платифілін, сенеціонін[ru], тріходесмін[39] | ||
Похідні піперидину[41]  | Лізин → кадаверин → Δ1-піперідеїн[42] | Седамін, лобелін[en], анаферін, піперин[en][25][43] | |
| Октанова кислота[en] → коніцеїн → коніїн[26] | Коніїн, коніцеїн[26] | ||
| Похідні хінолізидину[en][44][45] | Група люпиніну[en] | Лізин → кадаверин → Δ1-піперідеїн[46] | Люпинін[en], нуфарідин[44] |
| Група цитизину | Цитизин[44] | ||
| Група спартеїну | Спартеїн, лупанін, анагірин, пахикарпін[en][44] | ||
| Група матріну | Матрін, оксіматрін, аломатрідин, софоранол[44][47][48] | ||
| Група ормозаніну | Ормозанін, піптантін[44][49] | ||
| Група 9b-азафеналену | Гіпоказін, конвергін, кочінелін[50] | ||
| Група фенантрохінолізидину | Криптоплеврін, криптоплеврідин | ||
Похідні індолізидину[51]  | Лізин → δ-полуальдегід α-аміноадіпінової кислоти → піпеколіноваі кислота → 1-індолізидинон[52] | Свансонін, кастаноспермін[53] | |
Похідні піридину[54][55] 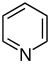 | Прості похідні піридину | Нікотинова кислота → дигідронікотинова кислота → 1,2-дигідропіридин[56] | Тригонелін, ріцинін, ареколін[54][57] |
| Поліциклічні неконденсовані похідні піридину | Нікотин, норнікотин, анабазин, анатабін[54][57] | ||
| Поліциклічні конденсовані похідні піридину | Актинідин, генціанін, педикулінін[58] | ||
| Сесквітерпеноїдні похідні піридину | Нікотинова кислота, ізолейцин | Евонін, гіпократеїн, гіпоглаунін, триптонін[55][56] | |
Похідні ізохіноліну[en] та зв'язані з ними алкалоїди[59]  | Прості похідні ізохіноліну[60] | Тирозин або фенілаланін → дофамін, або тирамін (для алкалоїдів амаріліса)[61][62] | Коріпалін, сальсолін, лофоцерин[59][60] |
| Похідні 1- і 3-ізохінолонів[63] | N-метилкоридальдін, нороксигідрастинін[63] | ||
| Похідні 1- і 4-фенілтетрагідроізохінолінів[60] | Криптостилін, херилін[60][64] | ||
| Похідні 5-нафтилізохіноліну[65] | Анцистрокладін, гаматін[65] | ||
| Похідні 1- і 2-бензилізохінолінів[66] | Папаверин, лауданозін, сендаверин | ||
| Група куларину[67] | Куларин, ягонін[67] | ||
| Павіни та ізопавіни[68] | Аргемонін, амуренсін[68] | ||
| Бензопіроколіни[69] | Криптаустолін[60] | ||
| Протоберберини[60] | Берберин, канадін, офіокарпін, мекамбрідин, коридалін[70] | ||
| Фталідизохіноліни[60] | Гідрастін[en], наркотін[en] (носкапін)[71] | ||
| Спіробензилізохіноліни[60] | Фумаріцин, охотенсін[68] | ||
| Алкалоїди іпекакуани [72] | Еметін, протоеметін, іпекозід[72] | ||
| Бензофенантридіни[60] | Сангвінарін, оксинітидін, коринолоксін[73] | ||
| Апорфіни[60] | Глауцин, корідин, ліриоденін[74] | ||
| Проапорфіни[60] | Пронуциферин, глаїовін[60][69] | ||
| Гомоапорфіни[75] | Крейсигін, мультифлорамін[75] | ||
| Гомопроапорфіни[75] | Бульбокодін[67] | ||
| Група морфіну[76] | Морфін, кодеїн, тебаїн[en], синоменін[77] | ||
| Гомоморфіни[78] | Крейсигінін, андроцимбін[76] | ||
| Трополоіохіноліни[60] | Імерубрин[60] | ||
| Азофлуорантени[60] | Руфесцин, імелутеїн[79] | ||
| Алкалоїди амарилісу[80] | Лікорин[en], амбелін, гіпеастрин, тазетин, галантамін, монтанін[81] | ||
| Алкалоїди еритрини[64] | Ерізодин, ерітроїдин[64] | ||
| Похідні фенантрену[60] | Атероспермінин, таліктуберин[60][70] | ||
| Протопіни[60] | Протопін, оксомурамін, корікавідин[73] | ||
| Арістолактами[60] | Дорифлавін[60] | ||
Похідні оксазолу[82]  | Тирозин → тирамін[83] | Анулолін, галфордінол, тексалін, тексамін[84] | |
Похідні тіазолу[85]  | 1-деоксі-D-ксилулози-5-фосфат (DOXP), тирозин, цистеїн[86] | Аргохелін, ностоцикламід, тіострептон[85][87] | |
Похідні хіназоліну[88]  | Похідні 3,4-дигідро-4-хіназолона | Антранілова кислота або фенілаланін або орнітин[ru][89] | Фебрифугін[90] |
| Похідні 1,4-дигідро-4-хіназолона | Глікорин, арборін (глікозин), глікозмінін[90] | ||
| Похідні піролідино- і піперідинохіназолінів | Вазицин (пеганін)[82] | ||
| Похідні акридину[82] | Антранілова кислота[91] | Рутакрідон, акроніцин, евоксантін[92][93] | |
Похідні хіноліну[94][95]  | Прості похідні хіноліну, похідні 2-хінолона і 4-хінолона | Антранілова кислота → 3-карбоксихінолін[96] | Куспарин, ехінопсин[ru], евокарпін[95][97][98] |
| Трициклічні терпеноїди | Фліндерсин[95][99] | ||
| Похідні фуранохіноліна | Диктамнін, фагарин, скиміанін[95][100][101] | ||
| Група хініну | Триптофан → триптамін → стриктозідин (з участю секологаніну) → корінантеал → цинхонінон[62][96] | Хінін, хінідин, цинхонін, цинхонідин[99] | |
Похідні індолу[77]  | Неізопреноїдні індольні алкалоїди | ||
| Прості похідні індолу[102] | Триптофан → триптамін або 5-гідрокситриптофан[103] | Серотонін, псилоцибін, диметилтриптамін (ДМТ), буфотенін[en][104][105] | |
| Прості похідні β-карболіну[en][106] | Гарман, гармін, гармалін[en], елеагнін[102] | ||
| Піролоіндольні алкалоїди[107] | Фізостигмін[en] (езерін), езерамін, фізовенін, ептастигмін[107] | ||
| Гемітерпеноїдні індольні алкалоїди | |||
| Алкалоїди спориння (ергоалкалоїди)[77] | Триптофан → ханоклавін → агроклавін → елімоклавін → паспалова кислота → лізергінова кислота[en][107] | Ерготамін[en], ергобазин, ергозин[108] | |
| Монотерпеноїдні індольні алкалоїди | |||
| Алкалоїди типу Corynanthe[103] | Триптофан → триптамін → стриктозідин (з участю секологаніну)[103] | Аймаліцин, сарпагін, вобазін, аймалін, акуамілин, йохимбин[en], резерпін, мітрагінін[109][110], група стрихніна (Стрихнін, бруцин, акуамицин, вомицин[111]) | |
| Алкалоїди типу Iboga | Ібогамін, ібогаїн, воакангін[103] | ||
| Алкалоїди типу Aspidosperma[en] | Вінкамін, вінкотин, аспідоспермін, квебрахамін[112][113] | ||
Похідні імідазолу[82] 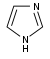 | Прямо із гістидину[114] | Гістамін, пілокарпін, долихотелін, пилозін, стівенсін[82][114] | |
Похідні пурину[115] 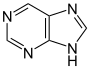 | Ксантозин (утворюється в процесі пуринового біосинтезу) → 7-метилксантозин → 7-метилксантин → теобромін → кофеїн[62] | Кофеїн, теобромін, теофілін, сакситоксин[116][117] | |
| Алкалоїди з азотом поза циклом (протоалкалоїди) | |||
Похідні β-фенілетиламіну[69] 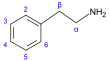 | Тирозин або фенілаланін → диоксифенілаланін → дофамін → адреналін і мескалін; тирозин → тирамін; фенілаланін → 1-фенілпропан-1,2-діон → катинон → ефедрин і псевдоефедрин[31][118][119] | Тирамін, горденін, ефедрин, псевдоефедрин, мескалін, катинон, катехоламіни (адреналін, норадреналін, дофамін)[118][120] | |
Колхіцинові алкалоїди[ru][121]  | Тирозин або фенілаланін → дофамін → аутумналін → колхіцин[122] | Колхіцин, колхамін[121] | |
Мускарини[123]  | Глутамінова кислота → 3-кетоглутамінова кислота → мускарини (з участь піровиноградної кислоти)[124] | Мускарин, аломускарин, епімускарин, епіаломускарин[123] | |
Бензиламіни[125] 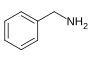 | Фенілаланін, з участю валіну, лейцину або ізолейцину[126] | Капсаїцин, дигідрокапсаїцин, нордигідрокапсаїцин[125][127] | |
| Поліамінні алкалоїди | |||
| Похідні путресцину[128] | Орнітин[ru] → путресцин → спермідин → спермін[en][129] | Пауцин[128] | |
| Похідні спермідину[128] | Інаденін-12-он, лунарин, кодонокарпин[128] | ||
| Похідні сперміну[en][128] | Вербасценін, афеландрін[128] | ||
| Пептидні (циклопептидні) алкалоїди | |||
| Пептидні алкалоїди с 13-членним циклом[27][130] | Тип нумуларіна C | Із різних амінокислот[27] | Нумуларін C, нумуларін S[27] |
| Тип зизифіна A | Зизифін A, сативанін H[27] | ||
| Пептидні алкалоїди с 14-членним циклом[27][130] | Тип франгуланіна | Франгуланін, скутіанін J[130] | |
| Тип скутіаніна A | Скутианін A[27] | ||
| Тип інтегерина | Інтегерин, дискарін D[130] | ||
| Тип амфібина F | Амфібин F, спинанін A[27] | ||
| Тип амфібина B | Амфібин B, лотузин C[27] | ||
| Пептидні алкалоїди с 15-членним циклом[130] | Тип мукроніна A | Мукронін A[24][130] | |
| Псевдоалкалоїди (терпени и стероїди) | |||
Дитерпени[24]  | Тип ликоктоніна | Мевалонова кислота → ізопентенілпірофосфат → геранілпірофосфат[131][132] | Аконітин, дельфинін[en][24][133] |
| Тип гетератизіна | Гетератизін[24] | ||
| Тип атизіна | Атизін[24] | ||
| Тип веатхіна | Веатхін[24] | ||
Стероїдні алкалоїди[134]  | Холестерин, аргінін[135] | Соласодин, соланідин, вералкамін[136] | |
Загальні відомості про дієві речовини лікарських рослин[ред. | ред. код]
Алкалоїди — це складні гетероциклічні сполуки, за допомогою яких відбувається перетворення і збереження азоту в рослинах (їх називають також азотовмісними сполуками). Вміст їх в рослинах невеликий (від 1—2 % до тисячної долі відсотка). Кількість алкалоїдів та їхній склад неоднакові не тільки в різних видах рослин, а й у різних частинах однієї рослини. Найбільше їх у плодах, листі та корінні рослин — від слідів до 2—3, дуже рідко (лише у корі хінного дерева) вміст алкалоїдів може досягати 10—15 %. Вміст алкалоїдів залежить від пори року та природних умов місцевості (складу ґрунту, вологості, клімату і т. ін.). Зазвичай, в рослині міститься не один, а кілька подібних за хімічною будовою алкалоїдів. Іноді понад 20. У рослинах алкалоїди перебувають у сполуках солей численних органічних (винної, лимонної, яблучної, мурашиної, цитринової, щавлевої, малонової, бурштинової, молочної, оцтової та ін.), іноді неорганічних кислот (сірчаної, фосфорної). Солі алкалоїдів добре розчиняються у воді (у вільному стані алкалоїди, зазвичай, не розчинні у воді).
Найбільше алкалоїдів у рослинах таких родин: макових, пасльонових, жовтецевих, метеликових.
Найвідоміші алкалоїди, що застосовуються у медицині, є в таких рослинах: у головках маку снотворного — морфін, у беладонні лікарській — атропін, у тютюнових листках — нікотин, у листках чаю китайського і зернах кави — кофеїн. Ринкова ціна хірально чистого Ксестоспонджину С — алкалоїду, вперше знайденого в тканинах австралійської губки Xestospongia exigua, а потім і в інших губках роду Xestospongia, становить близько 18 мільйонів доларів США за грам.[137].
Дія на людський організм[ред. | ред. код]
Ліки, виготовлені з алкалоїдних рослин, мають складну і багатогранну дію на живий організм. Вони активізують поділ клітин, підвищують артеріальний тиск, посилюють загальний обмін речовин, поліпшують секрецію травних залоз.
У медицині знайшли застосування такі алкалоїдні рослини, як чай, барбарис звичайний, чистотіл звичайний, головатень, маткові ріжки та ін.[138].
Наприклад, алкалоїд хелідонін, який є в чистотілі звичайному, розслаблює гладенькі м'язи кровоносних судин, знижуючи артеріальний тиск. Інші алкалоїди чистотілу — гомохелідонін і метоксихелідонін — впливають на обмін речовин та поділ клітин, завдяки чому перешкоджають росту й розвитку пухлин, тобто є антимітозними засобами.
Алкалоїд тирамін, виділений з омели білої і грициків, викликає звуження судин і підвищення артеріального тиску.
Атропін, екстрагований з дурману звичайного, блекоти чи беладонни, вибірково блокує М-холінорецептори. Після вживання атропіновмісних рослин зменшується секреція залоз травного апарату, розширюються зіниці очей, пульс прискорюється, знижується тонус гладеньких м'язів. Перебільшення допустимої дози атропіну може спричинити гостре отруєння: різке рухове збудження («лізе на стіни, мов блекоти об'ївся»), надмірне розширення зіниць, тахікардія, сухість шкіри і слизових оболонок.
Примітки[ред. | ред. код]
- ↑ Andreas Luch (2009). Molecular, clinical and environmental toxicology. Springer. с. 20. ISBN 3-7643-8335-6.
- ↑ Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг
- ↑ Химическая энциклопедия: Алкалоиды. Архів оригіналу за 14 січня 2011. Процитовано 4 листопада 2018.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 4.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 1—3.
- ↑ Oscar Jacobsen, "Alkaloide" in: Ladenburg, Handwörterbuch der Chemie (Breslau, Germany: Eduard Trewendt, 1882), vol. 1, pp. 213–422 [Архівовано 4 лютого 2017 у Wayback Machine.].
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 5.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 7.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 182
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 338.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 304.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 350.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 313—316.
- ↑ Большая советская энциклопедия : в 30 т. / главн. ред. А. М. Прохоров. — 3-е изд. — М. : «Советская энциклопедия», 1969—1978. (рос.)
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 204.
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology: Natural Products in Plants, Chemical Diversity of.
- ↑ а б Hesse M. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — P. 11.
- ↑ Орехов А. П. Химия алкалоидов. — 2-е изд. — М.: АН СССР, 1955. — С. 6.
- ↑ Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 109.
- ↑ Dewick P. M. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — P. 307.
- ↑ Hesse M. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — P. 12.
- ↑ а б Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — С. 223.
- ↑ Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 108.
- ↑ а б в г д е ж Hesse M. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — P. 84.
- ↑ а б Hesse M. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — P. 31.
- ↑ а б в Dewick P. M. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — P. 381.
- ↑ а б в г д е ж и к Gournelif D. C., Laskarisb G. G. and Verpoorte R. Cyclopeptide alkaloids // Nat. Prod. Rep. — 1997. — № 14. — P. 75—82.
- ↑ Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 11.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — С. 246.
- ↑ а б Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 12.
- ↑ а б Dewick P. M. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — P. 382.
- ↑ Hesse M. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — P. 44, 53.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — С. 224.
- ↑ а б в Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 75.
- ↑ Орехов А. П. Химия алкалоидов. — 2-е изд. — М.: АН СССР, 1955. — С. 33.
- ↑ а б в Химическая энциклопедия: Тропановые алкалоиды [Архівовано 24 жовтня 2016 у Wayback Machine.].
- ↑ Hesse M. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — P. 34.
- ↑ Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 27.
- ↑ а б в г Химическая энциклопедия: Пирролизидиновые алкалоиды [Архівовано 17 вересня 2016 у Wayback Machine.].
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — С. 229.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — С. 225.
- ↑ Aniszewski T. Alkaloids — secrets of life. — Amsterdam: 2007. — P. 95.
- ↑ Орехов А. П. Химия алкалоидов. — 2-е изд. — М.: АН СССР, 1955. — С. 80.
- ↑ а б в г д е Химическая энциклопедия: Хинолизидиновые алкалоиды [Архівовано 24 жовтня 2016 у Wayback Machine.].
- ↑ Saxton J. E. The Alkaloids. A Specialist Periodical Report. Vol. 1. — London: The Chemical Society, 1971. — P. 93.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 98.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 91.
- ↑ Joseph P. Michael. Indolizidine and quinolizidine alkaloids // Nat. Prod. Rep. — 2002. — № 19. — С. 458—475.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 92.
- ↑ Joseph P. Michael. Indolizidine and quinolizidine alkaloids // Nat. Prod. Rep. — 1999. — № 16. — С. 675—696.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 310.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 96.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 97.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 227.
- ↑ а б Химическая энциклопедия: Пиридиновые алкалоиды [Архівовано 21 жовтня 2016 у Wayback Machine.].
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 107.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 85.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 228.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 36.
- ↑ а б в г д е ж и к л м н п р с т у ф х ц Химическая энциклопедия: Изохинолиновые алкалоиды. Архів оригіналу за 24 жовтня 2016. Процитовано 6 листопада 2018.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — pp. 77—78.
- ↑ а б в Tadhg P. Begley. Encyclopedia of Chemical Biology: Alkaloid Biosynthesis
- ↑ а б J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 122.
- ↑ а б в Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 54.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 37.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 38.
- ↑ а б в Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 46.
- ↑ а б в Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 50.
- ↑ а б в Kenneth W. Bentley. β-Phenylethylamines and the isoquinoline alkaloids // Nat. Prod. Rep. — 1997. — № 14. — С. 387—411.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 47.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 39.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 41.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 49.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 44.
- ↑ а б в J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 164.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 51.
- ↑ а б в Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 236.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 163.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 3. — London: The Chemical Society, 1973. — p. 168.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 52.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 53.
- ↑ а б в г д Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 241
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — p. 261.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — pp. 260—263.
- ↑ а б Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 242.
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology: Cofactor Biosynthesis.
- ↑ John R. Lewis. Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids // Nat. Prod. Rep. — 2000. — № 17. — С. 57—84.
- ↑ Химическая энциклопедия: Хиназолиновые алкалоиды [Архівовано 24 жовтня 2016 у Wayback Machine.].
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 106.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 105.
- ↑ Richard B. Herbert. The biosynthesis of plant alkaloids and nitrogenous microbial metabolites // Nat. Prod. Rep. — 1999. — № 16. — С. 199—208.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 231, 246.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 58.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 231.
- ↑ а б в г Химическая энциклопедия: Хинолиновые алкалоиды [Архівовано 24 жовтня 2016 у Wayback Machine.].
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 114.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 205.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 55.
- ↑ а б Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 232.
- ↑ Орехов А. П. Химия алкалоидов. — Изд. 2. — М.: АН СССР, 1955. — с. 212.
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 118.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 112.
- ↑ а б в г Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 113.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 15.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 467.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 349—350.
- ↑ а б в Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 119.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 29.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — pp. 23—26.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 169.
- ↑ J. E. Saxton. The Alkaloids. A Specialist Periodical Report. Volume 5. — London: The Chemical Society, 1975. — p. 210.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — pp. 17—18.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 357.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 104
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 72.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 73.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 396.
- ↑ а б Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 110
- ↑ PlantCyc Pathway: ephedrine biosynthesis [Архівовано 2011-12-10 у Wayback Machine.].
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 76.
- ↑ а б Химическая энциклопедия: Колхициновые алкалоиды [Архівовано 24 жовтня 2016 у Wayback Machine.].
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: 2007. — p. 77.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 81.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 23. — Academic Press, 1984. — p. 376.
- ↑ а б Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 77.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 23. — Academic Press, 1984. — p. 268.
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 23. — Academic Press, 1984. — p. 231.
- ↑ а б в г д е Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 82.
- ↑ Spermine Biosynthesis [Архівовано 4 грудня 2016 у Wayback Machine.].
- ↑ а б в г д е Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 243.
- ↑ Химическая энциклопедия: Терпены [Архівовано 2 жовтня 2016 у Wayback Machine.].
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology: Natural Products: An Overview.
- ↑ Atta-ur-Rahman and M. Iqbal Choudhary. Diterpenoid and steroidal alkaloids // Nat. Prod. Rep. — 1997. — № 14. — С. 191—203.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — p. 88.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 388.
- ↑ Племенков В. В. Введение в химию природных соединений. — Казань: 2001. — с. 247.
- ↑ (-)-Xestospongin C на сайті Tocris. Архів оригіналу за 28 липня 2013. Процитовано 26 лютого 2013.
- ↑ Товстуха Є. С. Фітотерапія. — К.: Здоров'я, 1990.−304 с., іл., 6,55 арк. іл. ISBN 5-311-00418-5
Джерела[ред. | ред. код]
- Лікарські рослини: енциклопедичний довідник / відповідальний редактор. А. М. Гродзінський. — Київ : Видавництво «Українська енциклопедія» імені М. П. Бажана, Український виробничо-комерційний центр «Олімп», 1992. — 544 сторінки. — ISBN 5-88500-055-7. Ел.джерело
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Інвентаризація флори України (лікарські рослини – носії алкалоїдів) / Лебеда А.П. – К.: Академперіодика, 2006. – 264 с.
Література[ред. | ред. код]
- Біоорганічна хімія : підруч. для студ. вищих мед. та фармац. закл. освіти III-IV рівнів акредитації / Ю. І. Губський. - Вид. 2-ге, доопрац. та доп. - К. ; Вінниця : Нова Книга, 2007. - 431 с. - Бібліогр.: с. 408-409. - ISBN 978-966-382-045-3
- Кобзар А. Я. Фармакогнозія в медицині. – Київ: Медицина, 2007. - 100 с.
- Ковальов В. М., Павлій О. І, Ісакова Т. І. Фармакогнозія з основами біохімії рослин. – Харків: Прапор, . – 476 с.
- Основи фармакогнозії і фітотерапії / / За ред Т. П. Гарник , В.М. Князевича, В.А. Туманова. – Житомир: Рута, 2015. – 432 с. (див. он-лайн [Архівовано 13 березня 2017 у Wayback Machine.])
Посилання[ред. | ред. код]
- Головченко О. В. Алкалоїди [Архівовано 11 квітня 2022 у Wayback Machine.] // Велика українська енциклопедія. Дата звернення: 11.12.2019.
- Попова Н. В. Алкалоїди [Архівовано 29 листопада 2014 у Wayback Machine.] // Фармацевтична енциклопедія
- Руслан Примак. "Біографія " алкалоїдів [Архівовано 11 грудня 2019 у Wayback Machine.] // “Фармацевт Практик” #01’ 2013
- Ф. П. Трінус. Алкалоїди [Архівовано 29 жовтня 2020 у Wayback Machine.] // ЕСУ
| ||||||||||||||||||||||||||||||||||||||
| |||||
 | Це незавершена стаття з хімії. Ви можете допомогти проєкту, виправивши або дописавши її. |