Çiçek aşısı
 Vikipedi, özgür ansiklopedi
Vikipedi, özgür ansiklopedi
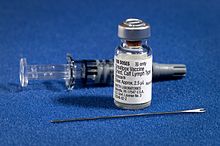 Dryvax kurutulmuş çiçek aşısı şişesi ve çatallı iğnenin yanında bir şırınga içinde çiçek aşısı seyrelticisi | |
| Aşı açıklaması | |
|---|---|
| Hedef | Çiçek hastalığı |
| Aşı türü | Canlı aşı |
| Klinik verisi | |
| Ticari adlar | ACAM2000, Imvanex, Jynneos, diğerleri |
| AHFS/Drugs.com | Monografi |
| Lisans veri | |
| Gebelik kategorisi |
|
| Uygulama yolu | Subkütan |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum | |
| Tanımlayıcılar | |
| DrugBank | |
| UNII | |
| KEGG | |
Çiçek aşısı, bulaşıcı bir hastalığa karşı geliştirilen ilk aşıdır. 1796 yılında İngiliz doktor Edward Jenner, nispeten hafif olan sığır çiçeği virüsü enfeksiyonunun ölümcül çiçek virüsüne karşı bağışıklık kazandırdığını göstermiştir. Sığır çiçeği, 20. yüzyılda modern çiçek aşısı ortaya çıkana kadar doğal bir aşı görevi gördü. Dünya Sağlık Örgütü (DSÖ), 1958'den 1977'ye kadar çiçek hastalığını ortadan kaldıran küresel bir aşılama kampanyası yürütmüş ve çiçek hastalığını ortadan kaldırılan tek insan hastalığı haline getirmiştir. Artık halka rutin çiçek aşısı yapılmasa da aşı biyoterörizm, biyolojik savaş ve mpox'a karşı korunmak için hala üretilmektedir.[9][10]
Aşı (İngilizce: vaccine) terimi, çiçek aşısının kökenini yansıtan Latince inek (Latince: vacca) kelimesinden türemiştir. Edward Jenner çiçek hastalığından variolae vaccinae (inek çiçek hastalığı) olarak bahsetmiştir. Çiçek aşısının kökenleri, özellikle Louis Pasteur'ün 19. yüzyılda aşı oluşturmak için laboratuvar teknikleri geliştirmesinden sonra, zaman içinde bulanıklaştı.[11] Allan Watt Downie 1939'da modern çiçek aşısının serolojik olarak inek çiçeğinden farklı olduğunu göstermiş[12] ve daha sonra vaccinia ayrı bir viral tür olarak kabul edilmiştir. Tüm genom dizilimi, vaccinia'nın en çok at çiçeği ile yakından ilişkili olduğunu ve Büyük Britanya'da bulunan inek çiçeği suşlarının vaccinia ile en az yakından ilişkili olduğunu ortaya koymuştur.[13]
Türler[değiştir | kaynağı değiştir]
En eski aşı olan çiçek aşısı, tıbbi teknolojinin birkaç neslinden geçmiştir. Aşı, 1796'dan 1880'lere kadar koldan kola aşılama yoluyla bir kişiden diğerine aktarılmıştır. Çiçek aşısı 1840'lardan itibaren sığırlarda başarıyla sürdürüldü ve buzağı lenf aşısı 1880'lerde önde gelen çiçek aşısı haline geldi. Canlı hayvanların derisi üzerinde yetiştirilen birinci nesil aşılar, çiçek hastalığını ortadan kaldırmak için 1950-1970'lerde yaygın olarak dağıtılmıştır. İkinci nesil aşılar daha fazla saflık için koryoallantoik membran veya hücre kültürlerinde yetiştirildi ve çiçek hastalığını yok etme kampanyası sırasında bazı bölgelerde kullanıldı. Üçüncü nesil aşılar zayıflatılmış vaccinia suşlarına dayanmaktadır ve çiçek hastalığının ortadan kaldırılmasından önce sınırlı kullanım görmüştür.[14]
Her üç nesil aşı da stoklarda mevcuttur. Birinci ve ikinci nesil aşılar canlı zayıflatılmamış vaccinia virüsü içerir ve alıcıların küçük bir yüzdesinde ciddi yan etkilere neden olabilir, buna milyon aşı başına 1-10 kişide ölüm de dahildir. Üçüncü nesil aşılar, zayıflatılmış vaccinia suşlarının daha hafif yan etkileri nedeniyle çok daha güvenlidir.[14] İkinci ve üçüncü nesil aşılar halen üretilmekte olup, biyoterörizm ve biyolojik savaş korkuları nedeniyle 2000'li yıllarda üretim kapasitesi artırılmıştır.
Birinci nesil[değiştir | kaynağı değiştir]
Birinci nesil aşılar, canlı hayvanların derisinde canlı vaccinia virüsü yetiştirilerek üretilmektedir. Birinci nesil aşıların çoğu ineklerin derisinde yetiştirilen buzağı lenf aşılarıdır, ancak koyunlar da dahil olmak üzere başka hayvanlar da kullanılmıştır.[14] 1950'lerde dondurularak kurutulmuş aşının geliştirilmesi, vaccinia virüsünün soğutma olmadan uzun süre korunmasını mümkün kılmış ve Dryvax gibi dondurularak kurutulmuş aşıların bulunmasını sağlamıştır.[15][16]:115
Aşı, aşı solüsyonunu çatalda tutan çatallı bir iğne ile derinin çoklu delinmesi (skarifikasyon) yoluyla uygulanır.[17] Deri alkol yerine su ile temizlenmelidir, çünkü alkol vaccinia virüsünü etkisiz hale getirebilir.[16]:292[18] Alkol kullanılırsa, aşı uygulanmadan önce tamamen buharlaşmasına izin verilmelidir.[16]:292 Aşılama, irinle dolan ve sonunda kabuklanan bir deri lezyonu ile sonuçlanır. Lokalize vaccinia enfeksiyonunun bu belirtisi aşı "alımı" olarak bilinir ve çiçek hastalığına karşı bağışıklığı gösterir. Kabuk 2-3 hafta sonra düşecek ve geride bir aşı izi bırakacaktır.[19]
Birinci nesil aşılar canlı, zayıflatılmamış vaccinia virüsünden oluşur. İlk kez aşı olanların üçte birinde okulu, işi veya diğer aktiviteleri kaçıracak veya uyumakta zorluk çekecek kadar önemli yan etkiler gelişir. Aşıyı ilk kez alan çocukların %15-20'sinde 39 °C üzerinde ateş gelişir. Aşı lezyonu virüsü diğer insanlara bulaştırabilir.[19] Nadir görülen yan etkiler arasında aşı sonrası ensefalit ve miyoperikardit yer alır.[19][20] Birçok ülke birinci nesil çiçek aşılarını stoklamıştır. 2006 yılında Almanya ve Hollanda'da toplu aşılama yapılması halinde meydana gelecek kayıplara ilişkin yapılan bir tahmin analizinde, New York City Sağlık Kurulu suşu ile aşılandıktan sonra Hollanda'da toplam 9,8 kişinin, Almanya'da ise 46,2 kişinin kontrolsüz vaccinia enfeksiyonundan öleceği tahmin edilmiştir. Diğer suşlara dayalı aşılar için daha fazla ölüm öngörülmüştür: Lister (55.1 Hollanda, 268.5 Almanya) ve Bern (303.5 Hollanda, 1,381 Almanya).[21][22]
İkinci nesil[değiştir | kaynağı değiştir]
İkinci nesil aşılar, koryoallantoik membran veya hücre kültüründe yetiştirilen canlı vaccinia virüsünden oluşur. İkinci nesil aşılar da çatallı bir iğne ile kazıma yoluyla uygulanır ve klonlanmış birinci nesil vaccinia suşu ile aynı yan etkileri taşırlar. Bununla birlikte, yumurta veya hücre kültürü kullanımı steril bir ortamda aşı üretimine izin verirken, birinci nesil aşı, aşının üzerinde yetiştirildiği hayvanın deri bakterilerini içerir.[14]
Ernest William Goodpasture, Alice Miles Woodruff ve G. John Buddingh 1932 yılında tavuk embriyolarının koryoallantoik membranında vaccinia virüsü geliştirmiştir.[23] Teksas Sağlık Departmanı 1939 yılında yumurta bazlı aşı üretmeye başladı ve 1948 yılında aşılama kampanyalarında kullanmaya başladı. [16]:588 Lederle Laboratories, Avianized çiçek aşısını 1959 yılında Amerika Birleşik Devletleri'nde satmaya başlamıştır.[24] Yumurta bazlı aşı Brezilya, Yeni Zelanda ve İsveç'te de yaygın olarak ve diğer birçok ülkede daha küçük ölçekte kullanılmıştır. Sıcaklık stabilitesi ve avian sarkoma lökoz virüsü ile ilgili endişeler, eradikasyon kampanyası sırasında daha yaygın olarak kullanılmasını engelledi, ancak Brezilya ve İsveç'te tavuklarda ASLV bulunmasına rağmen lösemide artış görülmedi.[16]:588
Vaccinia ilk olarak 1931 yılında Thomas Milton Rivers tarafından hücre kültüründe yetiştirilmiştir. DSÖ, 1960'larda Hollanda Ulusal Halk Sağlığı ve Çevre Enstitüsünde (RVIM) Lister/Elstree suşunun tavşan böbrek hücrelerinde yetiştirilmesine yönelik çalışmaları finanse etmiş ve 1973 yılında 45.443 Endonezyalı çocukta test ederek aynı buzağı lenf aşısı suşuyla karşılaştırılabilir sonuçlar elde etmiştir.[16]:588–589 2000'li yıllarda Lister suşundan iki başka hücre kültürü aşısı geliştirilmiştir: Elstree-BN (Bavarian Nordic) ve VV Lister CEP (Chicken Embryo Primary, Sanofi Pasteur).[14][25][26] Lister/Elstree-RVIM Hollanda'da stoklandı ve Elstree-BN stoklar için bazı Avrupa ülkelerine satıldı.[14] Ancak Sanofi, 2008 yılında Acambis'i satın aldıktan sonra kendi aşısını bırakmıştır.
ACAM2000, çiçek aşısını 2017 yılında Emergent Biosolutions'a satmadan önce 2008 yılında Sanofi Pasteur tarafından satın alınan Acambis tarafından geliştirilen bir aşıdır. Altı vaccinia suşu 3.000 doz Dryvax'tan izole edilmiş ve virülans açısından önemli farklılıklar gösterdiği bulunmuştur. Genel Dryvax karışımına en benzer virülansa sahip suş seçildi ve ACAM1000 aşısını yapmak için MRC-5 hücrelerinde büyütüldü. ACAM1000'in başarılı bir Faz I denemesinin ardından, virüs Vero hücrelerinde üç kez pasajlanarak ACAM2000 geliştirildi ve bu aşı Baxter'da seri üretime girdi. Amerika Birleşik Devletleri 1999-2001 yıllarında stokları için 200 milyon dozdan fazla ACAM2000 sipariş etmiştir ve süresi dolan aşıların yerine üretim devam etmektedir.[27][28]
Üçüncü nesil[değiştir | kaynağı değiştir]
Üçüncü nesil aşılar, çok daha az öldürücü olan ve daha az yan etki taşıyan zayıflatılmış vaccinia virüslerine dayanmaktadır. Zayıflatılmış virüsler çoğalabilir veya çoğalmayabilir.[14]
MVA[değiştir | kaynağı değiştir]
Modifiye vaccinia Ankara (MVA, Almanca: Modifiziertes Vakziniavirus Ankara), Batı Almanya'da seri pasajlama yoluyla geliştirilen, çoğalmaya yetkin olmayan bir aşı çeşididir. Orijinal Ankara aşı suşu Ankara, Türkiye'deki aşı enstitüsünde eşekler ve inekler üzerinde muhafaza edilmiştir. Ankara suşu 1953 yılında Batı Almanya'ya götürülmüş ve burada Herrlich ve Mayr tarafından Münih Üniversitesinde koryoallantoik membran üzerinde üretilmiştir. 572 seri pasajdan sonra, vaccinia virüsü genomunun %14'ünden fazlasını kaybetmişti ve artık insan hücrelerinde çoğalamıyordu. MVA 1977-1980 yılları arasında Batı Almanya'da kullanıldı, ancak çiçek hastalığının ortadan kaldırılması aşılama kampanyasını sadece 120.000 dozdan sonra sona erdirdi.[29]
MVA, çoğaltıcı aşılara göre daha az antikor üretimini uyarır.[30] Çiçek hastalığı eradikasyon kampanyası sırasında MVA, yan etkileri azaltmak için çoğalan aşıdan önce uygulanacak bir ön aşı veya çoğalan aşıdan yüksek risk altında olan kişilere güvenli bir şekilde verilebilecek alternatif bir aşı olarak düşünülmüştür.[16]:585 Japonya MVA'yı değerlendirmiş ve düşük immünojenitesi nedeniyle reddetmiş, bunun yerine kendi zayıflatılmış aşısını geliştirmeye karar vermiştir.[31] 2000'li yıllarda MVA hayvan modellerinde çok daha yüksek dozlarda test edilmiştir.[32] MVA maymunlara Dryvax'ın 40 katı dozda verildiğinde, daha az yan etkiye neden olurken daha hızlı bir bağışıklık tepkisi uyarmaktadır.[33]
MVA-BN[değiştir | kaynağı değiştir]
MVA-BN (aynı zamanda şu adlarla da bilinir: Avrupa Birliği'nde Imvanex; Kanada'da Imvamune ve Jynneos)[34][35] Bavarian Nordic tarafından MVA'nın hücre kültüründe çoğaltılmasıyla üretilen bir aşıdır. Çoğalan aşıların aksine, MVA-BN deri altı yolla enjeksiyon yoluyla uygulanır ve aşının "alınması" ile sonuçlanmaz.[36] "Alım" veya "majör kutanöz reaksiyon" püstüler bir lezyon veya kabuk veya ülser olabilen merkezi bir lezyonu çevreleyen belirli bir endurasyon veya konjesyon alanıdır.[37]
MVA-BN, mevcut doz sayısını artırmak için intradermal olarak da uygulanabilir.[38] Bağışıklık sistemi baskılanmış hastalar ve vaccinia enfeksiyonu riski altında olanlar için daha güvenlidir.[kaynak belirtilmeli] MVA-BN Avrupa Birliği,[8] Kanada[39][40][41] ve Amerika Birleşik Devletleri'nde[42][43] onaylanmıştır. Klinik çalışmalar MVA-BN'nin ACAM2000 kadar güvenli ve immünojenik olduğunu ortaya koymuştur.[44][45][46] Bu aşı aynı zamanda mpox'a karşı kullanım için de onaylanmıştır.[47][48][49]
LC16m8[değiştir | kaynağı değiştir]
LC16m8, Japonya'da Kaketsuken tarafından üretilen, çoğalan zayıflatılmış bir vaccinia suşudur. Japonya'daki Chiba Serum Enstitüsünde çalışan So Hashizume, Lister suşunu birincil tavşan böbrek hücrelerinde 45 kez pasajlamış, 36, 42 ve 45. pasajlardan sonra klonları koryoallantoik membran üzerinde büyütmek ve pock boyutu için seçmek üzere süreci kesintiye uğratmıştır. Ortaya çıkan varyant LC16m8 (Lister klon 16, orta (medium) pocklar, klon 8) olarak adlandırılmıştır. Ağır hasarlı MVA'nın aksine, LC16m8 atasal vaccinia'da bulunan her geni içerir. Bununla birlikte, tek nükleotitli bir delesyon, membran proteini B5R'yi 317 kalıntı uzunluğundan 92'ye keser. Kesilen protein hücre dışı zarflı virüs üretimini azaltmasına rağmen, hayvan modelleri diğer membran proteinlerine karşı antikorların bağışıklık için yeterli olduğunu göstermiştir. LC16m8, 50.000'den fazla çocukta test edildikten sonra 1975 yılında Japonya'da onaylanmıştır. LC16m8 ile aşılama bir aşı "alımına" neden olur, ancak güvenlik MVA'ya benzerdir.[31]
Güvenlik[değiştir | kaynağı değiştir]
Vaccinia bulaşıcıdır, bu da etkinliğini artırır, ancak bağışıklık sistemi zayıflamış (örneğin kemoterapi görenler ve AIDS hastaları) veya egzama öyküsü olan kişilerde ciddi komplikasyonlara neden olur ve hamile kadınlar için güvenli kabul edilmez.[50] Gebe kalmayı planlayan bir kadın çiçek aşısı olmamalıdır. Sadece zayıflatılmış vaccinia virüsleri (zayıflatılmış virüs, seri pasajlama yoluyla patojenitesi azaltılmış virüstür) içeren aşılar önerilmiştir, ancak bazı araştırmacılar[kim?] böyle bir aşının olası etkinliğini sorgulamıştır. ABD Hastalık Kontrol ve Korunma Merkezlerine (CDC) göre, "virüse maruz kaldıktan sonraki 3 gün içinde aşı sizi hastalığa yakalanmaktan koruyabilir. Yine de hastalığa yakalanırsanız aşılanmamış bir kişiye göre çok daha az hastalanabilirsiniz. Virüse maruz kaldıktan sonraki 4 ila 7 gün içinde, aşı muhtemelen hastalığa karşı bir miktar koruma sağlar. Yine de hastalığa yakalanırsanız aşılanmamış bir kişinin yakalanacağı kadar hastalanmayabilirsiniz."[51]
Mayıs 2007'de ABD Gıda ve İlaç Dairesi (FDA) Aşılar ve İlgili Biyolojik Ürünler Danışma Komitesi (VRBPAC), Acambis tarafından üretilen yeni bir canlı virüs aşısı olan ACAM2000'in çiçek virüsüne maruz kalma riski yüksek olan kişilerde kullanım için hem güvenli hem de etkili olduğuna oybirliğiyle karar verdi. Bununla birlikte, ciddi yan etki oranının yüksek olması nedeniyle, aşı yalnızca Stratejik Ulusal Stok için CDC'nin kullanımına sunulacaktır.[52]
Stoklar[değiştir | kaynağı değiştir]
Çiçek hastalığının kökü kazındığından beri halk hastalığa karşı rutin olarak aşılanmamaktadır. Dünya Sağlık Örgütü, hastalığın yeniden ortaya çıkmasını önlemek amacıyla 1980 yılında 200 milyon dozluk bir aşı stoku oluşturmuş, ancak 1980'lerin sonunda çiçek hastalığı geri dönmeyince stokun %99'u imha edilmiştir.[14] 2001'deki 11 Eylül saldırılarından sonra birçok hükümet biyoterörizm korkusuyla yeniden aşı stokları oluşturmaya başladı. Bazı şirketler 1970'lerde ürettikleri aşı stoklarını sattı ve çiçek aşısı üretimi yeniden başladı.[53] Aventis Pasteur 1950'lerden kalma bir stok keşfetti ve bunu ABD hükümetine bağışladı.[54]
Yeni aşıların stokları, son kullanma tarihlerini taşıdıkları için periyodik olarak yeniden satın alınmalıdır. Amerika Birleşik Devletleri 2019 yılına kadar 269 milyon doz ACAM2000 ve 28 milyon doz MVA-BN almıştı,[55][56] ancak 2022 maymun çiçeği salgını başladığında stoktan sadece 100 milyon doz ACAM2000 ve 65.000 doz MVA-BN hala mevcuttu.[57] Birinci nesil aşıların belirli bir son kullanma tarihi yoktur ve derin dondurucuda süresiz olarak canlı kalırlar. ABD'nin WetVax stoku 1956-1957 yıllarında üretilmiş ve o zamandan beri -4 °F'de (-20 °C) muhafaza edilmiştir[58] ve 2004 yılında test edildiğinde hala etkiliydi.[59] Çoğalan aşılar 1:10 seyreltmede bile etkili olmaya devam etmektedir, bu nedenle sınırlı sayıda doz çok daha büyük bir nüfusu kapsayacak şekilde genişletilebilir.[59]
| Ülke, bölge veya kuruluş | Yıl | Dozlar (milyon) | Kompozisyon (nesil) |
|---|---|---|---|
| 2013 | 2,7 |
| |
| 2018 | 27 | Çeşitli (1, 2, 3.)[60][61] | |
| 2006 | 55 | 55 milyon Pourquier (1.)[62] | |
| 2022 | 100 | ||
| 2022 | 5[63] | ||
| 2006 | 56 | LC16m8 (3.)[31] | |
| 2017 | ? | Lister/Elstree-RVIM (2.)[16]:588–589 | |
| 2022 | 35 | Lancy-Vaxina (1.)[64][65] | |
| 2022 | 185 |
Tarihçe[değiştir | kaynağı değiştir]
Variolasyon[değiştir | kaynağı değiştir]
Çiçek hastalığının şiddetli formu olan variola major'un ölüm oranı aşılama olmadan çok yüksekti, bazı salgınlarda %35'e kadar çıkıyordu.[66] İnokülasyon, insüflasyon ya da "variolasyon" olarak bilinen bağışıklık kazandırma yöntemi, modern bir aşı geliştirilmeden önce uygulanmış ve muhtemelen uygulama Avrupa'ya gelmeden çok önce Afrika ve Çin'de görülmüştür.[67] Hindistan'da da uygulanmış olabilir, ancak bu tartışmalıdır; diğer araştırmacılar Hindistan'ın eski Sanskrit tıp metinlerinin bu teknikleri tanımlamadığını iddia etmektedir.[67][68] Çiçek inokülasyonuna ilk açık atıf Çinli yazar Wan Quan (1499-1582) tarafından 1549 yılında yayınlanan Douzhen xinfa (痘疹心法) adlı eserinde yapılmıştır.[69] Ming Hanedanı döneminde Longqing (hükümdarlık dönemi 1567-1572) dönemine kadar Çin'de çiçek aşısının yaygın olmadığı görülmektedir.[70] Çin'de toz haline getirilmiş çiçek hastalığı kabukları sağlıklı kişilerin burunlarına üflenirdi. Hastalar daha sonra hafif bir hastalık vakası geliştirir ve o andan itibaren hastalığa karşı bağışıklık kazanırdı. Bu teknik %0,5-2 ölüm oranına sahipti, ancak bu oran hastalığın kendisinin %20-30 ölüm oranından oldukça düşüktü. Çin'deki inokülasyon uygulamasına ilişkin iki rapor 1700 yılında Londra'daki Royal Society'ye ulaştı; biri Çin'de görev yapan Doğu Hindistan Şirketinin bir çalışanından rapor alan Dr. Martin Lister tarafından, diğeri ise Clopton Havers tarafından.[71] Voltaire'e (1742) göre Türkler inokülasyon yöntemini komşu Çerkesya'dan almışlardır. Voltaire, Çerkeslerin bu tekniği nereden aldıkları konusunda spekülasyon yapmaz, ancak Çinlilerin "bu yüzyıldır" bunu uyguladıklarını bildirir.[72]
Variolasyon, 17. yüzyılın ikinci yarısı boyunca Türkiye, İran ve Afrika'daki hekimler tarafından da uygulanmıştır. 1714 ve 1716 yıllarında, İstanbul'daki İngiliz Büyükelçiliğine bağlı bir doktor olan Emmanuel Timoni ve Giacomo Pylarini tarafından İngiltere'deki Royal Society'ye Osmanlı İmparatorluğu'ndaki Türk inokülasyon yöntemine ilişkin iki rapor sunulmuştur.[73] Kaynaklarda Mary Wortley Montagu için; "Leydi Mary Osmanlı İmparatorluğu'ndayken, çiçek hastalığına karşı variolasyon adı verilen yerel inokülasyon uygulamasını keşfetti" denilmektedir.[74] 1718'de beş yaşındaki oğluna çiçek aşısı yaptırdı. Oğlu çabucak iyileşti. Londra'ya döndü ve 1721'de bir çiçek hastalığı salgını sırasında Charles Maitland'a kızını aşılattı. Bu durum Britanya kraliyet ailesinin ilgisini çekmiş ve Newgate Hapishanesindeki mahkumlar üzerinde bir variolasyon denemesi gerçekleştirilmiştir. Bu başarılı oldu ve 1722'de Galler Prensesi Ansbachlı Caroline, Maitland'ın çocuklarını aşılamasına izin verdi.[75] Bu çeşitlemelerin başarısı İngiliz halkına prosedürün güvenli olduğu konusunda güvence verdi.[73]
—Dr. Peter Kennedy
Şiddetli bir salgın tarafından teşvik edilen variolasyon, Kuzey Amerika'da ilk kez 1721 yılında uygulanmıştır. Bu uygulama Boston'da 1706'dan beri bilinmekteydi; vaiz Cotton Mather, köle olarak tuttuğu Onesimus'tan bu yöntemi öğrenmişti; Onesimus da birçok akranı gibi kaçırılmadan önce Afrika'da inoküle edilmişti.[77] Bu uygulama ilk başta çok eleştirildi.[78] Ancak yapılan sınırlı bir deneme, variole edilen 244 kişiden altısının öldüğünü (%2,5), 5980 kişiden 844'ünün ise doğal hastalıktan öldüğünü (%14) gösterdi ve bu işlem tüm kolonilerde yaygın olarak benimsendi.[16]
İnokülasyon tekniğinin binde bir ölüm oranına sahip olduğu belgelenmiştir. Kennedy'nin açıklamasından iki yıl sonra, Mart 1718'de Dr. Charles Maitland, İngiltere'nin Türk sarayındaki büyükelçisinin beş yaşındaki oğlunu, büyükelçinin eşi Mary Wortley Montagu'nun talimatıyla başarılı bir şekilde inoküle etti ve dört yıl sonra bu uygulamayı İngiltere'ye tanıttı.[79]
Mary Wortley Montagu'nun Sarah Chiswell'e yazdığı 1 Nisan 1717 tarihli Türk Büyükelçiliği mektubunda bu uygulama anlatılmaktadır:
Aramızda çok yaygın olan ve ölümcül olan çiçek hastalığı, burada aşılama yönteminin icadı sayesinde tamamen zararsız hale getirilmiştir. Bu operasyonu yapmayı kendilerine iş edinmiş bir grup yaşlı kadın var. Her sonbaharda, sıcakların azaldığı eylül ayında insanlar birbirlerine haber göndererek ailelerinde çiçek hastalığına yakalanan olup olmadığını sorarlar. Bu amaçla partiler düzenlerler ve bir araya geldiklerinde (genellikle on beş ya da on altı kişi bir araya gelir) yaşlı kadın elinde en iyi çiçek hastalığı maddesiyle dolu bir fındık kabuğuyla gelir ve hangi damarların açılmasını istediğini sorar. Kendisine sunduğunuz damarı hemen büyük bir iğneyle yırtar (ki bu size sıradan bir çizikten daha fazla acı vermez) ve iğnenin baş kısmına sulanabilecek kadar zehir koyar ve küçük yarayı içi boş bir kabuk parçasıyla bağladıktan sonra bu şekilde dört ya da beş damar açar. ... Çocuklar ya da genç hastalar günün geri kalanında birlikte oynarlar ve ayın sekizine kadar gayet sağlıklıdırlar. Sonra ateş onları ele geçirmeye başlar ve iki gün, nadiren de üç gün yataklarından çıkmazlar. Yüzlerinde çok nadiren yirmi ya da otuzun üzerinde ateş olur, bu da asla belirti vermez ve sekiz gün içinde hastalıktan önceki kadar iyi olurlar. ... Bu hastalıktan ölen hiç kimse yok ve sevgili küçük oğlum üzerinde denemeye niyetlendiğim için bu deneyin güvenliğinden çok emin olduğuma inanabilirsiniz. Bu yararlı buluşu İngiltere'de moda haline getirmek için çaba gösterecek kadar vatanseverim ve içlerinde insanlığın iyiliği için gelirlerinin bu kadar önemli bir bölümünü yok edecek kadar erdemli olduğunu düşündüğüm birini tanısaydım, doktorlarımızdan bazılarına bu konuda özellikle yazmaktan geri kalmazdım, ancak bu hastalık onlar için, buna bir son vermeyi üstlenecek cesur bir adamı tüm kızgınlıklarına maruz bırakmayacak kadar faydalıdır. Belki geri dönecek kadar yaşarsam onlarla savaşmaya cesaret edebilirim.[80]
Erken aşılama[değiştir | kaynağı değiştir]

Aşılamanın ilk deneysel günlerinde, Louis Pasteur'ün mikrop teorisini ortaya koymasından ve Joseph Lister'in antisepsi ve asepsi üzerine yaptığı çalışmalardan önce, önemli ölçüde çapraz enfeksiyon vardı. İlk aşıcılardan biri olan ve Londra Çiçek Hastanesinin yöneticiliğini yapan William Woodville'ın, aşı maddesi olan inek çiçeği maddesini çiçek hastalığı maddesiyle kontamine ettiği ve bunun da esasen variolasyona yol açtığı düşünülmektedir. Diğer aşı malzemeleri güvenilir bir şekilde sığır çiçeğinden değil, sığırların diğer deri döküntülerinden elde edilmiştir.[81]
Deneysel çalışmaların ilk günlerinde, 1758 yılında Amerikalı Kalvinist Jonathan Edwards çiçek aşısı nedeniyle ölmüştür. En eski istatistiksel ve epidemiyolojik çalışmalardan bazıları 1727'de James Jurin ve 1766'da Daniel Bernoulli tarafından gerçekleştirilmiştir.[82] 1768 yılında Dr. John Fewster, variolasyonun çiçek hastalığı geçirmiş kişilerde hiçbir reaksiyona neden olmadığını bildirmiştir.[83][84]

Edward Jenner İngiltere'nin Berkeley kentinde yetim olarak doğdu. Küçük bir çocukken Jenner, kilise fonları aracılığıyla diğer okul çocuklarıyla birlikte variolasyona tabi tutuldu, ancak enfeksiyonunun ciddiyeti nedeniyle neredeyse ölüyordu. Müshil ilaçlarla beslenen ve kan alma işleminden geçen Jenner, iyileşene kadar variolasyon ahırlarından birine konuldu.[85] 13 yaşındayken, yakınlardaki Sodbury'de eczacı Daniel Ludlow'un ve daha sonra cerrah George Hardwick'in yanına çırak olarak verildi. Sığırlarla çalışırken çiçek hastalığına yakalanan insanların daha sonra çiçek hastalığına yakalanmadıklarını gözlemledi. Jenner nedensel bir bağlantı olduğunu varsaydı ancak bu fikir o dönemde benimsenmedi. Jenner 1770'ten 1772'ye kadar Londra'da St Georges Hastanesi'nde ve John Hunter'ın özel öğrencisi olarak ileri eğitim aldı, ardından Berkeley'de muayenehane açmak için geri döndü.[86]
Belki de hastalıklara karşı direnç ve sığırlarla çalışma arasında bir bağlantı olduğuna dair gayriresmi bir kamu anlayışı zaten vardı. "Güzel sütçü kız" bu dönemin sanat ve edebiyatında sıkça rastlanan bir imge gibi görünmektedir. Ancak 1770'i takip eden yıllarda İngiltere ve Almanya'da en az altı kişinin (Sevel, Jensen, Jesty 1774, Rendall, Plett 1791) inek çiçeği aşısını insanlarda çiçek hastalığına karşı bağışıklık sağlamak için kullanma olasılığını başarıyla test ettiği kesin olarak bilinmektedir.[87]


Jenner Nisan 1797'de Royal Society'ye gözlemlerini bildiren bir makale gönderdi. Bildiri resmi olarak sunulmamıştı ve Cemiyet kayıtlarında bu bildiriden bahsedilmemektedir. Jenner makaleyi gayriresmi olarak Cemiyetin başkanı Sir Joseph Banks'e göndermiş, o da Everard Home'dan görüşlerini istemiştir. Jenner'ın reddedilen ve ilk kez 1999 yılında yayınlanan raporuna şüpheyle yaklaşıldı ve daha fazla aşı yapılması çağrısında bulunuldu.[88]
Ek aşılar yapıldı ve 1798'de Jenner, İngiltere'nin bazı batı ilçelerinde, özellikle de Gloucestershire'da keşfedilen ve inek çiçeği adıyla bilinen bir hastalık olan Variolae Vaccinae'nin Nedenleri ve Etkileri Üzerine Bir İnceleme başlıklı çalışmasını yayınladı.[67][89][90] Daha önce inek çiçeği geçirdikten sonra doğal maruziyete direnen birkaç kişiyi de içeren 23 vakanın analiziydi. Jenner'ın kaç kişiyi aşıladığı ya da çiçek virüsü ile aşıladığı bilinmemektedir; örneğin Vaka 21 'birkaç çocuk ve yetişkin' içermektedir. Jenner'ın kasıtlı olarak çiçek virüsü aşıladığı en az dört kişinin tamamı aşıya direnç göstermiştir. Bunlar arasında bir dizi koldan kola transferin ilk ve son hastaları da vardı.
Jenner, inek çiçeği aşılamasının çiçek aşılamasına güvenli bir alternatif olduğu sonucuna varmış, ancak koruyucu etkinin ömür boyu sürdüğünü düşüncesizce iddia etmiştir. Bu son iddianın yanlış olduğu kanıtlandı.[91] Jenner ayrıca istenen sonucu veren 'Gerçek' çiçek aşısı ile etkisiz olan ve/veya şiddetli reaksiyona neden olan 'Sahte' çiçek aşısını birbirinden ayırmaya çalışmıştır. Modern araştırmalar, Jenner'ın şimdi bulaşıcı olmayan aşı, farklı bir virüs (örneğin paravaccinia/milker düğümleri) veya kontamine bakteriyel patojenlerin neden olduğu etkileri ayırt etmeye çalıştığını göstermektedir. Bu durum o dönemde kafa karışıklığına yol açsa da aşı geliştirmede önemli bir kriter haline gelecektir.[92]
Bir başka kafa karışıklığı kaynağı da Jenner'ın ineklerden elde edilen tam etkili aşının, yanlışlıkla gres olarak adlandırdığı bir at hastalığından kaynaklandığına inanmasıydı. Bu durum o dönemde eleştirilmiş, ancak at çiçeğinden elde edilen aşılar kısa süre içinde kullanıma sunulmuş ve daha sonra günümüz aşılarındaki virüs olan vaccinia virüsünün kökenine ilişkin karmaşık soruna katkıda bulunmuştur.[93]:165–78
Aşının Yeni Dünya'ya tanıtılması, Jenner'ın çocukluk arkadaşı ve tıbbi meslektaşı Dr. John Clinch tarafından 1798 yılında Trinity, Newfoundland'da gerçekleşti.[94][95] Amerika Birleşik Devletleri'nde ilk çiçek aşısı 1799 yılında uygulandı. Doktor Valentine Seaman, Jenner'dan aldığı bir serumu kullanarak çocuklarına çiçek aşısı yaptı.[96][97] 1800 yılına gelindiğinde Jenner'ın çalışması tüm önemli Avrupa dillerinde yayınlanmış ve Amerika Birleşik Devletleri'nde Benjamin Waterhouse'a ulaşmıştı - bu da hızlı yayılmanın ve derin ilginin bir göstergesiydi.[98]:262–67 Aşılamanın güvenliğine ilişkin bazı endişelere rağmen, özenle seçilmiş aşı kullanıldığında ölüm oranı sıfıra yakındı ve kısa süre içinde tüm Avrupa ve Amerika Birleşik Devletleri'nde kullanılmaya başlandı.[99][100]
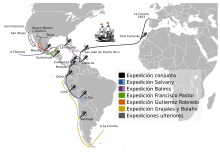
1804 yılında, Francisco Javier de Balmis'in komuta ettiği resmi bir İspanyol misyonu olan Balmis Keşif Gezisi, aşıyı İspanyol İmparatorluğu'na yaymak için önce Kanarya Adaları'na ve ardından İspanyol Orta Amerikası'na yelken açtı. Yardımcısı José Salvany, aşıyı İspanyol Güney Amerikası'nın batı ve doğu kıyılarına götürürken, Balmis Filipinler'deki Manila'ya ve Çin kıyısındaki Kanton ve Makao'ya yelken açtı. 1806'da İspanya'ya geri döndü.[101] Aşı şişeler halinde değil, canlı inek çiçeği virüsünün 'taşıyıcıları' olan 22 yetim erkek çocuk şeklinde taşındı. Varıştan sonra, "diğer İspanyol valiler ve doktorlar virüsü adalar arasında taşımak için köleleştirilmiş kızları kullandılar ve yerel nüfuslarını aşılamak için onlardan toplanan lenf sıvısını kullandılar".[102]
Napolyon çiçek aşısının ilk savunucularından biriydi ve orduya yeni katılanlara aşı yapılmasını emretti. Ayrıca Fransız Ordusu ve İmparatorluk Muhafızları için bir aşılama programı oluşturuldu. 1811 yılında oğlu II. Napolyon'a doğumundan sonra aşı yaptırdı. 1815 yılına gelindiğinde Fransız çocuklarının yaklaşık yarısı aşılanmıştı ve Napolyon İmparatorluğu'nun sonuna gelindiğinde çiçek hastalığı ölümleri - Fransız Devrimi sırasında ölümlerin %4,8'ini oluştururken - ölümlerin %1,8'ini oluşturuyordu.[103]
Zorunlu aşı uygulamasını başlatan ilk devlet 25 Eylül 1806 tarihinde Lucca ve Piombino Prensliği olmuştur.[104] 26 Ağustos 1807'de Bavyera da benzer bir önlem almıştır. Bunu 1809'da Baden, 1815'te Prusya, 1818'de Württemberg, 1816'da İsveç, 1867'de İngiltere ve 1874'te Reichs Aşı Yasası ile Alman İmparatorluğu izlemiştir.[105][106] Lutherci İsveç'te Protestan din adamları 1800 gibi erken bir tarihte gönüllü çiçek aşılamasında öncü bir rol oynamışlardır.[107] İlk aşılama 1801 yılında Lihtenştayn'da gerçekleştirilmiş ve 1812 yılından itibaren aşılama zorunlu hale getirilmiştir.[108]
İnek çiçeği inokülasyonunu/aşılamasını ilk kimin denediği sorusu kesin olarak cevaplanamamaktadır. Benjamin Jesty, Peter Plett ve John Fewster hakkında çok sayıda ama yine de sınırlı bilgi mevcuttur. 1774 yılında Dorset'teki Yetminster'da çiftçilik yapan Jesty, ailesiyle birlikte yaşayan iki sütannenin çiçek hastalığına karşı bağışıklığı olduğunu gözlemleyerek, çiçek hastalığından korunmak için ailesine inek çiçeği aşısı yapmıştır. O dönemde bir miktar yerel eleştiri ve alay konusu olmuş, ardından ilgi azalmıştır. Daha sonra dikkatler Jesty'nin üzerine çekildi ve 1802'de Jenner'ın Parlamentoya mali ödül için başvurduğu bir dönemde öne çıkmasını kıskanan eleştirmenler tarafından Londra'ya getirildi.[109]
1790-92 yılları arasında Holstein'lı bir öğretmen olan Peter Plett, Kiel Üniversitesi Tıp Fakültesine inek çiçeği inokülasyonunun sınırlı sonuçlarını rapor etti. Ancak Fakülte variolasyonu tercih etti ve herhangi bir işlem yapmadı.[110]
Jenner'ın Thornbury yakınlarından bir cerrah arkadaşı olan John Fewster, 1765 gibi erken bir tarihte toplantılarda inek çiçeği inokülayonu olasılığını tartışmıştır. Jenner'ın Phipps'i aşıladığı dönemde, 1796'da bazı inek çiçeği inokülayonları yapmış olabilir. Bununla birlikte, gelişen bir variolasyon uygulamasına sahip olan Fewster, bu seçeneği düşünmüş ancak bunun yerine çiçek hastalığını kullanmış olabilir. Fewster, aşılamanın variolasyona göre hiçbir avantajı olmadığını düşünüyordu, ancak Jenner ile dostane temasını sürdürdü ve eleştirmenler Jenner'ın itibarına saldırdığında kesinlikle aşılama için öncelik iddiasında bulunmadı.[111]
Aşılama için çiçek hastalığı yerine inek çiçeği kullanma fikrinin sadece tıp mesleği tarafından değil, 18. yüzyılın sonlarında da düşünüldüğü ve aslında denendiği açıktır. Dolayısıyla Jenner çiçek aşısını ilk deneyen kişi değildir. Ancak, kanıtlarını yayınlayan ve aşıyı serbestçe dağıtan, uygun materyalin seçimi konusunda bilgi veren ve koldan kola transfer yoluyla aşıyı sürdüren ilk kişiydi. Dünya Sağlık Örgütünün (DSÖ) Çiçek Hastalığı ve Eradikasyonu adlı resmi raporunun yazarları Jenner'ın rolünü değerlendirirken şunları yazmıştır.[16]:264
Soruşturmanın yayınlanması ve ardından Jenner'ın variola virüsü dışında bir virüsle aşılama fikrini enerjik bir şekilde yayması, çiçek hastalığının kontrolünde herkesten çok kendisinin övgüyü hak ettiği bir dönüm noktası oluşturmuştur.
Aşılama yaygınlaştıkça, bazı Avrupa ülkeleri bunu zorunlu hale getirdi. Aşının güvenliğine ilişkin endişeler, bazı durumlarda muhalefete ve ardından mevzuatın yürürlükten kaldırılmasına yol açtı.[111]:236–40[112] Zorunlu bebek aşılaması İngiltere'de 1853 Aşılama Yasası ile başlatılmıştır. 1871 yılına gelindiğinde, ebeveynler aşıya uymadıkları için para cezasına çarptırılabiliyor ve ödeme yapmadıkları takdirde hapse atılabiliyordu.[112]:202–13 Bu durum muhalefeti yoğunlaştırdı ve 1898 Aşı Yasası bir vicdan maddesi getirdi. Bu madde, iki sulh hakimi tarafından imzalanmış bir vicdani ret belgesi sunulması halinde muafiyete izin veriyordu. Bu tür sertifikalar her zaman kolaylıkla elde edilemiyordu ve 1907'de çıkarılan bir başka kanun, reddedilemeyecek bir yasal beyanla muafiyete izin verdi. Teorik olarak hala zorunlu olmasına rağmen, 1907 Yasası İngiltere'de zorunlu bebek aşılamasının fiilen sonunu getirmiştir.[112]:233–38

Amerika Birleşik Devletleri'nde aşılama tek tek eyaletler tarafından düzenlenmiş olup, zorunlu aşılamayı ilk uygulayan eyalet 1809 yılında Massachusetts olmuştur. Daha sonra çeşitli eyaletlerde zorlama, karşı çıkma ve yürürlükten kaldırma sıraları izlendi. 1930'a gelindiğinde Arizona, Utah, Kuzey Dakota ve Minnesota zorunlu aşılamayı yasaklamış, 35 eyalet yerel otoritelerin düzenlemesine izin vermiş ya da aşılamayı etkileyen herhangi bir mevzuatı bulunmazken, Washington, D.C. ve Massachusetts dahil olmak üzere on eyalette bebek aşılaması zorunlu hale getirilmiştir.[98]:292–93 Zorunlu bebek aşılaması, yalnızca aşılanmış olanların okula gitmesine izin verilerek düzenlenmiştir.[113] Zorunlu aşılamayı uygulamak isteyenler, kamu yararının kişisel özgürlüğün önüne geçtiğini savunmuştur. 1905 yılında Jacobson-Massachusetts davasında ABD Yüksek Mahkemesi tarafından desteklenen bu görüş, kişisel özgürlük ve kamu yararı ile ilgili davalar için emsal teşkil eden önemli bir karardır.[114]
Harvard Tıp Fakültesi (1915) mezunu bir Afro-Amerikan olan Louis T. Wright,[115] I. Dünya Savaşı sırasında orduda görev yaparken askerler için intradermal çiçek aşısını tanıttı.[116]
Üretimdeki gelişmeler[değiştir | kaynağı değiştir]
19. yüzyılın sonuna kadar aşılama ya doğrudan buzağı derisi üzerinde üretilen aşı ile ya da özellikle İngiltere'de buzağıdan elde edilen ancak daha sonra koldan kola transfer yoluyla muhafaza edilen aşı ile gerçekleştirilmiştir.[117] Başlangıçta her iki durumda da aşı kısa süreli saklama veya taşıma için fildişi uçlar üzerinde kurutulabilirken yüzyılın sonuna doğru bu amaçla cam kılcal tüplerin kullanımı artmıştır.[118] Bu dönemde aşının güvenliğini değerlendirmek için yeterli yöntemler yoktu ve kontamine aşının erizipel, tetanos, septisemi ve tüberküloz gibi enfeksiyonları bulaştırdığı vakalar vardı.[92] Koldan kola transfer durumunda frengi bulaşma riski de vardı. Bu durum zaman zaman meydana gelse de (100 milyon aşılamada 750 vaka olarak tahmin edilmektedir),[99]:122 Charles Creighton gibi bazı aşılama eleştirmenleri, kontamine olmamış aşının kendisinin frenginin bir nedeni olduğuna inanmaktaydı.[119] Çiçek aşısı bu dönemde mevcut olan tek aşıydı ve bu nedenle ona yönelik kararlı muhalefet, diğer aşılara ve 21. yüzyıla yayılan bir dizi aşı tartışmasını başlattı.[kaynak belirtilmeli]
Çiçek aşısıyla ilgilenen İngiliz Hükümeti bakteriyoloğu Sydney Arthur Monckton Copeman, gliserin de dahil olmak üzere çeşitli uygulamaların aşıdaki bakteriler üzerindeki etkilerini araştırdı. Gliserin bazen bazı kıtasal aşı üreticileri tarafından sadece seyreltici olarak kullanılıyordu. Ancak Copeman, %50 oranında kimyasal olarak saf gliserin içinde süspanse edilen ve kontrollü koşullar altında saklanan aşının çok az sayıda "yabancı" bakteri içerdiğini ve tatmin edici aşılar ürettiğini tespit etti.[120] Daha sonra gliserinin, aşıya "önemli miktarda" eklendiğinde erizipel ve tüberküloza neden olan organizmaları öldürdüğünü ve yönteminin kıtada yaygın olarak kullanıldığını bildirdi.[117] 1896'da Copeman'dan geleceğin VIII. Edward'ını aşılamak için "ekstra iyi buzağı aşısı" tedarik etmesi istendi.[121]
Copeman'ın yöntemiyle üretilen aşı, 1899'dan itibaren İngiliz Hükümeti Aşı Kuruluşu tarafından kamu aşıcılarına ücretsiz olarak verilen tek türdü. Aynı zamanda 1898 Aşı Yasası koldan kola aşılamayı yasaklamış, böylece frenginin bu aşıyla bulaşması engellenmiştir. Bununla birlikte, özel pratisyenler ticari üreticilerden aşı satın almak zorundaydı.[122]
Gliserinin doğru kullanımı bakteriyel kontaminasyonu önemli ölçüde azaltmış olsa da enfekte buzağıların derisinden kazınan ham başlangıç materyali her zaman yoğun şekilde kontamine olmuş ve hiçbir aşı tamamen bakterilerden arındırılamamıştır. 1900'de aşılar üzerinde yapılan bir araştırma, bakteriyel kontaminasyonda büyük farklılıklar olduğunu ortaya koymuştur. Devlet Aşı Kurumu tarafından üretilen aşılar gram başına 5.000 bakteri içerirken, ticari aşılar gram başına 100.000'e kadar bakteri içeriyordu.[123]
Bakteriyel kontaminasyon seviyesi, 1925 tarihli Terapötik Maddeler Yasası gram başına 5.000'lik bir üst sınır belirleyene ve erizipel veya yara enfeksiyonlarına neden olan organizmaları içerdiği tespit edilen herhangi bir aşı partisini reddedene kadar düzenlenmeden kaldı.[92] Ne yazık ki gliserollü aşı kısa süre içinde ortam sıcaklığında etkisini kaybederek tropikal iklimlerde kullanımını kısıtlamıştır. Bununla birlikte, tatmin edici bir soğuk zincirin mevcut olduğu 1970'lere kadar kullanımda kalmıştır.
Hayvanlar çiçek hastalığı eradikasyon kampanyası sırasında aşı üreticileri tarafından yaygın olarak kullanılmaya devam etmiştir. Bazıları birden fazla aşı kaynağı kullanan 59 üreticiyle yapılan bir DSÖ anketi, 39'unun buzağı, 12'sinin koyun ve 6'sının manda kullandığını, sadece 3'ünün hücre kültüründe ve 3'ünün embriyonlu tavuk yumurtasında aşı yaptığını ortaya koymuştur.[16]:543–45 Birinci Dünya Savaşı sırasında İngiliz aşısı zaman zaman koyunlarda üretilmiş, ancak 1946'dan itibaren sadece koyun kullanılmıştır.[118]
1940'ların sonu ve 1950'lerin başında, Lister Önleyici Tıp Enstitüsünde çalışan İngiliz mikrobiyolog Leslie Collier, toz halinde ısıya dayanıklı dondurularak kurutulmuş bir aşı üretmek için bir yöntem geliştirdi.[124][125] Collier, bakteriyel kontaminantların sayısını azaltmak için aşıya %0,5 fenol ekledi ancak kilit aşama, ampullere dağıtılmadan önce sıvı aşıya %5 pepton eklemekti. Bu, dondurarak kurutma işlemi sırasında virüsü korumuştur. Kurutma işleminden sonra ampuller nitrojen altında kapatıldı. Diğer aşılar gibi, sulandırıldıktan sonra ortam sıcaklığında 1-2 gün sonra etkisiz hale geldi. Ancak kurutulmuş aşı 37 °C'de (99 °F) 6 ay saklandıktan sonra sulandırıldığında %100 etkili oluyordu ve bu da uzak tropik bölgelere taşınmasına ve buralarda saklanmasına olanak tanıyordu. Collier'in yöntemi giderek daha fazla kullanıldı ve küçük değişikliklerle, 1967'de küresel çiçek hastalığı eradikasyon kampanyasını başlattığında DSÖ Çiçek Hastalığı Eradikasyon Birimi tarafından benimsenen aşı üretimi standardı haline geldi; o sırada 59 üreticiden 23'ü Lister suşunu kullanıyordu.[16]:545, 550
Çiçek aşısı tarihindeki dönüm noktalarıyla ilgili olarak Derrick Baxby tarafından yazılan ve alıntılanan bir mektupta, 1967'den 1977'ye kadar Çiçek Eradikasyon Biriminin şefi olan Donald Henderson şunları yazmıştır: "Copeman ve Collier, bana göre hiçbir zaman hak ettikleri değeri görmedikleri muazzam bir katkıda bulunmuşlardır".[126]
Çiçek aşısı derinin yüzeysel katmanlarına çizikler atılarak aşılanırdı ve bunu başarmak için çok çeşitli aletler kullanılırdı. Bunlar basit iğnelerden, bu amaç için özel olarak tasarlanmış çok uçlu ve çok kanatlı yaylı aletlere kadar uzanıyordu.[127]
Çiçek aşısına en büyük katkı 1960'larda Wyeth Laboratuvarları için çalışan Amerikalı mikrobiyolog Benjamin Rubin tarafından yapılmıştır. Rubin, gözleri enine yarıya kadar kesilmiş tekstil iğneleriyle yaptığı ilk testlere dayanarak çatallı iğneyi geliştirdi. Bu, bir doz sulandırılmış dondurularak kurutulmuş aşıyı kılcallık yoluyla tutmak için tasarlanmış keskinleştirilmiş iki uçlu bir çataldı.[128] Minimum eğitimle kullanımı kolay, üretimi ucuz (1000'de 5 dolar), diğer yöntemlerin dörtte biri kadar aşı kullanan ve alevle sterilizasyondan sonra tekrar tekrar kullanılabilen bu iğne, 1968'den itibaren DSÖ Çiçek Hastalığını Yok Etme Kampanyası'nda dünya çapında kullanıldı.[16]:472–73, 568–72 Rubin, kampanyanın son yıllarında yılda 200 milyon aşılama yapıldığını tahmin ediyor.[128] Kampanyayla yakından ilgilenenlere "Çatallı İğne Nişanı" verildi. Donald Henderson'ın kişisel bir girişimi olan bu nişan, kızı tarafından tasarlanıp yapılan ve "O" şeklini alan iğneden oluşan bir yaka rozetiydi. Bu, kampanyanın amacı olan "Hedef Sıfır "ı temsil ediyordu.[129]
Çiçek hastalığının ortadan kaldırılması[değiştir | kaynağı değiştir]

Çiçek hastalığı, 1967'de başlayan bir aşılama programıyla desteklenen büyük bir uluslararası salgın araştırmasıyla ortadan kaldırılmıştır. Bu program, Donald Henderson tarafından kurulan ve yönetilen bir Dünya Sağlık Örgütü (DSÖ) birimi tarafından organize ve koordine edilmiştir. Amerika kıtasındaki son vaka 1971'de (Brezilya), Güneydoğu Asya'da (Endonezya) 1972'de ve Hindistan alt kıtasında 1975'te (Bangladeş) meydana geldi. İki yıl süren yoğun araştırmalardan sonra, dünyanın herhangi bir yerindeki son endemik vaka olduğu kanıtlanan vaka Ekim 1977'de Somali'de meydana geldi.[16]:526–37
Frank Fenner başkanlığındaki Çiçek Eradikasyonunun Sertifikasyonu için Küresel Komisyon, çiçek hastalığının endemik olduğu tüm ülkelerden gelen kanıtları inceledi ve gerektiğinde bu ülkeleri ziyaret etti. Aralık 1979'da çiçek hastalığının ortadan kaldırıldığı sonucuna varıldı; bu sonuç Mayıs 1980'de DSÖ Genel Kurulu tarafından da onaylandı[16]:1261–62 Ancak, hastalık ortadan kaldırılırken bile birçok laboratuvarda çiçek virüsü stokları kalmaya devam ediyordu.
1978'de Birmingham Üniversitesi Tıp Fakültesindeki bir laboratuvarda kazara meydana gelen ve açıklanamayan bir muhafaza ihlali nedeniyle ortaya çıkan biri ölümcül (Janet Parker) iki çiçek hastalığı vakasıyla hızlanan DSÖ, bilinen çiçek hastalığı virüsü stoklarının ya imha edilmesini ya da daha güvenli laboratuvarlara taşınmasını sağlamıştır.
1979 yılına gelindiğinde sadece dört laboratuvarda çiçek virüsü olduğu biliniyordu. Londra'daki St Mary's Hastanesinde tutulan tüm İngiliz stokları Porton Down'daki daha güvenli tesislere ve ardından 1982'de Atlanta, Georgia'daki Hastalık Kontrol ve Korunma Merkezlerine (CDC) transfer edildi ve 1983'te tüm Güney Afrika stokları imha edildi.
1984 yılına gelindiğinde, bilinen tek stoklar ABD'deki CDC'de ve Rusya'nın Koltsovo kentindeki Viroloji ve Biyoteknoloji Devlet Araştırma Merkezinde (VECTOR) tutuluyordu.[16]:1273–76 Bu devletler, depolarının gelecekte doğal çiçek hastalığının belirsiz bir rezervuarının keşfedilmesi halinde olası biyolojik silahlanma karşıtı araştırmalar ve sigorta için olduğunu bildirmektedir.[130]
Terörle mücadele hazırlığı[değiştir | kaynağı değiştir]
Aralık 2002 ve Mart 2003 tarihleri arasında çiçek aşısı ile aşılanan 270.000'den fazla ABD askeri hizmet mensubu arasında, gözlemlendikleri 30 gün boyunca 100.000'de 7,8'lik bir insidansla on sekiz olası miyoperikardit vakası bildirilmiştir (hepsi NYCBOH aşı virüsü suşu alan ilk kez aşılanan kişilerde). Tüm vakalar genç, sağlıklı yetişkin beyaz erkeklerde görülmüş ve hepsi hayatta kalmıştır.[131]
2002 yılında Birleşik Devletler hükümeti ülke çapında 500.000 gönüllü sağlık çalışanını aşılamak için bir program başlattı. Aşılanacak kişiler, bir biyoterörist saldırı durumunda ilk müdahaleyi yapacak olan sağlık çalışanlarıydı. Birçok sağlık çalışanı aşının yan etkileri, tazminat ve sorumluluk konusunda endişelenerek aşı olmayı reddetti ya da aşı yaptırmadı. Çoğu, aşı için acil bir ihtiyaç görmemiştir. Bazı sağlık sistemleri, bir salgın durumunda çiçek hastaları için bir hedef haline gelmekten endişe ederek katılmayı reddetti.[132] Gerçekte 40.000'den az kişiye aşı yapıldı.[133]
21 Nisan 2022 tarihinde Kanada Kamu Hizmetleri ve Tedarik Kurumu, eradike edilen virüsün kazara veya kasıtlı olarak salınması ihtimaline karşı koruma sağlamak amacıyla 500.000 doz çiçek aşısı stoklamak üzere bir ihale ilanı yayınlamıştır.[134] 6 Mayıs'ta Imvamune aşısı için Bavarian Nordic ile sözleşme imzalandı.[135] Bu aşılar Kanada Halk Sağlığı Ajansı tarafından 2022'deki maymun çiçeği salgınına karşı hedefe yönelik aşılama için kullanıldı.[136]
Köken[değiştir | kaynağı değiştir]
Modern çiçek aşısının kökeni uzun zamandır belirsizdi,[137] ancak 2010'larda at çiçeği en olası ata olarak tanımlandı.[138]:9 Edward Jenner aşısını bir inekten elde etmişti, bu nedenle virüse Latince inek anlamına gelen vaccinia adını verdi. Jenner hem sığır çiçeği hem de çiçek hastalığının attan kaynaklanan ve ineğe geçen virüsler olduğuna inanıyordu[139]:52–53 ve bazı doktorlar hastalarını doğrudan at çiçeği ile aşılayarak onun mantığını izledi.[140] Louis Pasteur 19. yüzyılın sonlarında laboratuvarda aşı üretmeye yönelik teknikler geliştirdiğinde durum daha da bulanıklaştı. Tıp araştırmacıları virüsleri seri geçişlere tabi tuttukça, yetersiz kayıt tutma, kökenleri belirsiz laboratuvar türlerinin ortaya çıkmasına neden oldu.[93]:4 19. yüzyılın sonlarına gelindiğinde, aşının inek çiçeği mi, at çiçeği mi yoksa zayıflatılmış bir çiçek hastalığı türünden mi kaynaklandığı bilinmiyordu.[141]
1939 yılında Allan Watt Downie, vaccinia virüsünün serolojik olarak "spontane" inek çiçeği virüsünden farklı olduğunu gösterdi.[12] Bu çalışma, vaccinia ve inek çiçeğini iki ayrı viral tür olarak ortaya koydu. Vaccinia terimi artık sadece çiçek aşısını ifade ederken,[142] inek çiçeği artık Latince bir isme sahip değildir.[143] 1990'larda tüm genom dizilemesinin geliştirilmesi, ortopoksvirüs genomlarını karşılaştırmayı ve birbirleriyle olan ilişkilerini tanımlamayı mümkün kılmıştır. At çiçeği virüsü 2006 yılında dizilenmiş ve vaccinia ile en yakın akraba olduğu bulunmuştur.[144] Ortopoksvirüslerin filogenetik ağacında at çiçeği, vaccinia suşları ile bir klad oluştururken inek çiçeği suşları farklı bir klad oluşturmaktadır.[13]
At çiçeğinin vahşi doğada nesli tükenmiştir ve bilinen tek örnek 1976 yılında toplanmıştır.[145] Örnek çiçek hastalığını yok etme kampanyasının sonunda toplandığı için, bilim insanları at çiçeğinin vahşi doğaya kaçmış bir vaccinia türü olma ihtimalini düşünmüşlerdir.[146] Bununla birlikte, daha fazla çiçek aşısı dizilendikçe, eski aşıların at çiçeği ile modern vaccinia suşlarından daha benzer olduğu bulundu. Mulford tarafından 1902 yılında üretilen bir çiçek aşısı, at çiçeğine %99,7 oranında benzemektedir ve daha önce bilinen tüm vaccinia türlerinden daha yakındır.[147] Fransa'da 1866 yılında meydana gelen bir "inek çiçeği" salgınında toplanan materyalden yapılan ve 1887 yılında piyasaya sürüldüğü belgelenen modern Brezilya aşıları, diğer vaccinia türlerine kıyasla at çiçeğine daha çok benzemektedir.[148] Amerika Birleşik Devletleri'nde 1859-1873 yıllarında üretilen beş çiçek aşısı, 1902 Mulford aşısının yanı sıra birbirlerine[146] ve at çiçeğine en çok benzeyen aşılardır.[149] 1859-1873 aşılarından biri, vaccinia'da delesyonlara sahip 1976 at çiçeği örneğinden tam bir gen içeren yeni bir at çiçeği türü olarak tanımlanmıştır.[149]
Kaynakça[değiştir | kaynağı değiştir]
- ^ "ACAM2000 smallpox vaccine (live vaccinia virus) vial with diluent". Therapeutic Goods Administration (TGA). 18 Nisan 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2022.
- ^ "Imvamune Product information". Health Canada. 25 Nisan 2012. 22 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2022.
- ^ "Smallpox vaccine Product information". Health Canada. 25 Nisan 2012. 8 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2022.
- ^ "Smallpox vaccine Product information". Health Canada. 25 Nisan 2012. 8 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2022.
- ^ "Jynneos Smallpox and Monkeypox Vaccine" (PDF). 3 Eylül 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 2 Eylül 2023.
- ^ "ACAM2000 (smallpox- vaccinia vaccine, live injection, powder, lyophilized, for solution)". DailyMed. 21 Mart 2018. 24 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2022.
- ^ "Jynneos- vaccinia virus modified strain ankara-bavarian nordic non-replicating antigen injection, suspension". DailyMed. 14 Şubat 2022. 27 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2022.
- ^ a b "Imvanex EPAR". European Medicines Agency (EMA). 27 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2014.
- ^ Metzger W, Mordmueller BG (July 2007). Metzger W (Ed.). "Vaccines for preventing smallpox". The Cochrane Database of Systematic Reviews. 2007 (3): CD004913. doi:10.1002/14651858.CD004913.pub2. PMC 6532594 $2. PMID 17636779.
- ^ Anderson MG, Frenkel LD, Homann S, and Guffey J. (2003), "A case of severe monkeypox virus disease in an American child: emerging infections and changing professional values"; Pediatr Infect Dis J;22(12): 1093–96; discussion 1096–98.
- ^ Baxby D (1981). Jenner's Smallpox Vaccine: The Riddle of Vaccinia Virus and Its Origin. Heinemann Educational Books. ISBN 978-0-435-54057-9.
- ^ a b Downie AW (April 1939). "The Immunological Relationship of the Virus of Spontaneous Cowpox to Vaccinia Virus". British Journal of Experimental Pathology. 20 (2): 158-76. ISSN 0007-1021. PMC 2065307 $2.
- ^ a b Carroll DS, Emerson GL, Li Y, Sammons S, Olson V, Frace M, Nakazawa Y, Czerny CP, Tryland M, Kolodziejek J, Nowotny N, Olsen-Rasmussen M, Khristova M, Govil D, Karem K, Damon IK, Meyer H (August 2011). "Chasing Jenner's vaccine: revisiting cowpox virus classification". PLOS ONE. 6 (8): e23086. Bibcode:2011PLoSO...623086C. doi:10.1371/journal.pone.0023086. PMC 3152555 $2. PMID 21858000.
- ^ a b c d e f g h Operational framework for the deployment of the World Health Organization Smallpox Vaccine Emergency Stockpile in response to a smallpox event. World Health Organization (WHO). 2017. ISBN 978-92-4-151341-8.
- ^ Belongia EA, Naleway AL (April 2003). "Smallpox vaccine: the good, the bad, and the ugly". Clinical Medicine & Research. 1 (2): 87-92. doi:10.3121/cmr.1.2.87. PMC 1069029 $2. PMID 15931293.
- ^ a b c d e f g h i j k l m n o p Fenner F, Henderson DA, Arita I, Jezek Z, Ladnyi ID (1988). Smallpox and Its Eradication (PDF). History of International Public Health. Cenevre: World Health Organization (WHO). ISBN 978-92-4-156110-5. 25 Mayıs 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 5 Kasım 2013.
- ^ "Instructions for smallpox vaccination with bifurcated needle". World Health Organization (WHO). 1968. 16 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Temmuz 2022.
- ^ "Six bifurcated needles for smallpox vaccination | Science Museum Group Collection". Science Museum (London). 20 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Temmuz 2022.
The skin was not disinfected before use as this killed the vaccine.
- ^ a b c Cono J, Casey CG, Bell DM (February 2003). "Smallpox vaccination and adverse reactions. Guidance for clinicians" (PDF). MMWR. Recommendations and Reports. 52 (RR-4): 1-28. PMID 12617510. 22 Mart 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 11 Ağustos 2022.
- ^ Cassimatis DC, Atwood JE, Engler RM, Linz PE, Grabenstein JD, Vernalis MN (May 2004). "Smallpox vaccination and myopericarditis: a clinical review". Journal of the American College of Cardiology. 43 (9): 1503-1510. doi:10.1016/j.jacc.2003.11.053. PMID 15120802.
- ^ Kretzschmar M, Wallinga J, Teunis P, Xing S, Mikolajczyk R (August 2006). "Frequency of adverse events after vaccination with different vaccinia strains". PLOS Medicine. 3 (8): e272. doi:10.1371/journal.pmed.0030272. PMC 1551910 $2. PMID 16933957.
- ^ Kretzschmar M, Wallinga J, Teunis P, Xing S, Mikolajczyk R (3 Ekim 2006). "Correction: Frequency of Adverse Events after Vaccination with Different Vaccinia Strains". PLOS Medicine. 3 (10): e429. doi:10.1371/journal.pmed.0030429. PMC 1626554 $2.
- ^ Goodpasture EW, Woodruff AM, Buddingh GJ (May 1932). "Vaccinal Infection of the Chorio-Allantoic Membrane of the Chick Embryo". The American Journal of Pathology. 8 (3): 271-282.7. PMC 2062681 $2. PMID 19970016.
- ^ Council on Drugs (American Medical Association) (1964). New and Nonofficial Drugs. Lippincott. s. 739.
- ^ Wiser I, Balicer RD, Cohen D (January 2007). "An update on smallpox vaccine candidates and their role in bioterrorism related vaccination strategies". Vaccine. 25 (6): 976-984. doi:10.1016/j.vaccine.2006.09.046. PMID 17074424.
- ^ Ferrier-Rembert A, Drillien R, Meignier B, Garin D, Crance JM (November 2007). "Safety, immunogenicity and protective efficacy in mice of a new cell-cultured Lister smallpox vaccine candidate". Vaccine. 25 (49): 8290-8297. doi:10.1016/j.vaccine.2007.09.050. PMID 17964011.
- ^ Monath TP, Caldwell JR, Mundt W, Fusco J, Johnson CS, Buller M, Liu J, Gardner B, Downing G, Blum PS, Kemp T, Nichols R, Weltzin R (October 2004). "ACAM2000 clonal Vero cell culture vaccinia virus (New York City Board of Health strain)--a second-generation smallpox vaccine for biological defense". International Journal of Infectious Diseases. 8 (Suppl 2): S31-S44. doi:10.1016/j.ijid.2004.09.002. PMC 7110559 $2. PMID 15491873.
- ^ Nalca A, Zumbrun EE (May 2010). "ACAM2000: the new smallpox vaccine for United States Strategic National Stockpile". Drug Design, Development and Therapy. 4: 71-79. doi:10.2147/dddt.s3687. PMC 2880337 $2. PMID 20531961.
- ^ Volz A, Sutter G (2017). "Modified Vaccinia Virus Ankara: History, Value in Basic Research, and Current Perspectives for Vaccine Development". Advances in Virus Research. 97: 187-243. doi:10.1016/bs.aivir.2016.07.001. ISBN 9780128118016. PMC 7112317 $2. PMID 28057259.
- ^ Mayr A, Hochstein-Mintzel V, Stickl H (March 1975). "Abstammung, Eigenschaften und Verwendung des attenuierten Vaccinia-Stammes MVA". Infection. 3 (1): 6-14. doi:10.1007/BF01641272.
- ^ a b c Kenner J, Cameron F, Empig C, Jobes DV, Gurwith M (November 2006). "LC16m8: an attenuated smallpox vaccine". Vaccine. 24 (47–48): 7009-7022. doi:10.1016/j.vaccine.2006.03.087. PMC 7115618 $2. PMID 17052815.
- ^ Cohen J (1 Temmuz 2022). "There's a shortage of monkeypox vaccine. Could one dose instead of two suffice?". AAAS. 8 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Temmuz 2022.
Because MVA does not make copies of itself, the team gave it at a higher dose—similar to what's used in the Bavarian Nordic shot today—than the Dryvax vaccine.
- ^ Earl PL, Americo JL, Wyatt LS, Espenshade O, Bassler J, Gong K, Lin S, Peters E, Rhodes L, Spano YE, Silvera PM, Moss B (August 2008). "Rapid protection in a monkeypox model by a single injection of a replication-deficient vaccinia virus". Proceedings of the National Academy of Sciences of the United States of America. 105 (31): 10889-10894. Bibcode:2008PNAS..10510889E. doi:10.1073/pnas.0804985105. PMC 2495015 $2. PMID 18678911.
- ^ "Smallpox Vaccine Supply & Strength". National Institute of Allergy and Infectious Diseases (NIAID). 26 Eylül 2019. 17 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Ekim 2019.
- ^ Greenberg RN, Hay CM, Stapleton JT, Marbury TC, Wagner E, Kreitmeir E, Röesch S, von Krempelhuber A, Young P, Nichols R, Meyer TP, Schmidt D, Weigl J, Virgin G, Arndtz-Wiedemann N, Chaplin P (2016). "A Randomized, Double-Blind, Placebo-Controlled Phase II Trial Investigating the Safety and Immunogenicity of Modified Vaccinia Ankara Smallpox Vaccine (MVA-BN®) in 56-80-Year-Old Subjects". PLOS ONE. 11 (6): e0157335. Bibcode:2016PLoSO..1157335G. doi:10.1371/journal.pone.0157335. PMC 4915701 $2. PMID 27327616.
- ^ "Summary Basis for Regulatory Action Template". FDA. U.S. Food & Drug Administration. 8 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ekim 2021.
- ^ "Vaccine "Take" Evaluation". CDC. U.S. Centers for Disease Control and Prevention. 26 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ocak 2022.
- ^ CDC (13 Ekim 2022). "Monkeypox in the U.S." Centers for Disease Control and Prevention (İngilizce). 19 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ekim 2022.
- ^ "Smallpox and monkeypox vaccine: Canadian Immunization Guide". Public Health Agency of Canada. 16 Haziran 2022. 20 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2022.
- ^ "Register of Innovative Drugs" (PDF). Health Canada. June 2020. 26 Haziran 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 24 Haziran 2020.
- ^ "Products for Human Use. Submission #144762". Register of Innovative Drugs. Health Canada. 17 Haziran 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Ekim 2014.
- ^ "Jynneos". U.S. Food and Drug Administration (FDA). 24 Eylül 2019. STN 125678. 17 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Ekim 2019.
- ^ "FDA approves first live, non-replicating vaccine to prevent smallpox and monkeypox". U.S. Food and Drug Administration (FDA) (Basın açıklaması). 24 Eylül 2019. 17 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Ekim 2019.
- ^ "Infectious Diseases: Clinical Trials". Bavarian Nordic. 26 Nisan 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Ekim 2014.
- ^ "Phase II Trial to Assess Safety and Immunogenicity of Imvamune". ClinicalTrials.gov. Ulusal Sağlık Enstitüleri. 13 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Ekim 2014.
- ^ Pittman PR, Hahn M, Lee HS, Koca C, Samy N, Schmidt D, Hornung J, Weidenthaler H, Heery CR, Meyer TP, Silbernagl G, Maclennan J, Chaplin P (November 2019). "Phase 3 Efficacy Trial of Modified Vaccinia Ankara as a Vaccine against Smallpox". The New England Journal of Medicine. 381 (20): 1897-1908. doi:10.1056/NEJMoa1817307. PMID 31722150.
- ^ "Jynneos Vaccine Effectiveness". Centers for Disease Control and Prevention. 19 Mayıs 2023. 24 Mayıs 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Mayıs 2023.
- ^ "Considerations on posology for the use of the vaccine Jynneos/ Imvanex (MVA-BN) against monkeypox" (PDF). European Medicines Agency. 19 Ağustos 2022. 28 Mayıs 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 28 Mayıs 2023.
- ^ "Protecting you from mpox (monkeypox): information on the smallpox vaccination". GOV.UK (İngilizce). 28 Mayıs 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2023.
- ^ Rotz LD, Dotson DA, Damon IK, Becher JA (June 2001). "Vaccinia (smallpox) vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2001" (PDF). MMWR. Recommendations and Reports. 50 (RR-10): 1-25; quiz CE1-7. PMID 15580803. 13 Ekim 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 13 Haziran 2022.
- ^ "Prevention and Treatment". U.S. Centers for Disease Control and Prevention (CDC). 18 Ekim 2021. 15 Aralık 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Ağustos 2022.
- ^ "Vaccines and Related Biological Products Advisory Committee Meeting". U.S. Food and Drug Administration (FDA). 17 Mayıs 2007. 20 Ekim 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Mayıs 2013.
- ^ a b c d Kneip A (26 Ocak 2003). "Pocken-Fieber". Der Spiegel (Almanca). 4 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2022.
- ^ Lueck S (1 Nisan 2002). "Aventis to Donate Smallpox Vaccine To the U.S. Government's Stockpile". The Wall Street Journal. 12 Ocak 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2022.
- ^ Emergent BioSolutions (3 Eylül 2019). "Emergent BioSolutions Awarded 10-Year HHS Contract to Deliver ACAM2000®, (Smallpox (Vaccinia) Vaccine, Live) Into the Strategic" (Basın açıklaması). 8 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2022.
- ^ Bavarian Nordic. "Bavarian Nordic Announces U.S. FDA Approval of Jynneos (Smallpox and Monkeypox Vaccine, Live, Non-Replicating) for Prevention of Smallpox and Monkeypox Disease in Adults" (Basın açıklaması). 28 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2022.
- ^ a b c U.S. Department of Health and Human Services (1 Temmuz 2022). "HHS Orders 2.5 Million More Doses of JYNNEOS Vaccine For Monkeypox Preparedness" (Basın açıklaması). 4 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2022.
- ^ Petersen BW, Damon IK, Pertowski CA, Meaney-Delman D, Guarnizo JT, Beigi RH, Edwards KM, Fisher MC, Frey SE, Lynfield R, Willoughby RE (February 2015). "Clinical guidance for smallpox vaccine use in a postevent vaccination program" (PDF). MMWR. Recommendations and Reports. 64 (RR-2): 1-26. PMID 25695372. 19 Ocak 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 11 Ağustos 2022.
- ^ a b c Talbot TR, Stapleton JT, Brady RC, Winokur PL, Bernstein DI, Germanson T, Yoder SM, Rock MT, Crowe JE, Edwards KM (September 2004). "Vaccination success rate and reaction profile with diluted and undiluted smallpox vaccine: a randomized controlled trial". JAMA. 292 (10): 1205-12. doi:10.1001/jama.292.10.1205. PMID 15353533.
- ^ Costa A (5-7 Kasım 2013). "Smallpox vaccine stockpile" (PDF). World Health Organization (WHO). 4 Temmuz 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 4 Temmuz 2022.
- ^ "Smallpox eradication: destruction of variola virus stocks" (PDF). 4 Nisan 2019. 16 Mayıs 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 4 Temmuz 2022.
- ^ "Plan national de réponse à une menace de variole" (PDF). Ministère de la Santé et des Solidarités (France). August 2006. 19 Mayıs 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 4 Temmuz 2022.
- ^ "Vaiolo delle scimmie, 'abbiamo 5 milioni dosi di vaccino: pronti se servirà'" (İtalyanca). adnkronos. 27 Mayıs 2022. 14 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Temmuz 2022.
- ^ Jihyun Kim (23 Mayıs 2022). "15개국 퍼진 원숭이 두창, 불안 확산…백신·치료제는?". Newsis. Seul. 23 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mayıs 2022.
- ^ Oh MD, Lee JK (July 2012). "Milestones in history of adult vaccination in Korea". Clinical and Experimental Vaccine Research. 1 (1): 9-17. doi:10.7774/cevr.2012.1.1.9. PMC 3623517 $2. PMID 23596574.
- ^ Ryan KJ, Ray CG, (Ed.) (2004). Sherris Medical Microbiology (4. bas.). McGraw Hill. ss. 525-28. ISBN 978-0-8385-8529-0.
- ^ a b c Riedel S (January 2005). "Edward Jenner and the history of smallpox and vaccination". Proceedings. 18 (1): 21-25. doi:10.1080/08998280.2005.11928028. PMC 1200696 $2. PMID 16200144.
- ^ Van Alphen J, Aris A (1995). "Medicine in India". Oriental Medicine: An Illustrated Guide to the Asian Arts of Healing. Londra: Serindia Publications. ss. 19-38. ISBN 978-0-906026-36-6.
- ^ Needham J (1999). "Part 6, Medicine". Science and Civilization in China: Volume 6, Biology and Biological Technology. Cambridge: Cambridge University Press. s. 134.
- ^ Temple R (1986). The Genius of China: 3,000 Years of Science, Discovery, and Invention. New York: Simon and Schuster. s. 137. ISBN 978-0-671-62028-8.
- ^ Silverstein AM (2009). A History of Immunology (2. bas.). Academic Press. s. 293. ISBN 9780080919461. 3 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Temmuz 2017.
- ^ Voltaire (1742). "Letter XI". Letters on the English. 16 Ekim 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Temmuz 2017.
- ^ a b Behbehani AM (December 1983). "The smallpox story: life and death of an old disease". Microbiological Reviews. 47 (4): 455-509. doi:10.1128/MMBR.47.4.455-509.1983. PMC 281588 $2. PMID 6319980.
- ^ Aboul-Enein BH, Ross MW, Aboul-Enein FH (2012). "Smallpox inoculation and the Ottoman contribution: A Brief Historiography" (PDF). Texas Public Health Journal. 64 (1): 12. 11 Ekim 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 23 Aralık 2018.
- ^ Livingstone, N. 2015.
- ^ Kennedy P (1715). An Essay on External Remedies Wherein it is Considered, Whether all the curable Distempers incident to Human Bodies, may not be cured by Outward Means. Londra: A. Bell.
- ^ Willoughby B (12 Şubat 2004). "Black History Month II: Why Wasn't I Taught That?". Tolerance in the News. 14 Ocak 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2008.
- ^ "Open Collections Program: Contagion, The Boston Smallpox Epidemic, 1721". 26 Temmuz 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2008.
- ^ Robertson P (1974). The book of firsts. New York: C. N. Potter : distributed by Crown Publishers. ISBN 978-0-517-51577-8.
- ^ "Montagu, Turkish Embassy Letters". 15 Nisan 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2008.
- ^ "Statue of Dr Edward Jenner near the Italian Fountains, Kensington Gardens". lachlan.bluehaze.com.au. 28 Mart 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Ekim 2019.
- ^ Blower S, Bernoulli D (2004). "An attempt at a new analysis of the mortality caused by smallpox and of the advantages of inoculation to prevent it. 1766" (PDF). Reviews in Medical Virology. 14 (5): 275-288. doi:10.1002/rmv.443. PMID 15334536. 27 Eylül 2007 tarihinde kaynağından (PDF) arşivlendi.
- ^ Pearson G, (Ed.) (1798). An inquiry concerning the history of the cowpox, principally with a view to supersede and extinguish the smallpox. London, England: J. Johnson. ss. 102-104. 25 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Aralık 2015.
- ^ Thurston L, Williams G (2015). "An examination of John Fewster's role in the discovery of smallpox vaccination". The Journal of the Royal College of Physicians of Edinburgh. 45 (2): 173-179. doi:10.4997/JRCPE.2015.217. PMID 26181536.
- ^ Michael J. Bennett, War against Smallpox: Edward Jenner and the Global Spread of Vaccination (Cambridge, United Kingdom: Cambridge University Press, 2020), 32.
- ^ Bailey I (May 1996). "Edward Jenner (1749–1823): naturalist, scientist, country doctor, benefactor to mankind". Journal of Medical Biography. 4 (2): 63-70. doi:10.1177/096777209600400201. PMID 11616266.
- ^ Hammarsten JF, Tattersall W, Hammarsten JE (1979). "Who discovered smallpox vaccination? Edward Jenner or Benjamin Jesty?". Transactions of the American Clinical and Climatological Association. 90: 44-55. PMC 2279376 $2. PMID 390826.
- ^ Baxby D (January 1999). "Edward Jenner's unpublished cowpox inquiry and the Royal Society: Everard Home's report to Sir Joseph Banks". Medical History. 43 (1): 108-110. doi:10.1017/S0025727300064747. PMC 1044113 $2. PMID 10885136.
- ^ Winkelstein W (1992). "Not just a country doctor: Edward Jenner, scientist". Epidemiologic Reviews. 14: 1-15. doi:10.1093/oxfordjournals.epirev.a036081. PMID 1289108.
- ^ Willis NJ (August 1997). "Edward Jenner and the eradication of smallpox". Scottish Medical Journal. 42 (4): 118-121. doi:10.1177/003693309704200407. PMID 9507590.
- ^ Baxby D (January 1999). "Edward Jenner's Inquiry; a bicentenary analysis". Vaccine. 17 (4): 301-307. doi:10.1016/S0264-410X(98)00207-2. PMID 9987167.
- ^ a b c Baxby D (2001). Smallpox Vaccine, Ahead of Its Time – How the Late Development of Laboratory Methods and Other Vaccines Affected the Acceptance of Smallpox Vaccine. Berkeley, UK: Jenner Museum. ss. 12-16. ISBN 978-0-9528695-1-1.
- ^ a b Baxby D (1981). Jenner's smallpox vaccine; the riddle of vaccinia virus and its origin. Londra: Heinemann Educational Books. ISBN 0-435-54057-2.
- ^ Piercey T (August 2002). "Plaque in Memory of Rev. John Clinch". 20 Mart 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2014.
- ^ Handcock G (1996). The Story of Trinity. Trinity: The Trinity Historical Society. s. 1. ISBN 978-098100170-8.
- ^ "First X, Then Y, Now Z : Landmark Thematic Maps – Medicine". Princeton University Library. 2012. 13 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Mayıs 2018.
- ^ Morman ET (2006). "Smallpox". Finkelman P (Ed.). Encyclopedia of the New American Nation. Charles Scribner's Sons. ss. 207-08.
- ^ a b Hopkins DR (2002). The greatest killer : smallpox in history, with a new introduction. Chicago: University of Chicago Press. ISBN 978-0-226-35168-1.
- ^ a b Bazin H (2000). The Eradication of Smallpox. Londra: Academic Press. ss. 94-102. ISBN 978-0-12-083475-4.
- ^ Rusnock A (2009). "Catching cowpox: the early spread of smallpox vaccination, 1798-1810". Bulletin of the History of Medicine. 83 (1): 17-36. doi:10.1353/bhm.0.0160. PMID 19329840.
- ^ Smith MM (1970). "The 'Real Expedición Marítima de la Vacuna' in New Spain and Guatemala". Trans. Am. Philos. Soc. New Series. 64 (4): 1-74. doi:10.2307/1006158. JSTOR 1006158.
- ^ Ranscombe P (July 2022). "Vaccine Voyages: where science meets slavery". The Lancet Infectious Diseases. 22 (7): 956. doi:10.1016/s1473-3099(22)00270-5. ISSN 1473-3099. PMC 9023002 $2. 8 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Haziran 2022.
- ^ Tizard, Ian R. (2023). A History of Vaccines and Their Opponents. Elsevier. s. 99.
- ^ "Nova et Vetera". British Medical Journal. 1 (2370): 1297-1298. June 1906. doi:10.1136/bmj.1.2370.1297. PMC 2381502 $2. PMID 20762710.
- ^ Meyer C, Reiter S (December 2004). "[Vaccine opponents and sceptics. History, background, arguments, interaction]". Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz (Almanca). 47 (12): 1182-1188. doi:10.1007/s00103-004-0953-x. PMID 15583889.
- ^ Klein S, Schöneberg I, Krause G (October 2012). "Vom Zwang zur Pockenschutzimpfung zum Nationalen Impfplan". Bundesgesundheitsblatt (Almanca). pp. 1512–1523. 55. doi:10.25646/1620.
- ^ Jarlert A (2001). Sveriges Kyrkohistoria. 6. Stockholm. ss. 33-54.
- ^ Rheinberger R (1976). "Zum 200. Geburtstag von Landesphysikus Gebhard Schaedler. Ein Liechtensteinischer Artzt als Pionier der Pockenschutzimpfung.". Jahrbuch des Historischen Vereins fur das Furstentum Liechtenstein. Historischer Verein fur das Furstentum Liechtenstein. 76. ss. 337-343. 27 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ekim 2021.
- ^ Pead PJ (December 2003). "Benjamin Jesty: new light in the dawn of vaccination". Lancet. 362 (9401): 2104-2109. doi:10.1016/S0140-6736(03)15111-2. PMID 14697816.
- ^ Plett PC (2006). "[Peter Plett and other discoverers of cowpox vaccination before Edward Jenner]". Sudhoffs Archiv (Almanca). 90 (2): 219-232. JSTOR 20778029. PMID 17338405.
- ^ a b Williams G (2010). Angel of Death; the story of smallpox. Basingstoke: Palgrave Macmillan. ss. 162-73. ISBN 978-0-230-27471-6.
- ^ a b c Williamson S (2007). The Vaccination Controversy; the rise, reign and decline of compulsory vaccination. Liverpool: Liverpool University Press. ISBN 9781846310867.
- ^ George NA (November 1952). "Compulsory smallpox vaccination; the University City, Missouri, case". Public Health Reports. 67 (11): 1135-1138. doi:10.2307/4588305. JSTOR 4588305. PMC 2030845 $2. PMID 12993980.
- ^ "Toward a Twenty-First-Century Jacobson v. Massachusetts" (PDF). Harvard Law Review. The Harvard Law Review Association. 121 (7): 1823-1824. May 2008. 26 Ekim 2014 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 13 Mart 2014.
- ^ "A Brief Biography of Dr. Louis T. Wright". North by South: from Charleston to Harlem, the great migration. 20 Ekim 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2006.
- ^ "Spotlight on Black Inventors, Scientists, and Engineers". Department of Computer Science of Georgetown University. 7 Eylül 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2006.
- ^ a b Copeman SM (May 1898). "The Milroy Lectures on the Natural History of Vaccina: Delivered at the Royal College of Physicians". British Medical Journal. 1 (1951): 1312-1318. doi:10.1136/bmj.1.1951.1312. PMC 2411485 $2. PMID 20757828.
- ^ a b Didgeon JA (May 1963). "Development of Smallpox Vaccine in England in the Eighteenth and Nineteenth Centuries". British Medical Journal. 1 (5342): 1367-1372. doi:10.1136/bmj.1.5342.1367. PMC 2124036 $2. PMID 20789814.
- ^ Creighton C (1887). The Natural History of Cowpox and Vaccinal Syphilis. Londra: Cassell.
- ^ Copeman SM (1892). "The Bacteriology of Vaccine Lymph". Shelley CE (Ed.). Transactions of the Seventh International Congress of Hygiene and Demography. Eyre and Spottiswoode. ss. 319-26. Erişim tarihi: 14 Ocak 2014.
- ^ Copeman PW (February 1998). "Extinction of the speckled monster celebrated in 1996". Journal of Medical Biography. 6 (1): 39-42. doi:10.1177/096777209800600108. PMID 11619875.
- ^ Dixon CW (1962). Smallpox. Londra: J. & A. Churchill. ss. 280-81.
- ^ Special Commission (1900). "Report of the Lancet Special Commission on Glycerinated Calf Lymph Vaccines". Lancet. 155 (4000): 1227-36. doi:10.1016/s0140-6736(01)96895-3.
- ^ Collier LH (March 1955). "The development of a stable smallpox vaccine". The Journal of Hygiene. 53 (1): 76-101. doi:10.1017/S002217240000053X. PMC 2217800 $2. PMID 14367805.
- ^ "Professor Leslie Collier". The Telegraph. 22 Mart 2011. 12 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Mayıs 2013.
- ^ Baxby D (October 2005). "Development of a stable smallpox vaccine: Collier L. J Hyg 1955; 53: 76–101". Epidemiology and Infection. 133 (Suppl. 1): S25-S27. doi:10.1017/S0950268805004280. PMID 24965243.
- ^ Kirkup JR (2006). The Evolution of Surgical Instruments. Novato, California: Norman Publishing. ss. 419-37. ISBN 978-0-930405-86-1.
- ^ a b Rubin BA (May 1980). "A note on the development of the bifurcated needle for smallpox vaccination". WHO Chronicle. 34 (5): 180-181. PMID 7376638.
- ^ Henderson DA (2009). Smallpox; the death of a disease. Amherst, New York: Prometheus Books. ss. 26-27. ISBN 978-1-59102-722-5.
- ^ "Smallpox > Bioterrorism". U.S. Centers for Disease Control and Prevention (CDC). 19 Aralık 2016. 19 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mayıs 2022.
- ^ Halsell JS, Riddle JR, Atwood JE, Gardner P, Shope R, Poland GA, Gray GC, Ostroff S, Eckart RE, Hospenthal DR, Gibson RL, Grabenstein JD, Arness MK, Tornberg DN (June 2003). "Myopericarditis following smallpox vaccination among vaccinia-naive US military personnel". JAMA. 289 (24): 3283-3289. doi:10.1001/jama.289.24.3283. PMID 12824210.
- ^ Strom B, Stratton K, Anason AP, Baciu A (2005). "4. Lessons Learned from the Smallpox Vaccination Program". The Smallpox Vaccination Program: Public Health in an Age of Terrorism. Washington, DC: National Academies Press. ss. 82-97. doi:10.17226/11240. ISBN 0-309-54877-2. 14 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Ağustos 2022.
- ^ Mackenzie D (22 Ağustos 2003). "US smallpox vaccination plan grinds to a halt". New Scientist. 7 Şubat 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Eylül 2019.
- ^ Public Services and Procurement Canada (21 Nisan 2022). "Third Generation Smallpox Vaccine (6D024-215700/A)". Government of Canada. 20 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Haziran 2022.
- ^ Osman L (20 Mayıs 2022). "Canada considering smallpox vaccine for monkeypox cases, says Dr. Theresa Tam". CTV News. 20 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Haziran 2022.
- ^ Public Health Agency of Canada (24 Mayıs 2022). "Statement from the Minister of Health on Canada's Response to Monkeypox". Government of Canada. 11 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2022.
- ^ Smithson C, Kampman S, Hetman BM, Upton C (2014). "Incongruencies in Vaccinia Virus Phylogenetic Trees". Computation. 2 (4): 182-98. doi:10.3390/computation2040182.
- ^ Flint J, Racaniello VR, Rall GF, Hatziioannou T, Skalka AM (7 Ağustos 2020). Principles of Virology (5. bas.). John Wiley & Sons. ISBN 978-1-68367-033-9. 8 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2022.
- ^ Jenner E (1798). An Inquiry into the Causes and Effects of the Variolæ Vaccinæ. Londra: Self-published. 11 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Temmuz 2022.
- ^ Esparza J, Schrick L, Damaso CR, Nitsche A (December 2017). "Equination (inoculation of horsepox): An early alternative to vaccination (inoculation of cowpox) and the potential role of horsepox virus in the origin of the smallpox vaccine". Vaccine. 35 (52): 7222-7230. doi:10.1016/j.vaccine.2017.11.003. PMID 29137821.
- ^ Taylor HH (October 1889). "What is Vaccinia?". British Medical Journal. 2 (1504): 951-52. ISSN 0007-1447. PMC 2155820 $2.
- ^ Smith GL, Vanderplasschen A (1998). "Extracellular Enveloped Vaccinia virus: Entry, Egress, and Evasion". Enjuanes L, Siddel SG, Spaan W (Ed.). Coronaviruses and Arteriviruses. 440. Springer Science & Business Media. s. 396. ISBN 978-0-306-45910-8. PMID 9782308.
- ^ ICTV Taxonomy history: Cowpox virus. 14 Nisan 2021. 15 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Nisan 2021.
Varidnaviria > Bamfordvirae > Nucleocytoviricota > Pokkesviricetes > Chitovirales > Poxviridae > Chordopoxvirinae > Orthopoxvirus > Cowpox virus
- ^ Tulman ER, Delhon G, Afonso CL, Lu Z, Zsak L, Sandybaev NT, Kerembekova UZ, Zaitsev VL, Kutish GF, Rock DL (September 2006). "Genome of horsepox virus". Journal of Virology. 80 (18): 9244-9258. doi:10.1128/JVI.00945-06. PMC 1563943 $2. PMID 16940536.
- ^ Esparza J (September 2013). "Has horsepox become extinct?". The Veterinary Record. 173 (11): 272-273. doi:10.1136/vr.f5587. PMID 24057497.
- ^ a b Duggan AT, Klunk J, Porter AF, Dhody AN, Hicks R, Smith GL, Humphreys M, McCollum AM, Davidson WB, Wilkins K, Li Y, Burke A, Polasky H, Flanders L, Poinar D, Raphenya AR, Lau TT, Alcock B, McArthur AG, Golding GB, Holmes EC, Poinar HN (July 2020). "The origins and genomic diversity of American Civil War Era smallpox vaccine strains". Genome Biology. 21 (1): 175. doi:10.1186/s13059-020-02079-z. PMC 7370420 $2. PMID 32684155.
- ^ Schrick L, Tausch SH, Dabrowski PW, Damaso CR, Esparza J, Nitsche A (October 2017). "An Early American Smallpox Vaccine Based on Horsepox". The New England Journal of Medicine. 377 (15): 1491-1492. doi:10.1056/NEJMc1707600. PMID 29020595.
- ^ Damaso CR (February 2018). "Revisiting Jenner's mysteries, the role of the Beaugency lymph in the evolutionary path of ancient smallpox vaccines". The Lancet Infectious Diseases. 18 (2): e55-e63. doi:10.1016/S1473-3099(17)30445-0. PMID 28827144. 21 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2022.
- ^ a b Brinkmann A, Souza AR, Esparza J, Nitsche A, Damaso CR (December 2020). "Re-assembly of nineteenth-century smallpox vaccine genomes reveals the contemporaneous use of horsepox and horsepox-related viruses in the USA". Genome Biology. 21 (1): 286. doi:10.1186/s13059-020-02202-0. PMC 7716468 $2. PMID 33272280.
Dış bağlantılar[değiştir | kaynağı değiştir]
| Wikimedia Commons'ta Çiçek aşısı ile ilgili ortam dosyaları bulunmaktadır. |
- Çiçek Hastalığı ABD Hastalık Kontrol ve Korunma Merkezleri (İngilizce)
- Çiçek Bulaşıcı Hastalıklar Araştırma ve Politika Merkezi (İngilizce)
- "Smallpox/Monkeypox Vaccine Information Statement". U.S. Centers for Disease Control and Prevention (CDC). November 2022. 3 Haziran 2022 tarihinde kaynağından arşivlendi. (İngilizce)
- "Interim Clinical Considerations for Use of JYNNEOS and ACAM2000 Vaccines during the 2022 U.S. Mpox Outbreak". U.S. Centers for Disease Control and Prevention (CDC). 2 Ağustos 2023. 27 Şubat 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2023. (İngilizce)
- "Medication Guide Smallpox (Vaccinia) Vaccine, Live ACAM2000" (PDF). Emergent Biosolutions. (İngilizce)