Тетрагидрометаноптерин
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Тетрагидрометаноптерин | |
|---|---|
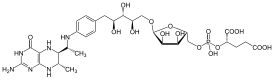 | |
| Общие | |
| Хим. формула | C30H45N6O16P |
| Физические свойства | |
| Молярная масса | 776,68 г/моль |
| Классификация | |
| Рег. номер CAS | 92481-94-2 |
| PubChem | 5462234 |
| SMILES | |
| InChI | |
| ChEBI | 17321 |
| ChemSpider | 4573696 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тетрагидрометаноптерин (H4-МП) — коэнзим, участвующий в процессе метаногенеза. Он переносит одноуглеродные группы, начиная с формильной, которая затем последовательно восстанавливаются до метильной и переносятся на коэнзим M[1].
Тетрагидросарцинаптерин (H4-СП) отличается от метаноптерина наличием глутамина, присоединённого к 2-гидроксиглутаровой кислоте на его конце.
Преобразование одноуглеродных фрагментов[править | править код]
В процессе метаногенеза N-формилметанофуран передаёт одноуглеродный фрагмент на N5 атом птеринового кольца, в результате чего образуется формил-H4-МП[2]. После этого от формильной группы отщепляется вода и образуется метенил-H4-МП, который затем восстанавливается до метилен-H4-МП[3]. Метилен-H4-МП впоследствии восстанавливается с использованием кофактора F420 в качестве донора электронов до метил-H4-МП. Реакция катализируется F420-зависимой метилен-H4-МП редуктазой. Завершаются преобразования тем, что метилен-H4-МП передаёт метильную группу на коэнзим M при посредничестве кобальт содержащего белка[1].
Сравнение с тетрагидрофолиевой кислотой[править | править код]
Тетрагидрометаноптерин схож по структуре с другим переносчиком одноуглеродных фрагментов — тетрагидрофолиевой кислотой. Основное различие между ними — это наличие у тетрагидрофолата электроноакцепторной карбонильной группы в фенильном кольце. Как следствие, метенил-H4-МП гораздо труднее восстанавливается по сравнению с метенил-ТГФ. Восстановление осуществляется так называемой гидрогеназой, не содержащей железосерный кластер[3]. Такое нескладное название придумано, чтобы отличать эту гидрогеназу от так называемых железных гидрогеназ, которые содержат железосерный кластер.
Примечания[править | править код]
- ↑ 1 2 Thauer R. K. Biochemistry of methanogenesis: a tribute to Marjory Stephenson:1998 Marjory Stephenson Prize Lecture // Microbiology. — 1998. — 1 сентября (т. 144, № 9). — С. 2377—2406. — ISSN 1350-0872. — doi:10.1099/00221287-144-9-2377.
- ↑ Acharya Priyamvada, Warkentin Eberhard, Ermler Ulrich, Thauer Rudolf K., Shima Seigo. The Structure of Formylmethanofuran: Tetrahydromethanopterin Formyltransferase in Complex with its Coenzymes // Journal of Molecular Biology. — 2006. — Март (т. 357, № 3). — С. 870—879. — ISSN 0022-2836. — doi:10.1016/j.jmb.2006.01.015.
- ↑ 1 2 Korbas Malgorzata, Vogt Sonja, Meyer-Klaucke Wolfram, Bill Eckhard, Lyon Erica J., Thauer Rudolf K., Shima Seigo. The Iron-Sulfur Cluster-free Hydrogenase (Hmd) Is a Metalloenzyme with a Novel Iron Binding Motif // Journal of Biological Chemistry. — 2006. — 3 августа (т. 281, № 41). — С. 30804—30813. — ISSN 0021-9258. — doi:10.1074/jbc.M605306200.