Zapalenie

Zapalenie[1][2][3], stan zapalny[1], reakcja zapalna[3], proces zapalny[3], odczyn zapalny[3] (łac. inflammatio[3]) – uporządkowany proces rozwijający się w tkance unaczynionej pod wpływem czynnika uszkadzającego. Zapalenie może być spowodowane czynnikami: chemicznymi, fizycznymi, biologicznymi (zakażenie drobnoustrojami chorobotwórczymi) - ogólnie czynnikami egzogennymi lub endogennymi[1][2]. Celem zapalenia jest obrona organizmu[3]. Proces zapalny powinien więc doprowadzić do usunięcia czynnika chorobotwórczego i pozwolić na powrót tkanki do stanu fizjologicznego. U większości osób starszych, jednakże, przejście zapalenia w stan chroniczny może stać się jednym z czynników zagrożenia większą umieralnością[4].
U podłoża reakcji zapalnej leżą zmiany w naczyniach krwionośnych. Dochodzi do rozszerzenia naczyń, zwiększenia ukrwienia tkanki i przepuszczalności naczyń, na skutek czego do zaatakowanej tkanki mogą przedostawać się różne białka osocza, pełniące funkcje obronne, np. przeciwciała lub dopełniacz. Niezależnie od tego ścisłego znaczenia, nazwa zapalenie odnosi się również do zespołu objawów np. zaczerwienienie (rubor), ból (dolor), podwyższona temperatura (calor), obrzęk (tumor), zaburzenie funkcji tkanki (functio laesa), które towarzyszą wymienionym procesom.
W terminologii łacińskiej stosuje się nazwy inflammatio lub phlegmasia (np. phlegmasia coerulea dolens), częściej do nazwy narządu lub tkanki zajętego stanem zapalnym dodaje się przyrostek -itis np. coniunctivitis, stomatitis, proctitis[5].
Etapy reakcji zapalnej[edytuj | edytuj kod]
Gdy patogen pokona zewnętrzne bariery, rozpoczyna się zapalenie. Pobudzeniu ulegają komórki tuczne, komórki dendrytyczne oraz makrofagi które fagocytują i wydzielają mediatory reakcji zapalnej. Substancje te powodują lokalne rozszerzenie naczyń krwionośnych oraz pojawienie się cząstek adhezyjnych (adhezyny) na komórkach śródbłonka żyłek (limfocyty przechodzą przez wysoki śródbłonek obwodowych naczyń limfatycznych; wszystkie leukocyty mogą przechodzić przez żyłki poza włosowe narządów nielimfatycznych[6]). Prowadzi to do migracji leukocytów. Przybyłe neutrofile prowadzą dalszą fagocytozę, a następnie są fagocytowane przez makrofagi. Fragmenty uszkodzonej tkanki i martwe leukocyty tworzą ropę. Napływające komórki NK niszczą patogeny i zakażone komórki organizmu oraz wydzielają interferon, co prowadzi do aktywacji makrofagów, prezentacji antygenu oraz uruchomieniu mechanizmów odporności swoistej za sprawą limfocytów Th1[7].
Migracja leukocytów do miejsca zapalenia[edytuj | edytuj kod]
Każda reakcja zapalna zachodzi w kilku krokach, które w sensie ogólnym są takie same, zaś dzięki pewnym różnicom obserwowane efekty mogą być zupełnie odmienne. Te różnice dotyczą głównie zestawu białek, które na każdym z etapów odgrywają zasadniczą rolę. Mamy bowiem do czynienia z określonymi rodzinami białek, których przedstawiciele mogą między sobą różnić się dosyć subtelnymi szczegółami, ale mającymi niebagatelny wpływ na całość. Ogólnie w napływie leukocytów można wyróżnić następujące etapy, przedstawione dalej w sposób bardziej szczegółowy:
- marginację, która zwykle nie bywa w ogóle wyodrębniana, jest bowiem zależna jedynie od fizycznych właściwości krwi
- toczenie się, które jest procesem zależnym od selektyn
- aktywację, w której główną rolę odgrywają cytokiny, zwłaszcza ich duża grupa zwana chemokinami
- ścisłą adhezję, zależną głównie od grupy białek noszących nazwę integryn
- diapedezę, czyli proces przechodzenia leukocytu przez barierę śródbłonka oraz tkankę do miejsca występowania antygenu.
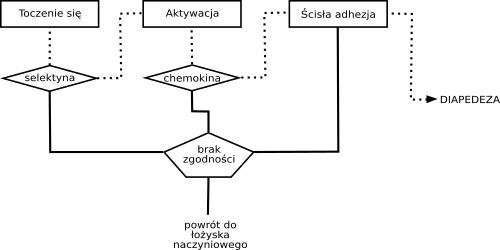
Poniższy rysunek przedstawia poszczególne etapy: 
Marginacja[edytuj | edytuj kod]
Proces polegający na wypchnięciu leukocytu z głównego strumienia krwi w kierunku ściany naczynia krwionośnego przebiegający w żyłkach pozakapilarnych, czyli naczyniach znajdujących się po sieci naczyń włosowatych. Istotny jest tutaj fakt, że ścianę żyłek stanowią jedynie komórki śródbłonka, bez występującej pod nimi warstwy mięśniowej, co pozwala leukocytom łatwiej przechodzić do tkanki. Ponadto tlen, który miał być dostarczony do komórek organizmu został już oddany w naczyniach włosowatych, dzięki czemu duże ilości leukocytów przyczepiających się do śródbłonka nie blokują transportu tego gazu[8].
Toczenie się[edytuj | edytuj kod]
Zjawisko toczenia się (ang. rolling) jest następstwem marginacji. Leukocyty, stykając się ze ścianą naczynia (komórkami śródbłonka), napotykają tam selektyny. Na powierzchni leukocytu występują odpowiednie receptory, które mogą się wiązać z selektynami. Efektem tego wiązania jest chwilowe zaczepienie się komórki o śródbłonek, jednak napór wypływającego z naczynia włosowatego osocza oraz innych komórek powoduje, że połączenie między leukocytem a śródbłonkiem jest zrywane, a sama komórka lekko się obraca. Związanie się kolejnych receptorów z leżącymi dalej selektynami sprawia, że cały proces znowu się powtarza, leukocyt zaczyna więc toczyć się po śródbłonku.
Zjawisko toczenia się leukocytów jest istotne, gdyż umożliwia z kolei aktywację komórki. Jeżeli jednak leukocyt nie będzie posiadał receptorów dla określonych selektyn, to nie dojdzie do toczenia się i nie zajdą dalsze etapy zapalenia. Ponieważ znanych jest kilka selektyn, to już na tym etapie, w zależności od ich repertuaru na powierzchni śródbłonka oraz leukocytu, może dojść do wstępnej selekcji określonych grup komórek odpornościowych. Jej znaczenie na tym i późniejszych etapach zostanie omówione w dalszej części artykułu.
Aktywacja[edytuj | edytuj kod]
Podczas toczenia się komórka łączy się nie tylko z selektynami. Za pomocą innych receptorów bada ona powierzchnię komórek śródbłonka. Jeżeli napotka określone substancje, dojdzie do jej aktywacji, jeśli nie – leukocyt odłączy się od śródbłonka i wróci do głównego strumienia krwi, aby dalej krążyć po organizmie. Najważniejsze substancje aktywujące to chemokiny, które odegrają ważną rolę także podczas diapedezy. Znamy obecnie ponad 40 rodzajów tych cytokin oraz kilkanaście receptorów dla nich. Podobnie jak było to w wypadku selektyn, także tutaj leukocyt musi posiadać receptory dla chemokin, które występują na śródbłonku. Jest to prawdopodobnie najważniejszy etap selekcji leukocytów w danym procesie zapalnym, gdyż poszczególne populacje i subpopulacje leukocytów mają odmienny repertuar receptorów dla chemokin. Z kolei to, jakie chemokiny znajdą się na powierzchni śródbłonka, zależy w znacznej mierze od charakteru antygenu, który wywołał reakcję zapalną. Tak więc na etapie aktywacji w zasadzie zostaje podjęta decyzja wyboru mechanizmu, za pomocą którego zostanie usunięty patogen. Ma to duże znaczenie, gdyż inne mechanizmy uczestniczą w usuwaniu infekcji wirusowej, a inne w odpowiedzi przeciwbakteryjnej. Wybór złego mechanizmu może mieć fatalne skutki, gdyż komórki odpowiedzialne za zwalczanie bakterii praktycznie nie mogą zwalczyć wirusa i vice versa.
Ścisła adhezja[edytuj | edytuj kod]
W wyniku aktywacji dochodzi do gruntownych zmian w architekturze leukocytu, czego efektem jest gwałtowna zmiana kształtu komórki: z praktycznie kulistego, leukocyt staje się płaski i mocno przylega do śródbłonka. W ten sposób nie jest już narażony na silny prąd krwi i przestaje się toczyć. Etap ten, noszący miano ścisłej adhezji, jest możliwy dzięki połączeniu się integryn na powierzchni leukocytów z ich ligandami na powierzchni śródbłonka. Także tutaj, podobnie jak w dwóch poprzednich przypadkach dochodzi do selekcji komórek układu odpornościowego, ale już nie w tak dużym stopniu. Leukocyty zaczynają tutaj wypuszczać nibynóżki, co pozwala na pełzanie po śródbłonku. W efekcie mogą one dotrzeć do miejsc, w których między komórkami śródbłonka występują przerwy. Zapoczątkowuje to proces diapedezy.
Diapedeza (Transmigracja)[edytuj | edytuj kod]
Diapedeza jest wynikiem aktywacji komórki i polega na przechodzeniu leukocytów przez barierę śródbłonka oraz przemieszczaniu się przez tkankę do miejsca, w którym występuje patogen. Podczas diapedezy aktywowany leukocyt rozpoczyna wydzielanie licznych enzymów, trawiących tkankę i torujących mu drogę. Skąd jednak leukocyt "wie", w którą stronę ma się poruszać? Tutaj istotną rolę po raz drugi odgrywają chemokiny. Wydzielane są one m.in. przez uszkodzone tkanki lub też różne komórki pobudzone mediatorami z innych, zniszczonych komórek. Taka niebezpieczna sytuacja towarzyszy patogenom, dlatego też właśnie tam, gdzie znajduje się patogen, są też wydzielane chemokiny i inne cytokiny. Rozprzestrzeniają się one w otaczającej zagrożone miejsce tkance, zaś ich stężenie maleje wraz z odległością od miejsca występowania patogenu. Leukocyty mogą reagować na tak powstały gradient stężeń, mamy zatem do czynienia z typową chemotaksją dodatnią. Drogę do zagrożonego miejsca wyznacza więc rosnące stężenie chemokin. Po dotarciu do celu leukocyty zaczynają, dzięki wcześniejszej aktywacji, sprawować swoją funkcję obronną, co jest już w szczegółach zależne od ich właściwości. Nawet tutaj jednak wciąż podlegają ścisłej regulacji, która gwarantuje sukces w zwalczeniu patogenu.
Rola cytokin prozapalnych[edytuj | edytuj kod]
Żeby przedstawione powyżej etapy zapalenia mogły w ogóle zostać zapoczątkowane, leukocyt stykający się ze śródbłonkiem musi dostać sygnały o toczącym się procesie zapalnym. Jest to możliwe dzięki wcześniejszemu pobudzeniu komórek śródbłonka. Ich aktywacja następuje pod wpływem cytokin prozapalnych. Są one zwykle jednymi z pierwszych substancji, pojawiających się w wyniku uszkodzenia tkanki, ich wydzielanie może być wywoływane bezpośrednio przez czynnik uszkadzający albo też indukowane substancjami pochodzącymi z rozpadających się komórek, np. białkami szoku cieplnego. Działając na śródbłonek, cytokiny te, wspólnie z innymi substancjami, mogą zapoczątkowywać ekspresję genów dla selektyn i integryn, dzięki czemu może dojść do toczenia się i ścisłej adhezji. Chemokiny, przynajmniej niektóre, także mogą być wydzielane po zadziałaniu cytokin prozapalnych na śródbłonek, jednak wiele z nich jest transportowanych na jego powierzchnię wprost z miejsca występowania patogenu. Także cytokiny prozapalne odpowiedzialne są za rozluźnienie struktury śródbłonka, dzięki czemu zachodzi diapedeza oraz przenikanie białek osocza do tkanki objętej procesem zapalnym. Obok cytokin znaczną rolę odgrywają też takie czynniki, jak histamina, zwiększone ciśnienie osmotyczne oraz zakwaszenie ogniska zapalnego. Histamina wpływa na rozszerzenie naczyń i działa jako bodziec bólowy, co z kolei powoduje zwiększony napływ krwi do tkanki objętej zapaleniem (przekrwienie). Zwiększona kwasowość i ciśnienie osmotyczne powodują natomiast napływ płynu z krwi do tkanek.
Regulacja procesu zapalnego[edytuj | edytuj kod]
Wymienione powyżej etapy reakcji zapalnej oraz odpowiedzialne za nie białka pozwalają na przedstawienie (w znacznym uproszczeniu) następującego schematu regulacji zapalenia:
W celu lepszego przedstawienia tej regulacji posłużymy się następującym, hipotetycznym i skrajnie prostym przykładem. Wyobraźmy sobie trzy komórki o następujących właściwościach:
- komórka A: posiada receptor dla selektyny L, chemokin IL-8 i MIP-1alfa oraz integryny CD11a/CD18
- komórka B: ma na powierzchni receptor dla selektyny P i L, chemokiny IL-8 oraz integryny CD11b/CD18
- komórka C: posiada receptor dla selektyny P, chemokin IL-8 i MIP-1alfa oraz integryny CD11a/CD18
Niech dodatkowo śródbłonek posiada na powierzchni zwróconej do światła naczynia selektynę L, chemokinę IL-8 oraz integrynę CD11a/CD18.
W tym przykładzie komórka A oraz B mogą się toczyć po powierzchni śródbłonka i wchodzić w kolejny etap zapalenia. Komórka C już na tym etapie jest wyeliminowana, bowiem nie mogąc się toczyć, nie podlega również aktywacji, pomimo posiadania receptorów dla chemokiny obecnej na śródbłonku oraz odpowiedniego receptora dla integryn. Zarówno komórka A, jak i B będzie podlegać aktywacji, jednak nieobecność na komórce B receptora dla integryny CD11a/CD18 spowoduje, iż komórka B nie ulegnie ścisłej adhezji, a więc nie dojdzie w jej przypadku do diapedezy. Także ona wróci do krążenia, mimo tego, że już uległa aktywacji. W ten sposób w obronie organizmu weźmie udział jedynie komórka A. Ponieważ charakter patogenu powoduje pojawienie się odpowiednich cząsteczek na powierzchni śródbłonka, pośrednio właśnie od niego zależy wybór odpowiedniej komórki. W ten sposób najodpowiedniejszą okazała się komórka A, podczas gdy pozostałe nie tylko mogłyby zajmować niepotrzebnie miejsce, ale nawet zaszkodzić, wydzielając nieodpowiednie cytokiny i w ten sposób zaburzając odpowiedź. Podany przykład pokazuje, że jeśli wziąć pod uwagę znaczną ilość kombinacji istniejących cytokin prozapalnych, selektyn, integryn i chemokin, proces zapalny jest sterowany niezwykle precyzyjnie.
Podział zapaleń[edytuj | edytuj kod]
Regulacja zapalenia nie zawsze przebiega prawidłowo, czego konsekwencją jest możliwość powstania[8]:
- zapalenia ostrego (Inflamatio acuta), które jest procesem prawidłowym i pozwala na usunięcie patogenu, przekrwienie i wysięk, trwa kilka dni
- zapalenia podostrego (Inflamatio subacuta), którego obraz jest wysiękowy i wytwórczy, trwa kilkanaście dni
- zapalenia przewlekłego (Inflamatio chronica), które jest zjawiskiem polegającym na doborze złych mechanizmów efektorowych lub związane jest całkowicie z brakiem możliwości usunięcia patogenu. W tym przypadku mamy do czynienia z utrwaleniem wadliwych mechanizmów albo też z reakcją układu odpornościowego, która jest wręcz szkodliwa. Przykładem zapalenia przewlekłego może być alergia (a wskutek niej np. atopowe zapalenie skóry) lub gruźlica. Obraz wytwórczy, może trwać tygodnie, miesiące lub lata.
- zapalenia podprzewlekłego (Inflamatio subchronica)
Podział patomorfologiczny zapaleń[edytuj | edytuj kod]
- uszkadzające
- wytwórcze
- wysiękowe
- krwotoczne
- nieżytowe
- ropne
- rzekomobłoniaste
- surowicze
- włóknikowe
- wrzodziejące
- zgorzelinowe
Objawy stanu zapalnego[edytuj | edytuj kod]
- objawy miejscowe – wynikające bezpośrednio z przedstawionych powyżej procesów
- objawy uogólnione – rzutujące na cały organizm np. gorączka albo "łamanie w kościach" towarzyszące grypie
Objawy miejscowe[edytuj | edytuj kod]
Wymieniane już przez Celsusa w 40. roku naszej ery[3]:
- rubor – zaczerwienienie wynikające ze zwiększonego przepływu krwi w tym rejonie,
- tumor – obrzmienie będące skutkiem wycieku białek i komórek z naczyń do tkanki,
- dolor – ból powstający na skutek pobudzenia receptorów bólowych przez mediatory reakcji zapalnej i ucisk przez migrujące komórki układu odpornościowego,
- calor – ocieplenie będące również wynikiem zwiększonego przepływu krwi,
- functio laesa – utrata funkcji (częściowa lub całkowita) danego narządu.
Migracja limfocytów[edytuj | edytuj kod]
Podobnie do reakcji zapalnej zachodzi migracja limfocytów do węzłów chłonnych. Istnieje tutaj jednak kilka różnic:
- do węzłów nie dostają się dowolne leukocyty, a jedynie limfocyty
- śródbłonek wyściełający naczynia prowadzące do węzła to tzw. wysoki śródbłonek. Zawiera on na swej powierzchni jedynie selektyny, chemokiny i integryny, które w ogólnym rozrachunku pozwalają wyselekcjonować tylko limfocyty. Różni się on także morfologią komórek.
- białka biorące udział w migracji limfocytów do węzła są wytwarzane konstytutywnie (stale), a nie po stymulacji cytokinami prozapalnymi.
Dzięki tym zjawiskom limfocyty nie krążą po całym organizmie, a jedynie pomiędzy węzłami chłonnymi. W ten sposób mogą napotkać komórki, które dostarczają tam antygen i mogą pobudzać limfocyty do aktywacji. Dopiero tak zaktywowane komórki krążą po całym organizmie i w przypadku odnalezienia miejsca, gdzie przebiega zapalenie, mogą migrować do tkanek. Dzieje się tak dlatego, że po aktywacji w węźle chłonnym mają na swej powierzchni zestaw receptorów dla selektyn, chemokin i integryn, który umożliwia im wejście do tkanki. Limfocyty tym jednak różnią się od pozostałych leukocytów, że wchodzą praktycznie do każdego miejsca objętego zapaleniem, a kiedy nie odnajdą patogenu, wracają z powrotem do łożyska naczyniowego lub ulegają apoptozie.
Nazewnictwo[edytuj | edytuj kod]
W nomenklaturze medycznej nazwy zapaleń narządów w organizmie kończą się łacińskim przyrostkiem -itis, choć istnieją wyjątki, np. zapalenie płuc — pneumonia. Częściej używanymi przykładami są:
- Zapalenie żołądka (gastritis)
- Zapalenie dziąseł (gingivitis)
- Zapalenie cewki moczowej (urethritis)
- Zapalenie gardła (pharyngitis)
- Zapalenie jąder (orchitis)
- Zapalenie krtani (laryngitis)
- Zapalenie macicy (endometritis)
- Zapalenie mózgu (encephalitis)
- Zapalenie naczyń chłonnych (lymphangitis)
- Zapalenie naczyń krwionośnych (angiitis)
- Zapalenie nerek (nephritis)
- Zapalenie okostnej (periostitis)
- Zapalenie opłucnej (pleuritis)
- Zapalenie opon mózgowo-rdzeniowych (meningitis)
- Zapalenie osierdzia (pericarditis)
- Zapalenie oskrzeli (bronchiitis)
- Zapalenie otrzewnej (peritonitis)
- Zapalenie pęcherza moczowego (cystitis)
- Zapalenie pęcherzyka żółciowego (cholecystitis)
- Zapalenie płuc (pneumonia)
- Zapalenie pochwy (vaginiitis; colpitis)
- Zapalenie przydatków (adnexitis)
- Zapalenie przyzębia (periodontitis)
- Zapalenie spojówek (conjunctivitis)
- Zapalenie sutka (mastitis)
- Zapalenie ścięgien (tendinitis)
- Zapalenie trzustki (pancreatitis)
- Zapalenie ucha środkowego (otitis)
- Zapalenie wątroby (hepatitis)
- Zapalenie węzłów chłonnych (lymphonoduitis)
- Zapalenie wyrostka robaczkowego (appendicitis)
- Zapalenie zatok przynosowych (sinusitis)
- Zakrzepowo-zarostowe zapalenie naczyń (thrombangiitis obliterans)
Przypisy[edytuj | edytuj kod]
- ↑ a b c Marzena Popielarska-Konieczna: Słownik szkolny: biologia. Kraków: Wydawnictwo Zielona Sowa, 2003, s. 569. ISBN 83-7389-096-3.
- ↑ a b zapalenie, [w:] Encyklopedia PWN [dostęp 2015-01-19].
- ↑ a b c d e f g Tadeusz Krzymowski, Jadwiga Przała: Fizjologia zwierząt: podręcznik dla studentów wydziałów medycyny weterynaryjnej, wydziałów biologii i hodowli zwierząt akademii rolniczych i uniwersytetów : praca zbiorowa. Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne, 2005, s. 307. ISBN 83-09-01792-8.
- ↑ Bertrand Fougère, Eric Boulanger, Fati Nourhashémi et al.. Chronic Inflammation: Accelerator of Biological Aging. „J Gerontol A Biol Sci Med Sci”. DOI: 10.1093/gerona/glw240. PMID: 28003373. (ang.).
- ↑ Marcin Piekarz, Lingua Latina medicinalis, Wyd. Medycyna Praktyczna, 1996
- ↑ Jakub Gołąb, Marek Jakóbisiak, Witold Lasek, Tomasz Stokłosa: Immunologia. Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 192. ISBN 978-83-01-15154-6.
- ↑ Tadeusz Krzymowski, Jadwiga Przała: Fizjologia zwierząt : podręcznik dla studentów wydziałów medycyny weterynaryjnej, wydziałów biologii i hodowli zwierząt akademii rolniczych i uniwersytetów : praca zbiorowa. Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne, 2005, s. 307-310. ISBN 83-09-01792-8.
- ↑ a b Vinay Kumar [Red.], Ramzi S. Cotran [Red.], Stanley L. Robbins [Red.]: Patologia. Wrocław: Elsevier Urban & Partner, 2005. ISBN 83-89581-92-2.