Teoria pola krystalicznego

Teoria pola krystalicznego (TPK) – model opisujący strukturę elektronową związków kompleksowych tworzonych przez metale przejściowe. Teoria ta pozwala przewidzieć niektóre własności tych związków takie jak kolory, entalpię hydratacji oraz ich geometrię, ale nie nadaje się do kwantowego opisu wiązań chemicznych występujących w tych związkach. TPK została opracowana przez Hansa Bethego oraz Johna Hasbroucka van Vlecka[1] w latach 30. XX wieku. Teoria ta została połączona z teorią orbitali molekularnych by utworzyć bardziej złożoną i dającą lepszy obraz rzeczywistości teorię pola ligandów, która pozwala na opisanie wiązań występujących w związkach kompleksowych.
Zarys teorii pola krystalicznego[edytuj | edytuj kod]
Nawiązując do TPK oddziaływania pomiędzy metalem przejściowym a ligandem wynikają z przyciągania pomiędzy dodatnio naładowanym kationem metalu i ujemnie naładowanym ligandem. Teoria zakłada, że energia pięciokrotnie zdegenerowanego orbitalu d ulega zmianie po otoczeniu przez ładunki punktowe ligandów otaczające kation metalu. Gdy ligandy zbliżają się do jonu centralnego to dochodzi do ich odpychania przez elektrony metalu znajdujące się na zapełnionych orbitalach d. Dlatego też elektrony znajdujące się w pobliżu ligandów będą miały wyższą energię niż te położone dalej. W efekcie dochodzi do rozszczepienia zdegenerowanego orbitalu d kationu metalu. Na różnicę w energiach elektronów mają wpływ następujące czynniki:
- konfiguracja elektronowa kationu metalu
- stopień utlenienia metalu; zazwyczaj wysoki stopień utlenienia powoduje większą różnicę energii
- konfiguracja przestrzenna ligandów wokół jonu metalu
- rodzaj ligandów otaczających kation metalu
Kompleksy o geometrii oktaedrycznej są najbardziej rozpowszechnione. Zbudowane są one z jednego kationu metali i sześciu ligandów tworzących oktaedr. Taka aranżacja ligandów prowadzi do rozszczepienia energii orbitali d na dwa pasma o różnicy energii Δoct, gdzie orbitale dxy, dxz i dyz charakteryzują się niższą energią, natomiast orbitale dz2 i dx2-y2 są wysokoenergetyczne. Różnica energii wynika z odległości pomiędzy elektronami metalu a elektronami ligandów, przy większej odległości odpychanie pomiędzy nimi jest mniejsze, przez co energia orbitali też jest niższa.
Kompleksy tetraedryczne także są rozpowszechnione, w tej aranżacji cztery ligandy formują tetraedr dookoła centralnego kationu metalu. W tetraedrycznym polu krystalicznym także dochodzi do rozbicia zdegenerowanych orbitali d na dwa pasma o różnych energiach. Orbitale dz2 i dx2-y2 mają niższą energię, natomiast orbitale dxy, dxz i dyz mają wyższą energię. Widać, że w porównaniu do oktaedrycznego pola krystalicznego orbitale o niższej energii w przypadku geometrii tetraedrycznej mają wyższą energię.
Teoria pola krystalicznego może także posłużyć do opisu rozszczepienia energetycznego dla kompleksów o innych typach geometrii.
Wielkość przerwy energetycznej pomiędzy energiami orbitali d zależy od kilku czynników, takich jak chemiczna natura ligandów oraz kształt cząsteczki kompleksu. Niektóre ligandy zawsze prowadzą do powstania małej różnicy w wartości Δ, podczas gdy inne zawsze prowadzą do dużego rozszczepienia. Dobre wyjaśnienie dla tych efektów może dać dopiero teoria pola ligandów. Natomiast pomiary spektroskopowe pozwalają na stworzenie empirycznych reguł pozwalających na oszacowanie wielkości przerwy energetycznej. Szereg spektrochemiczny stanowi listę ligandów ułożoną wedle wrastającej energii rozszczepienia
I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < 2,2'-bipirydyna < phen < NO2− < PPh3 < CN− < CO
Stan utlenienia metalu także ma wpływ na wartość Δ. Wyższy stopień utlenienia danego metalu jest skorelowany z większą wartością przerwy energetycznej. Przykładowo kompleks V3+ ma wyższą wartość Δ niż połączenia kompleksowe V2+ dla takiego samego zbioru ligandów. Wywołane jest to większą gęstością ładunku dodatniego w przypadku V3+ przez co elektrony ligandów znajdują się bliżej orbitali d metalu co prowadzi do ich silniejszego wzajemnego odpychania się.
Kompleksy nisko- i wysokospinowe[edytuj | edytuj kod]

Ligandy powodujące duże rozszczepienie energii orbitali molekularnych d określane są mianem ligandów silnego pola, przykładem mogą być CN− lub CO. Kompleksy zawierające te ligandy wykazują tendencją do lokowania elektronów na orbitalach o niższej energii. Prowadzi to do sytuacji, w której orbitale te są całkowicie wypełnione, zanim zacznie się wypełnianie orbitali wysokoenergetycznych. Kompleksy tego rodzaju nazywane są kompleksami niskospinowymi. Przykładowo NO2− jest ligandem silnego pola wprowadzającym duże Δ. Oktaedryczny jon [Fe(NO2)6]3−, mając 5 elektronów na orbitalach d, posiada oktaedryczny diagram rozszczepienia, w którym wszystkie pięć elektronów znajduje się na poziomie energetycznym t2g.

Natomiast ligandy takie jak I− i Br− powodują małe rozszczepienie energetyczne Δ orbitali d i nazywane są kompleksami słabego pola. W ich przypadku wprowadzenie elektronów na poziomy wysokoenergetyczne jest bardziej preferowane, niż tworzenie par elektronów na poziomach o niższej energii (wynika z reguły Hunda). Dlatego też elektrony najpierw są umieszczane na wyższych poziomach, a dopiero później są parowane. Efektem jest tworzenie kompleksu nazywanego wysokospinowym. Przykładem może być kompleks [FeBr6]3−, mając pięć elektronów na orbitalach d, posiada oktaedryczny diagram rozszczepienia.
Warunkiem koniecznym do powstania kompleksu niskospinowego jest na tyle znaczna różnica w energiach pomiędzy poziomami t i g, by bardziej opłacalne energetycznie było umieszczanie kolejnego elektronu na poziomie już zajmowanym przez jeden elektron, niż przenoszenie go na wysokoenergetyczny poziom g. Innymi słowy Δ musi mieć wartość wyższą niż energia odpychania się dwóch elektronów. W innym przypadku powstanie kompleks wysokospinowy.
Energia rozszczepienia w polu krystalicznym dla kompleksów tetraedrycznych Δtet jest w przybliżeniu równa 4/9Δoct (energii rozszczepienia dla pola o geometrii oktaedrycznej). Wynika z tego, że energia wymagana do sparowania dwóch elektronów jest z reguły wyższa, niż energia konieczna do ulokowania elektronów na wyższych poziomach energetycznych. Dlatego też tetraedryczne kompleksy są zazwyczaj wysokospinowe.
Kompleksy wysokospinowe z uwagi na obecność niesparowanych elektronów często mają własności paramagnetyczne, przez co są przyciągane przez pole magnetyczne. Natomiast kompleksy niskospinowe z reguły mają własności diamagnetyczne, przez co w niewielkim stopniu są one wypychane przez pole magnetyczne.
Energia stabilizacyjna pola krystalicznego[edytuj | edytuj kod]
Energia stabilizacyjna pola krystalicznego (ESPK) wynika ze stabilizacji wywołanej umieszczeniem kationu metalu przejściowego w polu krystalicznym generowanym przez określony zbiór ligandów. Ponieważ orbitale atomowe d nie są zdegenerowane w polu ligandów, to niektóre poziomy energetyczne są bardziej stabilne, niż gdyby znajdowały się w hipotetycznym, barocentrycznym polu ligandów o symetrii kulistej, gdzie wszystkie orbitale mają taką samą energię. Przykładowo rozważając kompleks oktaedryczny, gdzie zestaw poziomów energetycznych t2g posiada niższą energię, niż zdegenerowane orbitale d. Ponieważ poziomy te są preferencyjnie wypełniane elektronami, to kompleks jest stabilniejszy energetycznie o wartość ESPK, niż jon w hipotetycznym polu sferycznym. Natomiast orbitale eg w oktaedrycznym polu krystalicznym posiadają energię wyższą o wartość ESPK, niż orbitale w polu sferycznym.

Jeżeli wartość rozszczepienia energetycznego orbitali d w oktaedrycznym polu ligandów zostanie zapisana jako Δoct, to trzy orbitale t2g są stabilniejsze, niż orbitale w polu sferycznym o wartość 2/5 Δoct, natomiast orbitale eg są destabilizowane względem orbitali w polu sferycznym o wartość 3/5 Δoct. W ramach przykładu można rozważyć dwie konfiguracje d5 opisane powyżej. Konfiguracja niskospinowa posiada pięć elektronów na orbitalach t2g, dlatego też całkowita wartość ESPK wynosi: 5 x 2/5 Δoct = 2Δoct. Z kolei konfiguracja wysokospinowa może zostać wyznaczona w następujący sposób: (3 x 2/5 Δoct) – (2 x 3/5 Δoct) = 0. Wynika z tego, że stabilizacja zapewniana przez elektrony znajdujące się na orbitalach o niskiej energii jest znoszona przez destabilizujący wpływ wysokoenergetycznych elektronów
Formalizm stabilizacji w polu krystalicznym może być stosowany do opisu kompleksów metali przejściowych o wszystkich typach geometrii. Przykładowo tłumaczy ona, dlaczego wiele kompleksów o konfiguracji elektronowej d8 ma geometrię płaską kwadratową. Jest ona wywołana przez znaczną stabilizację w kwadratowym polu ligandów.
Wpływ na własności spektroskopowe[edytuj | edytuj kod]
Wyraźne kolory przejawiane przez wiele kompleksów metali przejściowych mogą być wytłumaczone przy użyciu teorii pola krystalicznego. W sytuacji gdy orbitale atomowe d ulegają rozbiciu na dwa opisane powyżej zbiory, po absorpcji fotonu światła jeden z elektronów może przeskoczyć na wyższy poziom energetyczny, co prowadzi do wzbudzenia atomu. Różnica energii pomiędzy atomem w stanie podstawowym a wzbudzonym jest równa energii zaabsorbowanego kwantu. Ponieważ jedynie fotony o ściśle określonych długościach fali mogą zostać absorbowane, każdy związek posiada określone zabarwienie.
W zależności od wybranego zestawu ligandów pole krystaliczne wokół kationu metalu będzie miało odmienne wartości. Dla danego kationu pole krystaliczne generowane przez ligandy słabego pola będzie się charakteryzowało małą wartością Δ, co pozwala na absorpcję fotonów o dużej długości fali (jest ona odwrotnie proporcjonalna do energii). Natomiast wprowadzenie tego kationu w pole generowane przez ligandy silnego pola skutkować będzie absorpcją fotonu o małej długości fali. Jednakże w rzeczywistości jedynie w niewielu przypadkach energia absorbowanych fotonów bezpośrednio nawiązuje do wielkości przerwy energetycznej pomiędzy orbitalami. Wywołane jest to przez odpychanie się elektronów oraz efekt Jahna-Tellera, które w znaczący sposób zmieniają zarówno geometrię kompleksów, jak i różnicę w energii pomiędzy stanem podstawowym i stanami wzbudzonymi.

Przedstawione koło barw wskazuje, jakie zabarwienie związku będzie widoczne w zależności od energii zaabsorbowanego kwantu energii (rozpatrując jedynie absorpcję w świetle widzialnym).
| Absorbowana barwa | wartość λ absorbowanej barwy | Obserwowana barwa | wartość λ obserwowanej barwy |
|---|---|---|---|
| fioletowy | 400 nm | zielono-żółty | 560 nm |
| niebieski | 450 nm | żółty | 600 nm |
| niebiesko-zielony | 490 nm | czerwony | 620 nm |
| żółto-zielony | 570 nm | fioletowy | 410 nm |
| żółty | 580 nm | granatowy | 430 nm |
| pomarańczowy | 600 nm | niebieski | 450 nm |
| czerwony | 650 nm | zielony | 520 nm |
Diagramy rozszczepienia energii orbitali[edytuj | edytuj kod]
Oktaedr | Bipiramida pentagonalna | Antypryzmat kwadratowy |
|---|---|---|
 |  |  |
| Kwadratowy płaski | Piramida kwadratowa | Tetraedr |
 | 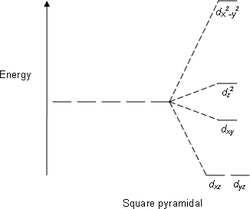 |  |
Bipiramida trygonalna | ||
 |
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ J.H. Van Vleck. Theory of the Variations in Paramagnetic Anisotropy Among Different Salts of the Iron Group. „Phys. Rev.”. 41, s. 208–215, 1932. DOI: 10.1103/PhysRev.41.208.
Bibliografia[edytuj | edytuj kod]
- Kettle, S.F.A. Fizyczna chemia nieorganiczna na przykładzie chemii koordynacyjnej, PWN Warszawa, 1999. ISBN 83-01-12840-2
- Zumdahl, Steven S. Chemical Principles Fifth Edition. Boston: Houghton Mifflin Company, 2005, s. 550–551, 957–964.
- Silberberg, Martin S. Chemistry: The Molecular Nature of Matter and Change, wyd. 4, New York: McGraw Hill Company, 2006, s. 1028–1034.
- D.F. Shriver, P.W. Atkins Inorganic Chemistry, wyd. 3, Oxford University Press, 2001. s. 227–236.
- Housecroft, C.E.; Sharpe, A.G. (2005) Inorganic Chemistry, wyd. 2, Pearson Education Limited. ISBN 0-13-039913-2
- Miessler, G.L.; Tarr, D.A. (2003) Inorganic Chemistry, wyd. 3, New Jersey: Pearson Prentice Hall. ISBN 0-13-035471-6