Ortoestry


Ortoestry – organiczne związki chemiczne z grupy estrów, w których wszystkie atomy tlenu wyjściowego kwasu, także te, które były połączone wiązaniem podwójnym z atomem centralnym (X=O), uległy estryfikacji. Termin ten stosowany jest zwykle do estrów kwasów karboksylowych, jednak w ujęciu ogólnym dotyczy także innych kwasów, np. kwasu fosforowego[1].
Ortoestry kwasów karboksylowych[edytuj | edytuj kod]
Ortoestry kwasów karboksylowych mogą być traktowane jako produkty wyczerpującej estryfikacji kwasów ortokarboksylowych (nietrwałych produktów przyłączenia cząsteczki wody do reszty karboksylowej; patrz też acetale). Charakteryzują się występowaniem trzech reszt alkoksylowych przyłączonych do jednego atomu węgla. Łatwo ulegają hydrolizie, zwłaszcza w środowisku kwasowym.
Otrzymywanie[edytuj | edytuj kod]
- Reakcja alkoholanów z chloroformem (który można tu uważać za chlorek kwasowy kwasu ortomrówkowego). Produktami są ortomrówczany alkilowe.
- Reakcja nitryli z alkoholami (reakcja Pinnera):
- RCN + 3R’OH + HCl → RC(OR’)3 + NH4Cl
Hydroliza[edytuj | edytuj kod]
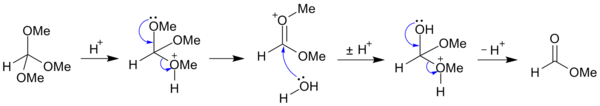
Podobnie jak acetale, ortoestry szybko hydrolizują w łagodnych warunkach kwasowych do estrów i alkoholi, są natomiast trwałe w środowisku zasadowym:
- RC(OR’)3 + H2O → RCO2R’ + 2R’OH
Reakcja zaczyna się od protonowania i eliminacji jednej z grup alkoksylowych. Następnie następuje addycja cząsteczki wody i eliminacja drugiej grupy alkoksylowej:
Zastosowanie[edytuj | edytuj kod]
Tworzenie ortoestru jest wykorzystywane jako ochrona grup estrowych (→ grupy ochronne), kwasów karboksylowych[2] i 1,2-dioli[3]. Ponadto z ortoestrów można otrzymywać ketale oraz aldehydy.
Przypisy[edytuj | edytuj kod]
- ↑ Ramirez, Fausto. Oxyphosphoranes. „Accounts of Chemical Research”. 1 (6), s. 168-174, 1968. DOI: 10.1021/ar50006a002.
- ↑ Theodora W. Greene, Peter G. M. Wuts: Protective groups in organic synthesis. John Wiley & Sons, 1999, s. 437-440. ISBN 0-471-16019-9.
- ↑ Theodora W. Greene, Peter G. M. Wuts: Protective groups in organic synthesis. John Wiley & Sons, 1999, s. 231-237. ISBN 0-471-16019-9.
Literatura[edytuj | edytuj kod]
- David A. Shirley "Chemia organiczna", str. 438-439, Wydawnictwa Naukowo-Techniczne, Warszawa 1968.