Carcharhinus amboinensis

| Carcharhinus amboinensis[1] | |||
| (Müller i Henle, 1839)[2] | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Rząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | Carcharhinus amboinensis | ||
| Synonimy | |||
| | |||
| Kategoria zagrożenia (CKGZ)[6] | |||
brak danych | |||
| Zasięg występowania | |||
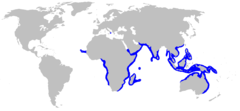 Zasięg występowania Carcharhinus amboinensis | |||
Carcharhinus amboinensis – gatunek rekina z rodziny żarłaczowatych (Carcharhinidae). Występuje w tropikalnych wodach wschodniego Oceanu Atlantyckiego, Oceanu Indyjskiego i południowo-zachodniego Oceanu Spokojnego – od Wysp Zielonego Przylądka na zachodzie po Archipelag Tonga na wschodzie. Zamieszkuje płytkie przybrzeżne wody na głębokości do 150 m, wzdłuż górnych półek szelfów kontynentalnych. Korpus tego gatunku jest masywny, krótki szeroki tępo zakończony pysk z U-kształtnym otworem gębowym oraz dużą heterocerkiczną płetwę ogonową z wolnym fałdem skórnym na końcu jej górnego łuku. Zwierzę osiąga maksymalnie 2,8 m długości.
Głównym pożywieniem tego rekina są małe ryby kostnoszkieletowe, rzadziej poluje na głowonogi, skorupiaki i ryby chrzęstnoszkieletowe. Pasożytami C. amboinensis są tasiemce i widłonogi. Podobnie jak inne żarłaczowate jest żyworodny. Samica po trwającej 9-12 miesięcy ciąży rodzi zazwyczaj od 3 do 13 młodych, mierzących około 60–75 cm. Rekin ten poławiany jest przez ludzi dla mięsa, płetw, oleju z wątroby i mączki rybnej, choć brakuje szczegółowych danych na ten temat. Międzynarodowa Unia Ochrony Przyrody (IUCN) nie posiada wystarczających informacji, by określić globalny stan populacji tego gatunku. Subpopulacja z południowo-zachodniego Oceanu Indyjskiego otrzymała status NT.
Taksonomia i filogenetyka[edytuj | edytuj kod]
Rekin ten został opisany w 1841 roku przez dwóch niemieckich przyrodników Johannesa Petera Müllera i Friedricha Gustava Jakoba Henle jako Carcharias (Prionodon) amboinensis. Typowy okazem (holotypem) była samica, złowiona w wodach przybrzeżnych wyspy Amboina (obecnie Ambon, w Archipelagu Moluków należącym do Indonezji), przechowywana w National Natuurhistorisch Museum w holenderskiej Lejdzie[2]. Obecnie uznaje się, że podrodzaj Carcharias (Prionodon) jest synonimem rodzaju Carcharhinus Blainville, 1816, pomimo formalnych niedostatków opisu rodzaju Carcharhinus dokonanego przez Blainville'a[7][8]. Spotykane w literaturze nazwy Carcharhinus ambioensis (Müller & Henle, 1841) oraz Carcharinus amboinensis (Müller & Henle, 1841) zawierają błędy literowe i nie powinny być używane[9].
Nazwa rodzajowa (z greki: κάρχαρος =karcharos – zaostrzony, ῥίς, ῥινός =rhinos – nos) odnosi się do kształtu głowy[9]. Epitet gatunkowy jest eponimem utworzonym od nazwy miejsca złowienia holotypu – wyspy Amboina[2].
W pracy dotyczącej badań filogenetycznych żarłaczowatych na podstawie cech morfologicznych, opublikowanej w 1982 roku, Jack Garrick uznał na podstawie kształtu zębów, stosunków wielkości oraz rozmieszczenia płetw, że C. amboinensis tworzy klad z żarłaczem tępogłowym (C. leucas), siostrzany do kladu tworzonego przez C. melanopterus i C. cautus[10]. W 1988 roku Leonard Compagno opierając się na fenetycznych badaniach potwierdził bliskie pokrewieństwo z C. leucas, lecz uznał te dwa gatunki za siostrzane do rodzajów Glyphis, Lamiopsis i Negaprion[11]. W 2012 roku Tillett i inni za jego najbliższych krewnych uznali C. fitzeroyensis i C. sorrah[12]. Z badań molekularnych, na podstawie czterech loci mitochondrialnych (COI, NADH-2, CytB, 16S RNA) oraz jednego locus jądrowego (Rag-1) wynika, że C. amboinensis nie jest gatunkiem siostrzanym żarłacza tępogłowego i w obrębie rodziny Carcharhinidae należy do osobnego kladu, blisko są z nim natomiast spokrewnione C. brachyurus i C. brevipinna[13].
Występowanie i środowisko[edytuj | edytuj kod]

Carcharhinus amboinensis zamieszkuje tropikalne wody wschodniego Oceanu Atlantyckiego, Oceanu Indyjskiego i południowo-zachodniego Oceanu Spokojnego. W Atlantyku spotyka się go w wodach wokół Wysp Zielonego Przylądka oraz u zachodnich wybrzeży Afryki, od południowych krańców Sahary Zachodniej po Nigerię na północy oraz od Gabonu po północne krańce Namibii na południu. Według pojedynczych doniesień widywany również w Morzu Śródziemnym[14]. Na zachodzie Oceanu Indyjskiego zamieszkuje przybrzeżne obszary od prowincji KwaZulu-Natal (Południowa Afryka) poprzez Półwysep Somalijski po południową Erytreę oraz wody wokół Madagaskaru, Wysp Sokotra, Archipelagu Zanzibar, Archipelagu Czagos, Komorów, Seszeli, Maskarenów i Amirantów[15]. Na północy spotykany w Morzu Czerwonym[16], Zatoce Adeńskiej, Zatoce Omańskiej, na południu Zatoki Perskiej, u wybrzeży Półwyspu Arabskiego[17], Iranu, Pakistanu i południowo-zachodnich Indii oraz wokół Cejlonu, Lakszadiwów, Malediwów, Nikobarów i Andamanów[18]. Rekin ten najpospoliciej występuje na wschodzie, gdzie rozpowszechniony jest w Morzu Andamańskim, Morzu Południowochińskim, w południowym Morzu Wschodniochińskim[19], oraz w indonezyjskich morzach Celebes, Banda, Arafura, Jawajskim, Flores, Timor, Seram i Sulu. U wybrzeży Australii spotykany na całej północy, od Perth na zachodzie po Półwysep Jork na wschodzie i dalej na południe, aż po Sydney[20]. W wodach Oceanu Spokojnego zamieszkuje okolice Wysp Vanuatu, Palau, Salomona, Fidżi, Gilberta, Marshalla, Mikronezji, Tonga, Samoa, Mariany, wybrzeża Nowej Kaledonii i Nowej Gwinei oraz wody Morza Koralowego i Morza Filipińskiego[11].
Podobnie jak inne rekiny z rodzaju Carcharhinus preferuje płytkie przybrzeżne wody szelfów kontynentalnych, o piaszczystym dnie do głębokości 150 m (zwykle 30–80 m)[9]. U wybrzeży zarówno wschodniej jak i zachodniej Afryki C. amboinensis migrują wzdłuż wybrzeży, pokonując niekiedy ponad 1200 km rocznie. Podobna sytuacja ma miejsce u wybrzeży Australii[21]. Osobniki populacji zamieszkujących wody Indonezji i Oceanii, podobnie jak osobniki młodociane, są filopatryczne, zazwyczaj nie zmieniają obszaru, na którym przebywają[22]. Przedstawiciele tego gatunku rekina występują zazwyczaj do 40–50 km od brzegu, choć pojedyncze osobniki spotykane są dużo dalej. Spotykany jest najczęściej w pobliżu dna morskiego. Niekiedy wpływa do estuariów i ujść rzek, podobnie jak żarłacz tępogłowy, choć nie tak często i nie tak daleko jak tamten gatunek[23].
Cechy morfologiczne[edytuj | edytuj kod]
W wodach północnej Australii największy złowiony samiec mierzył 231 cm, podczas gdy największa samica: 242 cm, natomiast największe osobniki złowione u wybrzeży Republiki Południowej Afryki miały 238 (samiec) i 245 (samica) cm długości[24]. Rekordowym okazem była brzemienna samica wyłowiona w 1956 roku przez francuskiego ichtiologa Pierre Fourmanoira w wodach wschodniego Madagaskaru, mierząca 280 cm[25]. C. amboinensis posiada masywny, dobrze zbudowany korpus, przypominający ten u żarłacza tępogłowego. Pysk jest krótki, szeroki i ostro zakończony. Jego U-kształtny otwór gębowy jest wyposażony w kilkanaście rzędów zębów w każdej ze szczęk. Górne zęby w kształcie równobocznych trójkątów o piłkowanych krawędziach i szerokiej, niskiej podstawie, dolne zaś są węższe (lecz w porównaniu do dolnych zębów innych gatunków Carcharhinus stosunkowo szerokie), trójkątne o ostrych, równych krawędziach, gruzełkowatej tylnej powierzchni i szerokiej, masywnej podstawie[26]. Nozdrza rozmieszczone są szeroko nieco poniżej oczu, blisko przedniej krawędzi pyska. Posiadają duże, trójkątne fałdy skórne. Okrągłe małe oczy wyposażone są w półksiężycowate fałdy spojówek (ochraniające migotkę). Nad nimi znajdują się niewielkie, lekko spłaszczone, owalne tryskawki. Rekin ten posiada pięć niedużych, równych szczelin skrzelowych. Piąta para umiejscowiona jest za proksymalną krawędzią płetw piersiowych. Na spodzie pyska widoczne są liczne elektroreceptory, zwane ampułkami Lorenziniego[10].
Szeroka, niska, tępo zakończona pierwsza płetwa grzbietowa przypomina mocno wygięty ku tyłowi sierp. Posiada długą, wolną, dalszą końcówkę. Jej podstawa usadowiona nad tylnymi krawędziami płetw piersiowych. Stosunkowo niska druga płetwa grzbietowa ma romboidalny kształt i wąską podstawę. Umiejscowiona jest przed przednią krawędzią płetwy odbytowej. Pomiędzy płetwami grzbietowymi nie występuje międzygrzbietowy łuk[27][20]. Równe płetwy piersiowe są krótkie, ale za to stosunkowo szerokie, w kształcie trójkątów o prostej dystalnej krawędzi. Płetwy brzuszne są proporcjonalnie duże, ich przednia krawędź wraz z dolną krawędzią tworzy kąt prosty. U samca z części płetw brzusznych wykształcił się narząd kopulacyjny zwany pterygopodium. Płetwa odbytowa jest mała, posiada głębokie, ostre wygięcie i mocno wygiętą ku tyłowi dolną końcówkę. Na końcu ogona mieści się długa, heterocerkiczna, asymetryczna płetwa ogonowa. Jej dolny łuk jest kilkukrotnie krótszy od górnego, osiągającego niekiedy prawie metr długości, na którego końcu mieści się szeroki, wydłużony fałd skórny poprzedzony wyraźnym, sierpowatym wcięciem[10]. Skórę pokrywają romboidalne, połyskujące łuski plakoidalne[18]. Grzbiet rekina cechuje się jasnoszarą, błękitną lub jasnobrązową barwą. Spód oraz boki są jaśniejsze, najczęściej barwy śnieżnobiałej. Na krawędziach płetw piersiowych oraz płetwy ogonowej widoczne niekiedy ciemniejsze zabarwienia[11].
Ekologia i zachowanie[edytuj | edytuj kod]

C. amboinensis zamieszkujące wybrzeża wschodniej Afryki żywią się głównie żyjącymi przy dnie rybami kostnoszkieletowymi, stanowiącymi 62% ich diety, i chrzęstnoszkieletowymi (w szczególności rajowatymi) oraz skorupiakami (krewetkami, krabami, homarami i równonogami), głowonogami (kałamarnicami i ośmiornicami) i ślimakami tyłoskrzelnymi[28]. U wybrzeży Australii dieta tego rekina jest podobna, choć mniej zróżnicowana[29]. Wśród pasożytów tego gatunku wyróżniono między innymi tasiemce (Callitetrarhynchus gracilis, Heteronybelinia australis[30], Floriceps minacanthus[31] i Protogrillotia zerbiae[32]) i widłonogi (Kroyeria procerobscena i Paralebion elongatus[33]). W pozbyciu się parazytów zewnętrznych pomagają rekinowi ryby z rodzajów Labroides i Caranx[31]. Na dorosłe osobniki nie poluje żaden naturalny drapieżnik z uwagi na spore rozmiary tych ryb[9]. Młode czasami padają ofiarą większego żarłacza tępogłowego[29].
Cykl życiowy[edytuj | edytuj kod]
Podobnie jak inne żarłaczowate, jest żyworodny[34]. Samce dojrzewają płciowo przy długości 2,1 m, samice zaś po osiągnięciu 215–220 cm[6]. Zarówno na wschodzie, jak i zachodzie Oceanu Indyjskiego kopulacja następuje w styczniu lub lutym[35]. W wodach Oceanii do zapłodnienia dochodzi w maju, a we wschodnim Atlantyku od października do listopada. W tym okresie pobudzone samce uporczywie próbują doprowadzić do kopulacji, często w sposób agresywny, gryząc samicę w okolice płetwy grzbietowej. Jest to typowe zachowanie dla żarłaczowatych. Kopulacja odbywa się za pomocą pterygopodium, narządu wykształconego z dystalnych fragmentów płetw brzusznych u samców. Długość ciąży zależy od położenia geograficznego, dla populacji australijskich wynosi 9 miesięcy[29], dla południowoafrykańskich i pozostałych 11-12[36]. Embriony w ciele matki zużywają zapasy żółtka z pęcherzyka żółtkowego, który później łączy się ze ścianą macicy tworząc tzw. łożysko żółciowe, dzięki któremu dostarczane jest pożywianie z organizmu matki[11]. Młode rodzą się od października do grudnia, z wyjątkiem obszarów Oceanii, gdzie poród następuje w od kwietnia do maja. Samica wydaje na świat od 3 do 13 (u wybrzeży RPA zwykle 5[36], w Australii najczęściej 9[29]) potomków, mierzących około 60–75 cm. Bez względu na pochodzenie geograficzne liczba młodych zależy od wielkości matki: im większa samica, tym liczniejszy miot[11]. W Australii największy opisany zarodek miał 59 cm, podczas gdy najmniejszy swobodnie pływający osobnik mierzył 66 cm[37]. U wybrzeży Afryki młode rodzą się większe (rekordowo 79 cm)[36]. Każda z pięciu brzemiennych samic wyłowionych w Zatoce Karpentaria w latach 90. XX wieku nosiła miot o stosunkowo równych proporcjach samców do samic[6]. Zwyczaje i preferencje siedliskowe analizowano u osobników młodocianych zasiedlających rejon Cleveland Bay, w stanie Queensland. Okazuje się, że przez pierwsze kilka lat młodociane osobniki pozostają w płytkich (nie głębszych niż 40 m) przybrzeżnych wodach, w pobliżu ujść rzek, w wodach o stosunkowo silnych prądach i dużym zamuleniu – prawdopodobnie dzięki temu są mniej narażone na ataki drapieżników niż w strefie otwartego morza. Osobniki młodociane zajmują stosunkowo niewielkie terytoria (średnio 30 km²), poszerzając je stopniowo wraz z wiekiem, i podczas przypływu penetrują w poszukiwaniu pokarmu strefę pływów. W związku z sezonowymi zmianami zasolenia i koncentracji tlenu, powodowanymi przez zasilające zatokę wody rzek, podczas pory suchej przemieszczają się bliżej ujść rzek, natomiast podczas pory deszczowej oddalają się od nich[23][38]. Samice zachodzą w ciążę regularnie co dwa lata[18].
Relacje z ludźmi[edytuj | edytuj kod]

Rekin ten u wybrzeży północnej Australii poławiany jest nielicznie za pomocą sieci skrzelowych, sieci przydennych i specjalnych linek z haczykami w szczególności dla mięsa i płetw[21]. Brakuje jednak dokładnych danych na ten temat[6]. Niekiedy wykorzystuje się również olej z wątroby oraz pochodną mączkę rybną[39]. Według programu The Northern Pelagic Fish Stock gatunek ten pomiędzy styczniem 1984 a majem 1985 stanowił 0,5% połowów rekinów za pomocą sieci skrzelowych oraz 3,5% w przypadku lin z haczykami[40]. W latach 1978-1990 w sieci chroniące plaże KwaZulu-Natal wpadło 16 rekinów C. amboinensis (0,5% wszystkich rekinów, 0,4 os./km), najwięcej w Richards Bay, gdzie ochronne sieci wprowadzono w 1981 roku[15]. Znajdowany jest niekiedy jako przyłów[29]. Jako konsumenci szczytowi w sieciach pokarmowych są podatne na bioakumulację toksyn, co może powodować zatrucia ludzi spożywających ich mięso. W roku 1993 około 500 ludzi w okolicach Manakara na Madagaskarze uległo zatruciu po spożyciu mięsa C. amboinensis, skażonego toksyną, produkowaną przez morskie bruzdnice. Spośród nich zmarło 98 osób – było to pierwsze tak masowe zatrucie pokarmowe po spożyciu rekina oraz pierwsze z tak wysoką śmiertelnością[41]. Jest uważany za gatunek stanowiący potencjalne zagrożenie dla kąpiących się w morzu, ale nie odnotowano jego ataków na ludzi[11].
Zagrożenia i ochrona[edytuj | edytuj kod]
Z uwagi na brak wystarczających informacji na temat wielkości populacji oraz wpływu rybołówstwa na liczebność tego gatunku Międzynarodowa Unia Ochrony Przyrody (IUCN) nie potrafi ustalić stopnia zagrożenia (DD)[6]. Subpopulacja z południowo-zachodniego Oceanu Indyjskiego uznana została za bliską zagrożenia (NT)[42].
Przypisy[edytuj | edytuj kod]
- ↑ Carcharhinus amboinensis, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b c d J.P. Müller & F.G.J. Henle: Systematische Beschreibung der Plagiostomen. Berlin: Veit, 1839, s. 40, (ryc. 19 (zęby)). (niem.).
- ↑ P. Bleeker. Diagnostische beschrijvingen van nieuwe of weinig bekende vischsoorten van Batavia. Tiental I-VI. „Natuurkundig Tijdschrift voor Nederlandsch Indië”. 4 (3), s. 507, 1853. (niderl.).
- ↑ P. Bleeker. Enumeratio specierum piscium hucusque in Archipelago indico observatarum, adjectis habitationibus citationibusque, ubi descriptiones earum recentiores reperiuntur, nec non speciebus Musei Bleekeriani Bengalensibus, Japonicis, Capensibus Tasmanicisque. „Acta Societatis Regiae Scientiarum Indo-Neêrlandicae”. 6, s. 206, 1859. (łac.).
- ↑ F. Day: The fishes of India; being a natural history of the fishes known to inhabit the seas and fresh waters of India, Burma, and Ceylon. Cz. 2. London: B. Quaritch, 1878, s. 720, ryc. clxxxix (rys. 3). (ang.).
- ↑ a b c d e G. Cliff, Carcharhinus amboinensis, [w:] The IUCN Red List of Threatened Species 2020, wersja 2020-2 [dostęp 2020-08-28] (ang.).
- ↑ Bigelow H.B., & W.C. Schroeder. 1948. Fishes of the Western North Atlantic, Cz. 1: Sharks. Memoir Sears Found. Mar. Res. New Haven, str. 320, pp: 59-576.
- ↑ Boeseman M. 1960. A tragedy of errors: the status of Carcharhinus Blainville, 1816; Galeolamma Owen, 1853; Eulamia Gill, 1861; and the identity of Carcharhinus commersonii Blainville, 1825. Zoologische Madedelinge, Rijksmuseum van Natuurlijke Historie Leiden, XXXVII(6): 81-100.
- ↑ a b c d Carcharhinus amboinensis. (ang.) w: Froese, R. & D. Pauly. FishBase. World Wide Web electronic publication. fishbase.org [dostęp 1 grudnia 2012]
- ↑ a b c Garrick, J.A.F. (1982). Sharks of the genus Carcharhinus. NOAA Technical Report, National Marine Fisheries Service. 445-494.
- ↑ a b c d e f Compagno, L.J.V.: Sharks of the Order Carcharhiniformes. Princeton University Press, 1988, s. 319-320. ISBN 0-691-08453-X.
- ↑ Tillett, B.J., Field, I.C., Bradshawd, C.J.A., Johnson, G., Buckworthf, R.C., Meekanb, M.G., Ovendenh, J.R.. Accuracy of species identification by fisheries observers in a north Australian shark fishery. „Fisheries Research”. 127, s. 109-115, 2012. Elsevier. DOI: 10.1016/j.fishres.2012.04.007.
- ↑ Velez-Zuao X. & Agnarsson I. 2011. Shark tales: A molecular species-level phylogeny of sharks (Selachimorpha, Chondrichthyes). Molecular Phylogenetics & Evolution 58: 207-217.
- ↑ De Maddalena, A., Della Rovere, G.. First record of the pigeye shark, Carcharhinus amboinensis (Müller & Henle, 1839), in the Mediterranean Sea. „Annales, Series Historia Naturalis”. 15 (2), s. 209-212, 2005.
- ↑ a b Cliff, G., Dudley, S.F.J.. Sharks caught in the protective gill nets off Natal, South Africa. 5. The Java shark Carcharhinus amboinensis (Müller & Henle). „South African Journal of Marine Science”. 11 (1), s. 443-453, 1991. DOI: 10.2989/025776191784287817.
- ↑ Spaet, J.L.Y., Cochran, J.E.M., Berumen, M.L.. First record of the Pigeye Shark, Carcharhinus amboinensis (Müller & Henle, 1839) (Carcharhiniformes: Carcharhinidae), in the Red Sea. „Zoology in the Middle East”. 52, s. 118-121, 2011.
- ↑ Carpenter, K.E., Krupp, F., Jones, D.A., Zajonz, U.: The living marine resources of Kuwait, Eastern Saudi Arabia, Bahrain, Qatar, and the United Arab Emirates. Rzym: Food and Agriculture Organization of the United Nations (FAO), 1997.
- ↑ a b c Raje, S.G., Sivakami, S., Mohan G., Manoj Kumar, P.P., Raju, A. i Joshi, K.K.. An Atlas on the Elasmobranch fishery resources of India. „CMFRI”. 95 (Special Publication), s. 29-31, 2007.
- ↑ Randall, J.E., Lim, K.K.P.. A checklist of the fishes of the South China Sea. „Raffles Bulletin of Zoology”. 8, s. 569-667, 2000.
- ↑ a b McAuley, R.B., Newbound, D.R., Ashworth, R.. Field identification guide to Western Australian Sharks and Shark-like Rays. „Fisheries Occasional Publications”. 1, s. 17, 2002.
- ↑ a b Last, P.R., Stevens, J.D.: Sharks and Rays of Australia. Melbourne, Australia: Commonwealth Scientific and Industrial Research Organisation (CSIRO), 1994.
- ↑ White, W.T., Last, P.R., Stevens, J.D., Yearsley, G.K., Fahmi, D., Dharmadi. Economically important sharks and rays of Indonesia. „ACIAR Monograph”. 124, s. 1-329, 2006.
- ↑ a b Knip, D.M., Heupel, M.R., Simpfendorfer, C.A., Tobin, A.J., Moloney, J.. Wet-season effects on the distribution of juvenile pigeye sharks, Carcharhinus amboinensis, in tropical nearshore waters. „Marine and Freshwater Research”. 62 (6), s. 658-667, 2011. DOI: 10.1071/MF10136.
- ↑ Bass, A.J., D'Aubrey, J.D., Kistnasamy, N.: Sharks of the east coast of southern Africa. I. The genus Carcharhinus (Carcharhinidae). South African Association for Marine Biological Research, Oceanographic Research Institute, Oceanographic Research Institute, 1973, s. 287-312.
- ↑ Fourmanoir, P.: Requins de la Côte Ouest de Madagascar. T. 4. Memoires de Institut Scientifique de Madagascar, 1961, s. 462-469, seria: F. Oceanographie.
- ↑ Naylor, G.J.P., Marcus, L.F.. Identifying Isolated Shark Teeth of the Genus Carcharhinus to Species: Relevance for Tracking Phyletic Change Through the Fossil Record.. „American Museum Novitates”. 3109, s. 1–53, 1994.
- ↑ Šanda, R., De Maddalena, A.. Collection of the sharks of the National Museum in Prague - Part 2. Skeletal preservations. „Journal of the National Museum, Natural History Series”. 173 (2), s. 51-58, 2004.
- ↑ Compagno, L.J.V., Ebert, D.A., Smale, M.J.: Guide to the sharks and rays of Southern Africa. Londyn: New Holland Ltd., 1989. ISBN 0-86977-880-3.
- ↑ a b c d e Stevens, J.D., McLoughlin, K.J.. Distribution, size and sex composition, reproductive biology and diet of sharks from northern Australia. „Australian Journal of Marine and Freshwater Research”. 42 (2), s. 151-199, 1991. DOI: 10.1071/MF9910151.
- ↑ Palm, H.W.: The Trypanorhyncha Diesing, 1863. Bogor: PKSPL-IPB Press, 2004, s. 216-219. ISBN 979-9336-39-2.
- ↑ a b Campbell, R.A., Beveridge, I.. Floriceps minacanthus sp. nov. (Cestoda: Trypanorhyncha) from Australian fishes. „Transactions of the Royal Society of South Australia”. 111 (4), s. 189-194, 1987.
- ↑ Palm, H.W., Waeschenbach, A., Olson, P.D., Littlewood, D.T.. Molecular phylogeny and evolution of the Trypanorhyncha Diesing, 1863 (Platyhelminthes: Cestoda). „Molecular Phylogenetics and Evolution”. 52, s. 351-367, 2009.
- ↑ Dippenaar, S.M., Jordaan, B.P.. New host and geographical records of siphonostomatoid copepods associated with elasmobranchs off the KwaZulu-Natal coast, South Africa. „Onderstepoort Journal of Veterinary Research”. 74 (2), s. 169-175, 2007.
- ↑ Dulvy, N.K., Reynolds, J.D.. Evolutionary transitions among egg-laying, live-bearing and maternal inputs in sharks and rays. „Proceedings of the Royal Society of London”. 264 (B), s. 1309-1315, 1997.
- ↑ Moore, A.B.M., McCarthy, I.D., Carvalho, G.R., Peirce, R.. Species, sex, size and male maturity composition of previously unreported elasmobranch landings in Kuwait, Qatar and Abu Dhabi Emirate. „Journal of Fish Biology”. 80 (5), s. 1619-1642, 2012. DOI: 10.1111/j.1095-8649.2011.03210.x.
- ↑ a b c Cliff, G., Dudley, S.F.J.. Reducing the environmental impact of shark-control programs: a case study from KwaZulu-Natal, South Africa. „Marine and Freshwater Research”. 62 (6), s. 700-709, 2011. DOI: 10.1071/MF1018.
- ↑ Stevens, J.D., West, G.J., McLoughlin, K.J.. Movements, recapture patterns, and factors affecting the return rate of carcharhinid and other sharks tagged off northern Australia. „Marine and Freshwater Research”. 51 (2), s. 127-141, 2000. DOI: 10.1071/MF98158.
- ↑ Knip, D.M., Heupel, M.R., Simpfendorfer, C.A., Tobin, A.J., Moloney, J.. Ontogenetic shifts in movement and habitat use of juvenile pigeye sharks Carcharhinus amboinensis in a tropical nearshore region. „Marine Ecology Progress Series”. 425, s. 233–246, 2011. DOI: 10.3354/meps09006.
- ↑ McLoughlin, K., Slack-Smith, R., Stevens, J.: Fishery Status Reports 1993, Resource Assessments of Australian Commonwealth Fisheries. Canberra, Australia: Bureau of Resource Sciences, 1994, s. 31-36.
- ↑ Bentley, N.: Australian overview. The World Trade in Sharks: a Compendium of TRAFFIC?s regional studies. Wyd. 2. Cambridge, Wielka Brytania: TRAFFIC Network, 1996.
- ↑ Gerhard G. Habermehl, Hans C. Krebs, Philippe Rasoanaivo, Angeline Ramialiharisoa. Severe ciguatera poisoning in Madagascar: A case report. „Toxicon”. 32 (12), s. 1539–1542, 1994. DOI: 10.1016/0041-0101(94)90312-3.
- ↑ G. Cliff, Carcharhinus amboinensis Southwest Indian Ocean subpopulation, [w:] The IUCN Red List of Threatened Species [dostęp 2021-02-13] (ang.).