Kwik(II)nitraat

| Kwik(II)nitraat | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
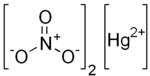 | |||||
Structuurformule van kwik(II)nitraat | |||||
| Algemeen | |||||
| Molecuulformule | Hg(NO3)2 | ||||
| IUPAC-naam | kwik(II)nitraat | ||||
| Andere namen | kwiknitraat, kwikdinitraat | ||||
| Molmassa | 324,7 g/mol | ||||
| CAS-nummer | 10045-94-0 | ||||
| EG-nummer | 233-152-3 | ||||
| Wikidata | Q417086 | ||||
| Beschrijving | Kleurloze kristallen of wit poeder | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H300 - H310 - H330 - H373 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P260 - P264 - P273 - P280 - P284 - P301+P310 | ||||
| Hygroscopisch? | ja | ||||
| VN-nummer | 1625 | ||||
| ADR-klasse | Gevarenklasse 6.1 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | kleurloos-wit | ||||
| Dichtheid | 4,4 g/cm³ | ||||
| Smeltpunt | 79 °C | ||||
| Goed oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Kwik(II)nitraat is een zeer giftig kwikzout van salpeterzuur, met als brutoformule Hg(NO3)2. De stof komt voor als een kleurloos of wit, goed in water oplosbaar kristallijn poeder. Het is een wateraantrekkende stof, die voorkomt als een monohydraat, Hg(NO3)2 · H2O, of dihydraat, Hg(NO3)2 · 2 H2O.
Synthese[bewerken | brontekst bewerken]
Kwik(II)nitraat kan bereid worden uit reactie van kwik en salpeterzuur. De oplossing die ontstaat moet echter zuur gehouden worden, omdat anders een neerslag ontstaat van hydrolyseproducten. Door indampen van de oplossing wordt het octahydraat verkregen.
Toepassingen[bewerken | brontekst bewerken]
Kwik(II)nitraat werd vroeger gebruikt om bont van dieren los te maken en om te zetten in vilt, maar dit gebruik is stopgezet. Lokeren (België) had vroeger een belangrijke viltnijverheid, die de oorzaak was van een historische kwikverontreiniging op en rond die zogenaamde haarsnijderijen.[1] Omwille van de giftigheid voor mens en milieu is het gebruik van kwik en kwikverbindingen nu sterk aan banden gelegd. In de Verenigde Staten werd het gebruik van kwik(II)nitraat in de bontindustrie al in 1941 door de United States Public Health Service verboden. Dit echter niet in verband met de schadelijke gevolgen voor mens en milieu, maar omdat door het gebruik van kwik(II)nitraat in de bontindustrie er minder beschikbaar was als detonator in de oorlog.[2]
Kwiknitraat is ook de katalysator in de zogenaamde Wolffenstein-Böters-reactie, waarmee gelijktijdig hydroxyl- en nitrogroepen op een aromatische verbinding worden aangebracht door een reactie met salpeterzuur. Een voorbeeld is de omvorming van benzeen tot picrinezuur.[3]
Kwikzouten, waaronder kwik(II)nitraat, kunnen ook gebruikt worden om de corrosiebescherming van staal in een zuur midden te verbeteren, meer bepaald bij olieboringen.[4][5]
Een verdunde oplossing van kwik(II)nitraat wordt in het laboratorium gebruikt als analytische standaard.[6]
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Kwik(II)nitraat is corrosief voor ogen, huid en luchtwegen en bij inslikken. Herhaald of langdurig contact kan de huid gevoelig maken. Kwik(II)nitraat kan effecten hebben op het centraal zenuwstelsel, het perifeer zenuwstelsel en de nieren.
Het is een sterke oxidator. Het is zelf niet brandbaar, maar het reageert hevig met brandbare en reducerende stoffen. Met onderfosforigzuur, ethanol en acetyleen vormt het schokgevoelige explosieve verbindingen.
Zie ook[bewerken | brontekst bewerken]
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|


