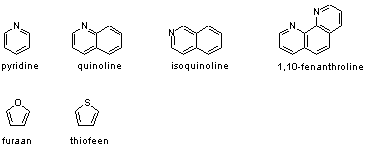Aromatische verbinding

Een aromatische verbinding of aromaat is in de scheikunde een organische verbinding die voldoet aan de regel van Hückel. Die zegt dat een verbinding aromatisch is als die boven en onder het molecuul een cyclische wolk van gedelokaliseerde π-elektronen (elektronen in een p-orbitaal) heeft en het aantal gedelokaliseerde π-elektronen 4n + 2 is. (n = 0, 1, 2, ... ). Een belangrijk kenmerk van aromatische verbindingen is het feit dat alle atomen in één plat vlak liggen.
Wanneer tussen twee atomen niet twee, maar vier elektronen worden gedeeld en zo zorgen voor de chemische binding (een zogenaamde dubbele binding of pi-binding), bevinden zich twee van die elektronen tussen de atomen, en twee andere in een vlak naast de binding. Deze laatste twee worden π-elektronen genoemd. Deze π-elektronen bevinden zich niet alleen tussen de atomen die ze binden, maar ook een beetje ernaast. Wanneer twee dubbele bindingen in een structuur gescheiden zijn door één enkele binding liggen de π-elektronen van de twee dubbele bindingen in hetzelfde vlak, en kunnen de π-elektronen van de ene dubbele binding naar de andere komen. Zulke systemen worden geconjugeerd genoemd, en de elektronen die door het molecuul kunnen bewegen noemt men gedelokaliseerd. Wanneer in een geconjugeerd systeem 4n+2 elektronen zitten (2, 6, 10, 14 of ...) en deze elektronen in ringen gedelokaliseerd zijn, dan levert dit een heel grote extra stabiliteit aan het molecuul. Een molecuul met zo'n systeem wordt aromatisch genoemd.
De eenvoudigste aromatische verbinding is benzeen. Naftaleen bestaat uit twee zesringen met 10 elektronen, daarop volgen met drie zesringen antraceen en fenantreen. Pyreen is een voorbeeld van een aromatisch molecuul met vier zesringen en 18 π-elektronen.
Aromatische verbindingen met een groot aantal ringen worden polycyclische aromatische koolwaterstoffen of PAK's genoemd. Deze verbindingen zijn veelal carcinogeen, omdat ze kunnen intercaleren in het DNA.
Heterocyclische aromaten[bewerken | brontekst bewerken]
In een aromatisch systeem zijn veel van de atomen koolstofatomen, maar dat is niet noodzakelijk. Ook andere atoomtypen als bijvoorbeeld zuurstof of stikstof kunnen aan een aromatisch systeem bijdragen. Vaak is het zo dat zulke heteroatomen meer dan één elektron of juist geen enkel elektron aan het aromatische systeem bijdragen. Zo kunnen aromatische systemen waar nog steeds 6 elektronen in zitten uit meer of minder dan 6 atomen bestaan. Een aantal eenvoudige voorbeelden zijn pyridine, chinoline, isochinoline en 1,10-fenantroline met stikstofatomen in het aromatische systeem. De stikstofatomen dragen 1 elektron bij aan het aromatische systeem. Voorbeelden met een zuurstof- en zwavelatoom zijn furaan en thiofeen. Bij deze laatste twee verbindingen dragen de heteroatomen twee elektronen bij aan het π-systeem.
Bij heteroatomen uit de tweede en hogere periode wordt de aromatische stabiliteit minder door de naast koolstof minder gunstige elektronenbanen in deze atomen.
Aromatische ionen[bewerken | brontekst bewerken]
Ook is het mogelijk dat door de extra stabiliteit die wordt gewonnen als er 2, 6 of 10 elektronen in een aromatisch systeem zitten, er uit een geconjugeerd systeem van 3, 7 of 11 elektronen een elektron wordt uitgestoten of in een systeem van 5 of 9 elektronen een extra elektron wordt ingevangen. Een voorbeeld hiervan met 2 elektronen is het cyclopropenyl-kation. Voorbeelden met 6 elektronen zijn het cyclopentadienylanion (extra elektron naast 5 'eigen'): C5H5−, en tropylium-kation (één elektron minder): C7H7+. Azuleen is een isomeer van naftaleen. In plaats van twee zesringen beschikt het molecuul over een vijfring en een ring van 7 koolstofatomen. De vijfring heeft een negatieve lading, de andere ring een positieve.
Toxicologie[bewerken | brontekst bewerken]
Veel aromaten zijn carcinogeen, dit komt omdat het polaire stoffen zijn die vrijuit door onze celmembranen bewegen en schade kunnen aanrichten aan DNA. Benzeen kent een MAC-waarde van 0,2 [ppm].