산-염기 항상성

| 산과 염기 |
|---|
 |
| 여러 가지 산 |
| 여러 가지 염기 |


산-염기 항상성(酸-鹽基恒常性, 영어: acid-base homeostasis)은 생물이 세포와 체액의 수소 이온 농도 또는 pH를 조절하는 항상성 기제이다. 많은 경우, 생물을 둘러싼 환경에 수소 이온은 매우 낮은 농도로만 존재한다. 하지만 수소 이온은 반지름이 매우 작아 전하 밀도가 높기 때문에 주변에 강한 전기장을 만든다. 따라서 수소 이온 농도가 조금만 바뀌어도 용액 속 각종 분자의 입체구조적 변화가 일어날 수 있다. 특히 효소 등 단백질은 수소 이온 농도에 따라 2차·3차 구조가 크게 변할 수 있어 매우 좁은 pH 범위 안에서만 제대로 기능하곤 한다. 이런 까닭에 많은 생물은 세포와 그 주변의 수소 이온 농도를 정밀하게 조절하는 기제를 갖추고 있다.[1][2] 예컨대 건강한 사람의 혈장 등 세포외액은 pH가 7.32~7.42 사이로 엄격하게 조절된다.[3][4][5][6][7] 태아도 성인과 정상 pH가 다르기는 하지만 좁은 범위로 유지되는 것은 마찬가지여서, 배꼽정맥 pH는 7.25~7.45, 배꼽동맥 pH는 7.18~7.38이다.[8]
변화하는 환경 속에서 세포의 pH를 일정하게 유지해야 한다는 과제는 식물이나 세균을 비롯하여 모든 생물이 마주하는 보편적인 도전이지만[9][10], 이 문서에서는 동물, 그 중에서도 특히 사람에 주로 초점을 맞춘다. 사람 몸에서는 세포 대사가 쉴새없이 일어나 각종 유기산이 만들어지며, 무기산 역시 대사로 생성되거나 음식 섭취로 유입된다. 또한 대변을 통해서는 염기가 빠져나간다.[11][12] 산·염기가 얼마나 출입하는지 그 양을 짐작하기란 매우 어렵지만[13], 체내에서 대사 산물로 만들어지는 유기산의 양만 따져도 하루에 약 15,000 mEq에 이르고, 그 밖에 산의 생성·섭취 및 염기 배설을 고려하면 하루에 산을 알짜로 약 70-80 mEq을 얻는 셈이라고 추산된 바 있다.[1][11] 이처럼 산이 계속 만들어지거나 유입되는데도 사람 체액의 수소 이온 농도는 변화가 크지 않아 pH 7.4에서 거의 벗어나지 않는다. 여러 기관계가 함께 작용하여 산-염기 항상성을 유지하기 때문이다.[1][11]
산-염기 항상성이 유지되지 못하면 체액의 수소 이온 농도가 비정상적으로 높아지거나 낮아질 수 있다. 동맥혈의 pH가 정상 값인 7.4보다 심하게 낮아지는 경우를 산혈증(acidemia), 높아지는 경우를 알칼리혈증(alkalemia)이라고 한다. pH가 6.8 미만으로 낮아지거나 8.0보다 높아지면 사람은 수 시간 이내에 죽는다.[1] 보통 pH 7.35 미만을 산혈증, 7.45 이상을 알칼리혈증이라고 본다. 갖가지 항상성 기제 가운데 하나가 망가지더라도 나머지가 더욱 활발하게 작동하여 보상하곤 하기에, pH만 보고 산-염기 항상성을 평가하기는 어렵다. 따라서 산-염기 장애(acid-base disorder, acid-base disturbance)는 실제로 나타난 변화가 아니라 경향성을 기준으로 정의된다. 체액을 산성화하는 경향을 보이는 기제나 과정이 있으면 이를 산성혈증(acidosis) 또는 산증이라고 하며, 체액을 알칼리화하는 기제나 과정이 있으면 알칼리증(alkalosis)이라고 한다. 겉으로 드러난 pH 변화는 여러 산증·알칼리증이 중첩된 결과일 수 있다.[1][14]
사람의 산-염기 항상성을 이해하는 방식은 시대에 따라 계속 바뀌어 왔으며[15][16][17], 사람 몸의 산-염기 항상성에 영향을 미치는 요인과 기제를 어떻게 설명해야 마땅한지, 산-염기 장애를 평가하고 구분하는 방법은 무엇이 가장 적절한지 지금까지도 의견이 갈린다.[16] 로런스 조지프 헨더슨과 도널드 밴슬라이크가 산염기 생리학의 기틀을 닦은 뒤로 지금까지 가장 널리 받아들여지는 것은 중탄산염 완충계의 역할이 핵심이라고 보는 시각이다.[16] 헨더슨-하셀바흐 방정식에 의해 탄산수소 이온과 이산화탄소의 비가 체액의 산염기 상태를 결정하며, 호흡계통이 이산화탄소 분압을 조절하고 콩팥이 탄산수소 이온 농도를 조절함으로써 균형이 유지된다.[14] 다만 이산화탄소 분압과 탄산수소 이온 농도만으로 환자의 산-염기 장애를 판단할 수 있는지, 아니면 염기과잉 등 더 정교한 도구가 필요한지 여부를 두고 견해차가 있다.[16] 한편 캐나다의 생리학자 피터 스튜어트는 중탄산염 완충계를 중시하는 관점에 반대하며, 체액의 전체 전해질 상태를 반영하는 강이온차이(strong ion difference, SID) 개념을 중심으로 한 이른바 물리화학적(physicochemical)[18] 접근법을 내세웠다.[19] 오늘날 임상에서 스튜어트 접근법을 활용하는 사람은 점점 많아지고 있으나[20][21], 그 이론과 쓸모를 둘러싼 논쟁은 여전히 이어지고 있다.[22][23][24] 이 문서에서는 주로 전통적인 시각을 따르되, 스튜어트 접근법이 제공하는 통찰을 일부 반영하여 서술한다.
개요
[편집]사람을 비롯한 동물에서 산-염기 항상성에 관여하는 기제를 세 가지 방어선으로 나누어 설명할 수 있다.[25][26]
- 혈액 속 화학적 완충계. 산-염기 생리학은 혈액에 산이나 염기를 첨가하여도 산염기 상태가 쉽게 변하지 않는다는 관찰에서 출발했다.[15][27] 혈액이 산염기 변동을 완충하는 작용은 다른 생리학적인 기제와 무관한 순전히 화학적인 현상으로, 용액 속에 약산과 그 짝염기 혹은 약염기와 그 짝산이 함께 있으면 르 샤틀리에의 원리에 의해 변동을 되돌리는 방향으로 반응이 진행되기 때문에 일어난다.[14] 혈액의 완충 능력에 기여하는 주된 약산-짝염기 쌍으로는 중탄산염 완충계, 인산염 완충계, 단백질 완충계 등이 있다. 산·염기가 생겨나거나 유입되면 이들 완충계가 수 초 이내에 중화한다. 다만 이는 pH 변화가 잠시 완화된 것일 뿐이다. 나머지 두 방어선이 작용하여 실제로 몸에서 산·염기를 제거하여야만 참으로 균형이 바로잡히게 된다.[1][14]
- 호흡계. 세포 대사로 생겨나는 막대한 양의 이산화탄소 및 유기산은 결국 탄산을 만든다. 탄산은 비교적 강한 산으로, 혈액에서 대부분 수소 이온과 탄산수소 이온으로 해리한다. 그런데도 수소 이온 농도가 크게 변하지 않는 것은 이산화탄소가 날숨으로 배출되기 때문이다. 호흡으로 이산화탄소를 배출하는 기제는 매우 효과적이어서, 호흡계통 기능이 정상이기만 하다면 세포 대사로 탄산이 얼마나 만들어지든 수 분 이내에 모두 제거된다. 이런 까닭에 탄산 및 탄산으로 대사되는 산을 휘발성 산(volatile acid)이라고 부른다.[1][12]
- 콩팥. 음식으로 섭취한 무기산 등 호흡으로 빠져나가지 못하는 비휘발성 산(nonvolatile acid, fixed acid)은 콩팥이 오줌으로 배설하여야 한다. 콩팥은 오줌의 조성을 조절함으로써 체액의 산염기 상태를 정상으로 되돌린다. 콩팥이 산-염기 항상성에 미치는 영향은 수 시간에서 수 일이 지나야 효과가 드러나지만 세 가지 방어선 가운데 가장 강력하다.[1]
헨더슨-하셀바흐 방정식
[편집]전통적인 산염기 생리학은 흔히 중탄산염 중심 접근법(bicarbonate-centered approach)이라고도 불리는데, 세포외액의 여러 완충계 중에서도 특히 중탄산염 완충계의 역할을 강조하기 때문이다.[16] 중탄산염 완충계는 H
2CO
3―HCO−
3 쌍으로 이루어진 완충계로, 다음과 같이 탄산의 해리 반응을 통해 산염기 변동을 완충한다.
체액에 산이 유입되어 H+
가 늘어나면 반응의 평형이 왼쪽으로 치우친다. 즉 늘어난 H+
를 HCO−
3가 중화하여 없앤다. 반대로 염기가 유입되면 OH−
가 H
2CO
3와 반응하여 물과 HCO−
3를 만든다. 즉 탄산이 OH−
를 중화하여 없앤다.[1] 중화되지 않고 남은 극소량의 H+
또는 OH−
에 의해 체액의 pH가 변동하게 된다.[28]
중탄산염 완충계의 평형을 정량적으로 따지려면 헨더슨-하셀바흐 방정식을 이용하면 된다. 용액에 용해된 기체의 농도가 공기 중 이산화탄소 분압에 비례한다는 헨리의 법칙 및 탄산 해리 반응 각 단계의 평형 조건을 결합하면 다음과 같은 수식을 얻는다.
여기서 상수 의 값은 약 10-6.1이고, 는 이산화탄소의 용해도계수(solubility coefficient)로 체온(37℃)에서 그 값은 약 0.03 mM/mmHg이다. 혹은 양변의 상용로그를 취해 변형하기도 한다.
보통 이 꼴로 나타낸 것을 헨더슨-하셀바흐 방정식이라고 부른다. 이때 pK는 로 정의되므로 그 값은 6.1이다.[29][30]
전통적인 중탄산염 중심 접근법에서 헨더슨-하셀바흐 방정식은 단순히 pH, , 의 상관관계를 기술하는 것이 아니라, pH가 와 의 비에 의해 결정된다는 인과관계를 나타낸다. 호흡계통과 콩팥이 각각 와 를 일정하게 유지함으로써 항상성이 유지된다.[14][31] 이러한 이치는 다음처럼 헨더슨-하셀바흐 방정식을 재치 있게 변형한 꼴로 요약된 바 있다.[32]
호흡계통과 콩팥의 항상성 조절
[편집]화학적 완충계, 호흡계통, 콩팥이 함께 산-염기 항상성을 조절하는 과정을 단순화하면 다음과 같다. 먼저 휘발성 산의 경우 호흡계통을 통해 쉽게 제거된다. 사람은 탄수화물·아미노산·지질 등을 산화하는 과정에서 하루에 약 15000 mEq의 이산화탄소를 생성한다. 이산화탄소가 모조리 혈중에 탄산으로 용해되어 H+
와 HCO−
3를 만든다면 혈액을 급격하게 산성화하겠지만, 호흡계통이 환기를 통해 재빨리 내보내므로 보통은 체액의 산염기 상태에 영향을 미치지 않는다. 이로써 호흡계통은 막대한 양의 잠재적 산을 제거한다.[12]
한편 무기산 섭취·염기 배설 등을 고려하였을 때 사람은 하루에 70-80 mEq 정도 비휘발성 산을 얻는다. 이러한 산 부하(acid challenge)에 맞서는 일차 방어선은 화학적 완충계이다. 먼저 중탄산염 완충계가 H+
부하를 대부분 중화하여, 중화한 양만큼 HCO−
3가 줄어들고 CO
2가 생성된다.
한편 중탄산염 완충계 이외의 다른 완충계도 기여한다.
이렇게 해서 H+
가 대부분(99.999% 이상) 중화되며, 그러고도 남은 극소량의 H+
가 혈액의 pH를 조금 떨어뜨린다. 산 부하는 중화되었지만 완충계를 이루는 성분들이 소모되었는데, 이를 보충해 주는 것이 콩팥의 역할이다. 콩팥은 매일 HCO−
3 약 70 mEq를 생성한다. 다시 말해 콩팥동맥을 통해 하루에 콩팥으로 유입되는 HCO−
3의 양보다 콩팥정맥을 통해 하루에 나가는 양이 70 mEq 더 많다. 새로 만든 HCO−
3의 일부는 비휘발성 산을 중화하느라 소모된 것을 보충하며, 나머지는 소모된 다른 염기(A−
)를 재생성하는 데에 쓰인다.
이로써 콩팥은 혈중 중탄산염 농도 및 다른 완충계를 이루는 성분의 농도를 일정하게 유지한다. 호흡계통은 이상의 반응에서 만들어진 CO
2를 배출하여 혈중 이산화탄소 분압을 일정하게 유지한다.[12]
호흡계통과 콩팥은 서로 보완·보상한다. 예컨대 호흡계통의 기능에 문제가 생겨서 가 증가하면 콩팥이 HCO−
3 생성을 늘린다. 이러한 콩팥보상 덕택에 헨더슨-하셀바흐 방정식의 분모가 변할 때 분자가 같은 방향으로 따라 변화하므로 pH 변화가 완화된다. 반대로 콩팥에 이상이 생겨서 가 감소하면 호흡보상이 일어나 호흡이 가빠져서 가 감소하게 된다.[14]
스튜어트 접근법
[편집]

가 측정되지 않은 강한 음이온을 나타낸다.
인체의 방어선은 체액의 pH를 일정하게 유지한다. 전통적인 관점에 따르면, 그 값이 하필 7.4인 까닭은 헨더슨-하셀바흐 방정식에서 와 의 비가 20:1이기 때문이다.[31] 그런데 등수소이온농도 원칙(isohydric principle)에 따르면 어떤 완충계에 대해서도 같은 꼴의 수식을 도출할 수 있으므로, HCO−
3와 CO
2의 농도비가 예컨대 HPO2−
4와 H
2PO−
4의 농도비보다 특별히 더 중요하다고 볼 까닭은 없다.[16][21]
미국 생리학자 피터 스튜어트는 등의 변수란 반드시 다른 요인에 의해 결정되는 종속변인이라고 강조하며, 독립변수를 중심으로 체액의 산-염기 상태를 이해하자고 제안했다. 온도와 각종 평형 상수를 제외하면 세 가지 독립변수가 있다.[16][21][33][34]
- 이산화탄소 분압. 전통적인 관점과 같이 호흡계통에 의해 조절된다고 간주된다.
- 비휘발성 약산 총량. 예컨대 혈중에 HA H+
+A−
라는 반응으로 정의되는 완충계가 있다면, 반응의 평형이 옮겨 감에 따라 HA와 A−
각각의 농도는 변할 수 있겠으나 질량 보존 법칙에 의해 둘의 합은 일정할 것이다. 주로 인산과 혈장 단백질, 특히 알부민이 기여한다고 생각되므로, 알부민 합성을 담당하는 간에 의해 조절된다고 볼 수 있다. - 강이온차이. 수용액에서 완전히 이온화하는 강한 전해질의 알짜 전하량, 즉 강한 양이온 전하량 총합과 강한 음이온 전하량 총합의 차이로 정의되며, 주로 콩팥에 의해 조절된다. 실제로 어떻게 계산해야 옳은지는 연구자마다 의견이 갈리곤 하나, 대개 다음처럼 구할 수 있다고 본다.
- 이들 구경꾼이온은 유입되거나 배출되지 않는 한 농도가 변할 일이 없으니 독립변수 구실을 한다는 것이다.
혈액의 산염기 상태를 바꿀 수 있는 요인은 오로지 이 셋뿐이며, , , 등은 모두 이들에 의해 결정되는 종속변수이다. 세 독립변수 가운데 앞의 두 가지는 역할을 쉽게 짐작할 수 있다. 이산화탄소 분압이 높아지거나 비휘발성 약산이 더해지면 체액이 산성화될 것이다. 세 번째 독립변수인 강이온차이가 체액의 pH에 영향을 주는 이치는 대강 다음과 같다. 전기 중성 원리(electroneutrality principle)에 따르면 혈중 양전하 총합과 음전하 총합은 서로 같아야 한다. 비휘발성 약산을 HA로 뭉뚱그려 생각하면 다음이 성립한다.
생리학적인 상황에서 , , 는 매우 작으므로, 근사적으로 다음이 성립한다.[21][33]
즉 강이온차이는 중탄산염 완충계와 그 밖의 다른 완충계의 평형에 제약을 부과한다. 이산화탄소 분압과 비휘발성 약산 총량이 일정할 때, 예컨대 HCl과 같은 강산이 유입되어 SID가 감소하면 약한 음이온의 총합은 적어져야만 한다. HCO−
3와 A−
가 '쥐어짜져서(squeezed)' 적어지면 이들 완충계의 평형 조건에 따라 H+
는 늘어나야만 한다. 혈액이 산성이 되는 것은 이처럼 강한 음이온인 Cl−
가 SID를 감소시키기 때문이다.[21][35]
스튜어트 접근법은 거센 논쟁의 대상이지만, 적어도 강이온차이 개념은 같은 현상을 바라보는 다른 방법이라고 해석할 수 있다.[36] 용액에 HCl과 같은 강산을 첨가하여 H+
와 Cl−
로 해리하면, H+
는 다른 분자와 반응하여 완충되지만 Cl−
는 반응하지 않고 남아 있다. 그러므로 짝염기 Cl−
는 강산 HCl이 첨가되었음을 알리는 '발자국(footprint)'이다.[37] 이처럼 강한 음이온과 양이온은 각각 강산과 강염기의 '발자국'이기 때문에[37], 전통적인 관점에서 보면 강이온차이란 첨가된 강산 총량과 강염기 총량의 차이를 반영하는 일종의 대리변수(surrogate variable)이다.[36][38][39] 첨가한 강산과 강염기의 양이 용액의 pH를 결정하는 요인인 것은 당연하므로, 강이온차이가 용액의 pH를 결정하는 독립변수라는 관점은 전통적인 산염기 생리학과 양립 가능하다.[39]
혈액의 완충 작용
[편집]산·염기와 완충용액의 화학
[편집]
2PO−
4의 짝염기 HPO2−
4가 H+
와 결합하여 중화하므로 H+
농도 변화가 완화된다.

가 H+
와 반응하여 물을 만들면 약산 H
2PO−
4가 해리하여 줄어든 H+
를 보충한다.
화학이 발전함에 따라 산과 염기의 정의도 여러 차례 변했다. 19세기에 스반테 아레니우스는 수용액에서 해리하여 수소 이온을 내놓는 물질이 산, 수산화 이온을 내놓는 물질이 염기라는 이른바 '아레니우스 산·염기 정의'를 제안했다. 이후 수산화 이온에 초점을 맞추기를 그치고 수소 이온을 주고받는 관계에 주목한 브뢴스테드-로우리 산염기 이론, 전자쌍 개념을 바탕으로 더 일반적으로 고친 루이스 산염기 이론 등이 등장했다.[16] 그러나 생체 내에서는 거의 대부분의 산-염기 반응이 수용액에서 일어나고, 루이스 산염기 정의가 포괄하고자 하는 예외 사례들은 거의 일어나지 않기에, 생리학·의학에서는 여전히 브뢴스테드-로우리 등 전통적인 산·염기 정의가 유용하게 쓰인다.[1][16][40][41]
수소 이온의 중요성을 인정하는 브뢴스테드-로우리 정의를 받아들인다면, 혈액이 수소 이온 농도 변화에 저항하는 원리를 밝히는 것이 중요한 문제가 된다. 이를 설명하는 화학 개념은 완충 용액으로, 수소 이온과 가역적으로 결합하는 물질로 이루어진 용액을 가리킨다.[1][28]
이 용액에 강산 HA를 첨가하면 H+
와 A−
로 이온화할 텐데, 해리되어 나온 수소 이온 가운데 일부는 과 결합하여 이 되므로 pH 변화가 완화된다. 이것이 완충 작용이다.
완충 작용이 일어나는 정도를 나타내는 척도로는 완충용량이 흔히 쓰인다. 완충용량은 용액의 pH를 1 올리기 위해 첨가해 주어야 하는 강염기의 양, 또는 pH를 1 떨어뜨리기 위해 필요한 강산의 양으로 정의된다. 완충 작용이 많이 일어날수록 pH를 같은 만큼 변화시키기 위해 강산·강염기를 더 많이 첨가하여야 하므로 완충용량이 크다.[28]
완충용량의 값은 여러 요인에 영향을 받는데, 한 가지는 각 화학종의 농도이다. 질량작용의 법칙에 따르면 화학 평형 상태에서 다음 식의 값은 온도에만 의존하는 상수이며, 이를 산 해리 상수라고 부른다.
생리학적인 상황에서 , 는 나노몰 단위이다. , 이 이보다 충분히 크기만 하다면, 농도가 같은 만큼 변하더라도 상대적인 변화율은 , 의 경우가 H+
보다 훨씬 작다. 과 을 변화시키기가 를 변화시키기보다 훨씬 쉬우므로, 강산을 첨가하여 생긴 H+
는 대부분 과 결합하여 제거된다. 이를 통해 및 이 많을수록 완충용량도 커짐을 알 수 있다.[28] 정량적으로 따져 보면 완충용량은 , 의 총량에 비례하며, 총량이 일정하면 두 화학종의 농도비가 1:1일 때 완충용량이 극대화된다. 산 해리 상수의 식을 참고하면 이는 곧 일 때와 같다. 혹은 라고 정의하면, pH가 pKa와 같을 때라고도 표현할 수 있다.[14][28]
중탄산염 완충계
[편집]
2CO
3를 만든다. H
2CO
3가 해리하여 만들어진 HCO−
3는 확산하여 도로 빠져나가고, H+
는 헤모글로빈에 의해 완충된다. 허파에서는 모든 과정의 역반응이 일어나, 알짜로는 조직에서 허파로 이산화탄소가 운반되는 셈이다.
중탄산염 완충계는 H
2CO
3―HCO−
3 쌍으로 이루어진 완충계이다. 세포외액에 H
2CO
3는 많지 않으며, 그 pKa 값도 혈액의 정상 pH와 제법 달라서 H
2CO
3와 HCO−
3의 농도 비는 보통 1:20이다. 그럼에도 중탄산염 완충계는 세포외액의 완충 작용에서 가장 중요한 역할을 담당하는데, 열린 계이기 때문이다. HCO−
3가 H+
를 제거하면서 H
2CO
3가 만들어지면, 혈액에 그대로 남아 있는 것이 아니라 금세 이산화탄소가 되어 날숨으로 배출된다. 혈액이 알칼리화되는 변동이 일어나는 경우에도 마찬가지로 호흡을 통해 H
2CO
3가 쉽게 공급된다.[29] 이처럼 이산화탄소 농도가 외부 공기와 언제나 평형을 이루고 있기에 중탄산염 완충계의 완충 능력은 크게 향상되어, 닫힌 계를 가정했을 때에 비해 수십 배 증폭된다.[42]
물과 이산화탄소가 탄산을 만드는 반응 및 그 역반응은 매우 느려서 탄산무수화효소가 없으면 거의 일어나지 않는다.[29] 사람 몸에서 탄산무수화효소는 몇몇 부위에 풍부하게 존재하는데, 대표적으로 적혈구 세포질에 많다. 조직에서 세포 대사의 산물로 만들어진 이산화탄소는 확산을 통해 적혈구 세포질로 유입되는데, 조직에서와 달리 탄산무수화효소가 있으므로 탄산이 된다. 이산화탄소가 소모되어 세포 안팎의 이산화탄소 농도 기울기가 가파르기 때문에 확산이 활발히 일어날 수 있다. 반대로 이산화탄소가 적은 허파에서는 탄산무수화효소의 촉매 작용으로 탄산이 이산화탄소가 되어 날숨으로 빠져나간다. 적혈구는 이처럼 일종의 '이산화탄소 싱크(sink)' 구실을 하면서 조직과 허파 사이에서 이산화탄소를 옮겨나른다(shuttling).[14]
다른 완충계
[편집]혈중 비-중탄산염 완충계의 완충용량 총합은 대략 30 mEq/L/(pH 단위) 정도로 추산되며[42][43][44], 이 중 적어도 50% 이상이 적혈구의 헤모글로빈 덕택인 것으로 보인다.[43][45] 헤모글로빈이 H+
를 중화하는 반응을 보통 다음처럼 나타낸다.[29]
하지만 헤모글로빈 분자에는 완충 작용을 하는 잔기가 여러 개 있기 때문에, 헤모글로빈 한 분자는 H+
여러 분자를 중화할 수 있다. 이 덕택에 농도가 2-3 mM에 지나지 않는데도[주해 1] 완충용량이 그토록 큰 것이다.[46] 한편 혈액이 아니라 온몸의 체액 전체를 따진다면, 그 완충 용량의 60-70 %는 세포내액의 완충 능력에서 비롯한다. 이는 대부분 세포 안에 풍부하게 존재하는 단백질 덕택이다. 그런데 H+
나 HCO−
3는 세포막을 가로질러 확산하기가 어렵기 때문에, 세포 내 완충 작용이 세포외액에 영향을 미치려면 적어도 수 시간은 걸리기 마련이다. 다만 헤모글로빈만은 특별하다. 상술하였듯이 적혈구 세포질에는 탄산무수화효소가 있기 때문이다. 세포외액에 산이 유입되면 H+
가 아니라 CO
2가 적혈구 세포질로 곧장 확산하여 들어오고, 탄산무수화효소의 촉매로 H+
와 HCO−
3를 만든다. 이로써 적혈구 안에서 이루어지는 헤모글로빈의 완충 작용이 세포외액까지 빠르게 영향을 미친다.[14][29]
헤모글로빈 이외에 혈액의 완충 능력에 기여하는 주된 성분은 알부민과 글로불린을 비롯한 혈장 단백질로[42], 그 완충용량 총합은 약 7.7 mEq/L/(pH 단위)로 추산된 바 있다.[43] 알부민은 아미노산 곁사슬이 많이 있는 고분자 물질로, 분자 하나마다 해리 가능한 잔기가 200개 넘게 있는 다양성자 산이다.[33][47] 등전점이 약 4.7이므로 pH 7.4인 혈장에서는 알짜로 음전하를 띤다.[48] 곁사슬의 종류와 위치에 따라 산 해리 상수가 다른데, 대다수는 생리적인 pH 범위에서 완전히 해리된 채로 있어 구경꾼이온 구실을 한다. 다만 한 분자에 히스티딘 이미다졸 잔기가 16개씩 있어 그 덕택에 완충 작용을 나타낸다. 이미다졸 잔기는 pKa 값이 6.75로 7.4에 비교적 가까워 pH에 따라 수소 이온을 받기도 하고 내어주기도 하기 때문이다.[33][49] 한 연구에서는 알부민의 질량당 완충용량을 0.1204 mEq/g/(pH 단위)로 계산하였다. 혈장 알부민 농도가 4.4 g/dL이라면 그 완충용량은 도합 5.3 mEq/L/(pH 단위)이다. 여기에 더해 혈장 글로불린이 2.8 g/dL 농도로 존재한다면 그 완충용량은 약 2.1 mEq/L/(pH 단위)로 계산되어, 합하면 상기한 값 7.7 mEq/L/(pH 단위)와 거의 비슷해진다.[47]
혈장의 나머지 성분은 완충 작용에 기여하는 정도가 훨씬 적다.[42] 인산염 완충계는 H
2PO−
4―HPO2−
4 쌍으로 이루어진 완충계이다.
pKa 값이 6.8로 혈액의 정상 pH인 7.4에 상당히 가깝지만, 세포외액 중 농도가 1 mM 정도밖에 되지 않아 완충 능력은 약하다.[29][47] 하지만 인산염 완충계는 세포내액 및 세뇨관을 흐르는 액체 속에서는 중요한 역할을 한다. 이들 액체는 인산염 농도가 훨씬 높고, 또 pH가 낮아 인산염 완충계의 pKa 값에 더욱 가깝기 때문이다.[29]
모형: 데이븐포트 그림과 염기과잉
[편집]
3 농도를 나타낸다. 우상향하는 곡선은 CO
2 분압에 대한 등치선으로, 중탄산염 완충계의 평형 조건을 나타낸다. 직선에 가까운 우하향 곡선은 완충선으로, 중탄산염 완충계를 제외한 나머지 완충계의 평형 조건을 나타낸다. 체액의 산염기 상태는 CO
2 등치선과 완충선이 만나는 지점으로 정해진다.

2 등치선의 변경으로 체액의 산염기 상태가 완충선을 따라 이동하는 것으로 표현된다.
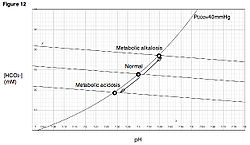
2 등치선을 따라 이동하는 것으로 표현된다.
여러 완충계가 함께 있는 혈액에서 완충 작용이 어떻게 일어나는지 이론적으로 따지기란 까다롭다. 중탄산염 완충계의 평형 조건을 나타내는 헨더슨-하셀바흐 방정식에는 pH, , 등 세 가지 미지수가 있다. 가 상수라고 하더라도 미지수가 두 개 남으므로 pH와 값은 다양한 조합으로 정해질 수 있다. 여러 조합 가운데 체액의 산염기 상태가 무엇으로 정해지는지 알려면 나머지 비-중탄산염 완충계의 평형 조건을 모두 연립하여 pH와 의 관계식을 도출하여야 한다.[32] 가로축에 pH, 세로축에 HCO−
3 농도를 나타낸 데이븐포트 그림(Davenport diagram)[32] 또는 산-염기 계산도표(acid-base nomogram)[50][51]를 활용하여 이 과정을 한결 쉽게 이해할 수 있다.
헨더슨-하셀바흐 방정식을 변형하면
이므로, 가 일정할 때 가능한 pH― 값의 조합들을 데이븐포트 그림에 나타내면 지수함수 꼴의 곡선을 이룬다. 이를 CO
2 등치선(isopleth)이라고 부른다. 이산화탄소 분압이 일정하게 유지되는 한, 체액의 산염기 상태가 어떻게 변동하든지 데이븐포트 그림에서는 CO
2 등치선을 따른 이동으로 나타내어질 수밖에 없다. 이산화탄소 분압이 변화하면 CO
2 등치선 자체가 이동한다. 즉 값마다 등치선이 한 종류씩 존재하는 셈이다.[32]
한편 비-중탄산염 완충계의 평형 조건 역시 데이븐포트 그림에서 어떠한 곡선으로 나타내어질 텐데, 이를 완충선(buffer line)이라고 부른다.[52] CO
2 등치선이 가 일정하게 유지되는 경우를 나타내는 것과 정반대로, 완충선은 오로지 만이 변화하는 경우를 나타낸다고 이해할 수 있다. CO
2 이외에 다른 물질이 출입하지 않는다면, 중탄산염 완충계 말고는 영향을 받을 이유가 없으니 평형 조건 역시 동일할 것이기 때문이다. 따라서 CO
2 분압만을 다양하게 변화시켜 가며 혈액의 pH 및 HCO−
3 농도가 어떻게 달라지는지 관찰하여 도표에 나타내면 이것이 바로 완충선이 된다. 이런 까닭에 완충선을 CO
2 평형화 곡선(CO
2 equilibration curve)이라고도 부른다.[43]
다른 물질의 출입 없이 만 변화하는 경우 완충염기(buffer base, BB)의 총량이 일정하게 유지된다.[43][53][54] 완충염기란 혈액에 산이 유입되었을 때 완충할 수 있는 짝염기를 통틀어 가리키는 말로, 혈중에 중탄산염 완충계 이외에 HA―A−
완충계만 있다고 가정하면 다음처럼 계산된다.[55]
스튜어트 접근법을 이용하면 이 값이 일정한 까닭을 쉽게 이해할 수 있는데, 상술하였듯이 전기 중성 원리에 따르면 이 값은 근사적으로 강이온차이 SID와 같다.[33] 물질 출입이 없다면 SID가 변할 일도 없으므로 BB의 값도 일정할 수밖에 없다. 따라서 완충선을 BB 또는 SID에 대한 등치선으로 이해할 수 있다. 이 조건으로부터 완충선의 수식을 이끌어내려면 를 pH에 대해 나타내어야 하는데, 실제로는 갖가지 다른 완충계가 함께 있을 것이므로 까다롭다. 완충선을 구하는 가장 정확한 방법은 실제로 환자의 혈액 표본을 채취하여 CO
2 평형화(CO
2 equilibration)를 통해 경험적으로 결정하는 것이지만[32][52], 이 역시 매우 번거로운 일이다. 따라서 임상에서는 와 pH의 관계에 대한 과거 관찰 결과를 토대로 완충선의 식을 귀납적으로 추정하곤 한다.[55]
혈중 비-중탄산염 완충계의 총 완충용량 β는 생리학적인 pH 범위에서 상당히 일정한 것으로 관찰된다.[32] pH 7.4, 24 mEq/L, 40 mmHg인 정상 상태와 비교하여 , , 의 변화량을 각각 , , 라고 하면
인데, β가 일정하다면
이다. 물질 출입 없이 만 변화하는 경우 이라고 하였으므로, 결국 다음을 얻는다.
이것이 pH 7.4, 24 mEq/L인 지점을 지나는 완충선의 수식이다.[주해 2] 한편 혈액에 비휘발성 산이나 염기가 더해지면 BB 및 SID의 값이 달라지므로 이라고 놓을 수 없고, 따라서 완충선 자체가 다음처럼 변경된다.[43][54]
이때 완충염기 BB의 값이 정상에서 벗어난 정도를 가리키는 를 염기과잉(base excess, BE)으로 정의한다.[55][주해 3]
이것이 일반적인 완충선의 식이다. 혈액 표본에서 pH와 를 측정하면 완충선 위의 한 점을 구할 수 있으므로, 기울기 β와 절편 BE 중 하나를 알면 완충선이 결정된다. 혈중 완충계의 조성을 바탕으로 β를 경험적으로 추정하는 것이 보통인데, 헤모글로빈 농도를 중요한 변인으로 간주하는 이른바 밴슬라이크 방정식(van Slyke equation)이 흔히 이용된다.[43][56][주해 4]
체액의 산염기 상태는 데이븐포트 그림에서 CO
2 등치선과 완충선이 만나는 지점으로 정해진다. 환기가 잦아서 이산화탄소 분압이 낮으면 CO
2 등치선이 오른쪽으로 이동하고, 환기가 뜸해서 이산화탄소 분압이 높으면 등치선이 왼쪽으로 이동한다. 한편 혈액에 비휘발성 산을 첨가하면 완충선이 아래로 내려가고 염기를 첨가하면 완충선이 위로 올라간다.[52] CO
2 등치선 및 완충선의 위치가 정상에서 벗어난 정도를 살핌으로써 체액의 산염기 상태를 따질 수 있다.[57] 물론 이는 혈액의 화학적 완충 작용만 감안한 것이다. 예컨대 가 낮은 상황에서 완충선이 아래로 이동하였다면, 비휘발성 산이 유입되었기 때문인지 아니면 변동에 대한 콩팥보상 때문인지 알 수 없다. 이처럼 데이븐포트 그림에서 드러난 산염기 변동이 정상적인 보상 반응인지 아니면 참으로 병적인 상황인지는 추가적인 판단이 필요하다.[57]
호흡계통의 역할
[편집]
호흡계통은 조직에서 끊임없이 만들어내는 이산화탄소를 환기를 통해 제거한다. 대사와 환기의 균형이 혈액의 이산화탄소 기체 분압을 결정한다. 대사가 활발하여 이산화탄소가 더 많이 만들어지면 이산화탄소 기체 분압이 증가하고, 반대로 호흡이 가빠져서 환기로 이산화탄소를 더 빨리 제거하게 되면 분압이 감소한다.[58] 그런데 호흡수는 이산화탄소 기체 분압에 반응해서 조절된다. 대사가 활발해지면 환기도 덩달아 빨라지므로 조직에 이산화탄소가 쌓이지 않고 그대로 제거된다.[59] 이러한 음성 되먹임에 의해 이산화탄소 기체 분압이 일정하게 유지되기 때문에 혈액의 중탄산염 완충계를 일정 압력의 기체와 평형을 이루고 있는 열린 계로 간주할 수 있고, 탄산으로 대사되는 각종 유기산을 휘발성 산이라고 부를 수 있는 것이다.
한편 호흡수는 혈중 H+
농도에 의해서도 조절된다. 세포 대사로 이산화탄소가 많이 생산되면 탄산의 해리 반응에 의해 H+
역시 많아지므로, H+
농도에 의한 환기 조절은 이산화탄소 분압의 균형을 이루는 데에 기여한다. 그런데 H+
농도는 다른 산·염기에 의해서도 변한다. 산을 섭취하여 H+
가 많아지면, 설령 대사량이 이전과 똑같더라도 호흡수가 증가하여 이산화탄소를 더 빠르게 제거한다. 혈중 이산화탄소 기체 분압이 감소하므로 H+
농도도 감소한다. 반대로 염기를 섭취하여 H+
가 적어지면 호흡이 느려져 이산화탄소 분압이 상승하고 H+
도 다시 많아진다. 이처럼 호흡계통은 혈중 H+
농도에 반응하여 환기를 통한 이산화탄소 제거 속도를 조절함으로써, 혈액의 완충계에 이어 사람의 산-염기 항상성을 유지하는 제2방어선 역할을 한다.[58]
호흡을 조절하여 H+
농도를 되돌리는 데에는 한계가 있다. 호흡보상의 효율은 보통 50-75 % 정도라고 보는데, 이를테면 산혈증으로 pH가 7.4에서 7.0으로 떨어지면 호흡을 빨리 해서 pH를 7.2-7.3 정도까지는 되돌릴 수 있다는 것이다. 알칼리혈증에 대한 호흡보상은 덜 효과적이다. 환기는 이산화탄소를 제거할 뿐만 아니라 산소를 공급하는 역할도 하기 때문에, 호흡이 가빠지기는 쉬워도 너무 느려져서는 위험하다. 따라서 pH가 증가하더라도 호흡수는 많이 감소하지 않는다.[58]
혈중 이산화탄소 기체 분압 및 H+
농도를 감지하여 호흡계통에 전달하는 것은 주로 호흡 중추의 화학감수성영역(chemosensitive area)이다. 숨뇌의 배쪽 표면 가까이에 좌우 각 한 무리씩 신경 세포가 모여 있어, H+
농도에 민감하게 반응하여 호흡 중추의 나머지 부위를 자극한다. 실제로 혈액에서 화학감수성영역을 더 효과적으로 자극하는 것은 H+
가 아니라 오히려 이산화탄소인데, 수소 이온은 혈액뇌장벽을 쉽게 넘나들지 못하는 반면 이산화탄소 기체는 자유롭게 확산하기 때문이다. 한편 목동맥토리·대동맥토리 등에 있는 말초 화학수용기도 부수적인 역할을 한다. 주로 산소 농도를 감지하는 데에 관여하지만 이산화탄소 및 H+
에도 반응하여 호흡 중추로 신호를 전달한다. 호흡을 조절하는 효과는 중추 화학감수성영역이 말초 화학수용기보다 훨씬 크지만, 빠르기로 따지면 말초 화학수용기의 반응이 다섯 배나 빠르다. 따라서 갑자기 운동을 시작할 때처럼 이산화탄소 분압이 급격하게 변할 때 기민하게 대응하도록 돕는 것으로 보인다.[58]
콩팥의 역할
[편집]콩팥은 오줌의 조성을 조절함으로써 산-염기 항상성을 유지한다. 산성 소변이 배설되면 체액에서 산이 제거되고, 염기성 소변이 배설되면 체액에서 염기가 제거된다. 보통 사람은 하루에 70-80 mEq 정도의 비휘발성 산을 섭취하는데, 호흡으로 제거하지 못하니 소변으로 내보내야 한다. 콩팥은 산성 소변을 내보내 하루에 70-80 mEq만큼 산을 제거함으로써 균형을 맞춘다. 또한 산혈증이 있으면 소변을 더욱 산성화하고, 반대로 알칼리혈증이 있으면 덜 산성화하거나 심지어 알칼리화하는 콩팥보상을 통해 혈액의 수소 이온 농도를 정상으로 되돌린다.[12][60]
콩팥이 소변의 산염기 상태를 조절하는 주된 분자 기제는 수소 이온 분비이다.[12][60] 토리에서 갓 여과한 액체는 혈액과 거의 조성이 비슷하여 중탄산염 농도가 약 24 mEq/L인 염기성 용액이다. 토리거름률이 정상이면 혈액이 하루에 약 180 L 걸러지므로, 중탄산염은 하루에 약 4320 mEq 여과된다. H+
를 그보다 많이 분비하면 알짜로 산을 배출하는 것이고, 그보다 적게 분비하면 염기를 잃어버리게 된다. 평상시에 산-염기 균형을 유지하려면 산 80 mEq를 배출해야 하니, H+
를 하루에 약 4400 mEq 분비하여야 한다. 이때 H+
4320 mEq만큼은 중탄산염을 적정하므로 소변 pH를 크게 변화시키지 않지만, 나머지 80 mEq는 만일 완충되지 않으면 pH를 급격하게 떨어뜨린다.[60] 소변 1.5 L에 H+
가 80 mEq 있으면 pH로는 1.3 정도에 해당한다.[12] 그런데 소변이 너무 산성이면 H+
가 세뇨관 밖으로 확산하기 시작하기 때문에 소변의 pH는 4.5 미만으로 떨어지기 어렵다. pH를 4.5 이상으로 유지하면서 H+
80 mEq를 배설하려면 하루에 소변을 최소한 2667 L 누어야 한다. 실제로 소변에는 인산염 등 완충계가 있어, 소변으로 분비한 H+
는 수용액 속을 자유롭게 돌아다니는 것이 아니라 예컨대 HPO2−
4와 결합하여 H2PO4-로 있다. 이로써 pH를 심하게 낮추지 않으면서 산을 다량 배설할 수 있다.[60]
| 수소 이온과 결합한 꼴로 존재하는 비율 (%) | |||
|---|---|---|---|
| pH | 인산염 (pKa = 6.8) | 요산염 (pKa = 5.8) | 크레아티닌 (pKa = 5.0) |
| 7.4 | 20.1 | 2.5 | 0.4 |
| 6.2 | 79.9 | 28.5 | 5.9 |
| 4.4 | 99.6 | 96.2 | 79.9 |
소변 속 완충계의 완충 능력은 각 완충계의 농도와 pKa 값, 그리고 소변의 pH에 따라서 달라진다. 인산염의 경우 다량 여과되었다가 대부분 재흡수되어 결과적으로 하루에 30-40 mEq/L 정도가 배설된다. 인산염 완충계의 pK 값은 6.8이므로, pH 7.4인 혈액에서는 20%가량이 HPO2−
4로 있는 반면, pH 6.2에서는 80%가 HPO2−
4로 존재한다. 즉 소변의 pH가 6.2가 될 때까지 H+
를 분비하면 인산염의 60%를 적정하게 된다. 소변을 더 산성화하면 pKa 값이 더 낮은 요산염과 크레아티닌이 주로 수소 이온을 적정하는 역할을 한다.[12][60]

또다른 중요한 성분은 암모늄이다. 혈중에는 거의 없지만, 세뇨관 벽 세포가 글루타민을 α-케토글루타르산으로 대사할 때 생성되어 소변으로 확산해 나가거나 능동수송으로 분비된다.[60] 이를 암모니아생성(ammoniagenesis)이라고 한다. 글루타민은 가장 흔한 비필수 아미노산으로 각종 음식에 풍부하게 들어 있다. 이처럼 기질이 풍부하기에, 암모니아생성은 필요에 따라 탄력적으로 조절되어 산 제거에 크게 기여할 수 있다.[61] 한 가지 이론적 문제는 암모니아-암모늄의 pKa 값이 9.2로 매우 높아서 혈액에서든 소변에서든 암모니아는 없고 암모늄밖에 없다는 점이다. 만들어질 때부터 모두 H+
와 결합하고 있어 H+
를 추가로 적정할 수 없는 암모늄이 무슨 수로 산 제거에 보탬이 되는지에 대해서는 논쟁이 있는데, 각 입장은 아래에 더 자세히 소개하였다.[7][62]
콩팥의 산염기 조절을 정량적으로 분석하는 지표는 알짜산배설량(net acid excretion, NAE)으로, 다음처럼 계산된다.
여기서 와 는 각각 소변을 통한 암모늄과 중탄산염의 배설량을 가리킨다. 암모늄을 배설할수록 산을 제거하는 것이고, 중탄산염을 배설할수록 염기를 잃어버리는 셈이다. 한편 는 적정산도(titratable acidity)로, 암모늄과 중탄산염 이외의 다른 완충계가 적정한 산의 양을 가리킨다. 소변의 pH가 7.4가 될 때까지 첨가해 주어야 하는 강염기의 양으로 측정할 수 있다. 암모늄은 pKa가 높아 해리하지 않으며, 따라서 암모늄의 양은 적정산도 계산에 포함되지 않는다. 평상시에 콩팥은 중탄산염을 대부분 재흡수하여 배설량은 0에 가깝다. 나머지 두 항인 적정산도와 암모늄 배설량은 항상성을 유지하기 위해 제거하여야 하는 산 80 mEq를 대략 40 mEq씩 나누어 맡는다.[60] 그런데 산혈증이 있어서 산을 더 많이 제거해야 하는 경우, 인산염 등은 여과되는 양 자체에 한계가 있으므로 적정산도가 크게 증가하기는 어렵다. 반면 암모늄 분비는 탄력적으로 조절되어 많게는 하루에 500 mEq까지도 늘어날 수 있다. 따라서 만성 산혈증 상황에서는 암모늄 분비가 콩팥의 산 제거에서 가장 큰 비중을 차지한다. 반대로 알칼리혈증이 있으면 암모늄 분비가 0에 가까워지고 중탄산염 분비가 늘어나 NAE가 음수가 되므로 알짜로 염기가 제거된다.[60][62]

2CO
3가 해리하면 HCO−
3와 H+
가 만들어진다. HCO−
3는 세포 바닥면의 통로를 통해 혈액으로 확산하여 나간다. H+
는 내강으로 분비되어 소변의 중탄산염을 적정하는 데에 쓰인다. 따라서 알짜로는 소변에서 혈액으로 중탄산염이 재흡수되는 셈이다.

중탄산염 중심 해석
[편집]생리학에서는 콩팥의 산염기 조절 작용을 흔히 수소 이온 배설, 중탄산염 재흡수, 그리고 중탄산염 생성으로 나누어 설명하는데, 따지고 보면 모두 수소 이온 분비라는 한 가지 기제에서 비롯하는 현상이다. 세뇨관 벽 세포로는 이산화탄소가 자유롭게 확산해 들어올 수 있으며, 이산화탄소가 용해하여 된 H
2CO
3는 세포 안의 탄산무수화효소에 의해 HCO−
3와 H+
로 해리한다. H+
를 세포 밖으로 분비해 없앨수록 반응의 평형이 치우치므로, HCO−
3도 많이 만들어져 세포 바닥면의 통로를 통해 확산하여 나간다. 따라서 H+
를 하나 분비할 때마다 중탄산염을 하나씩 얻는다. 분비한 H+
가 소변의 중탄산염을 적정하는 데 쓰이면 결과적으로는 소변에서 혈액으로 중탄산염을 재흡수하는 셈이다. 한편 다른 완충계가 수소 이온을 흡수하는 경우, 소변의 중탄산염은 변하지 않았는데 혈액에만 중탄산염이 많아지므로 중탄산염 생성이라고 보는 것이다.[60]
암모니아 생성의 역할
[편집]전통적으로 암모니아생성이 산 제거에 기여하는 것은 인산염 등 다른 완충계와 마찬가지 원리라고 간주되었다. 콩팥에서 만들어진 암모니아는 기체 상태로 소변으로 확산하여 나간다. 소변은 혈액보다 훨씬 산성이므로 암모니아는 즉시 암모늄이 된다. 기체인 암모니아와 달리 극성이 강한 이온인 암모늄은 세뇨관 벽을 쉽게 통과하지 못하므로 소변에 갇힌다. 이처럼 암모니아가 H+
와 결합하여 적정하기에 수소 이온이 배설되는 효과가 있다는 것이다.[7][60][62]
하지만 암모니아-암모늄의 pKa는 9.2로 너무 높아 98% 이상이 암모늄으로 존재하므로 완충 능력이 거의 없다. 더군다나 콩팥의 대사 과정에서 만들어지는 것은 암모니아 기체가 아니라 암모늄 이온이다. 다른 해석은 암모늄과 더불어 만들어지는 HCO−
3에 주목한다. 글루타민에서 아민을 떼어내면 카복시산 잔기가 남으므로 대사하여 HCO−
3를 만들 수 있다. 암모늄 하나를 분비할 때마다 HCO−
3를 하나씩 얻어 혈액의 H+
하나를 중화할 수 있으므로, 알짜로는 산이 제거되는 셈이다.[7][62]
또다른 견해는 간의 역할에 주목한다. 간에서는 아미노산을 분해하여 탄산수소 이온과 암모늄 이온을 하루에 약 1000 mEq씩 만든다.[주해 5] 콩팥에서 일어나는 아미노산 대사가 간에서 일어나는 반응과 다른 점은 암모늄이 몸 밖으로 분비된다는 것이다. 분비되지 않고 몸 안에 남은 암모늄은 요소로 대사되는데, 이때 HCO−
3가 소모된다.
그러므로 콩팥 암모니아생성이 산 제거에 기여할 수 있는 참된 이유는 HCO−
3를 소모하지 않으면서도 암모늄을 제거하는 방법을 제공하기 때문이다. 콩팥이 대사에 이용하는 글루타민 자체는 간에서 만들어져 유입된 것으로, α-케토글루타르산을 글루탐산염으로 대사할 때 수소 이온 하나가 만들어져 HCO−
3를 중화하였을 테니, 콩팥에서 만든 HCO−
3는 그저 잃어버렸다가 되찾은 것에 지나지 않는다. 간에서 만든 암모늄을 독성이 적은 형태로 콩팥까지 옮기려고 임시로 글루타민을 합성하는 것이다. 암모늄 하나를 분비할 때마다 알짜로 HCO−
3를 하나씩 얻는 것은 맞지만, 내막을 살펴보면 간의 요소 합성에 소모되는 양을 줄임으로써 나타나는 간접적인 효과이다.[62]
조절
[편집]콩팥은 체액의 산염기 상태에 따라 오줌의 조성을 조절함으로써 산염기 변동을 되돌린다. 산혈증이 있으면 H+
분비 및 암모니아생성을 늘림으로써 산을 많이 제거하고 중탄산염을 많이 만든다. 반대로 알칼리혈증이 있으면 H+
분비를 줄여 중탄산염이 재흡수되지 않고 그대로 빠져나가도록 하며, 암모늄 역시 분비하지 않는다. 이로써 염기를 제거한다.[63]
토리쪽곱슬세관 세포는 세뇨관 내강을 마주하는 꼭대기면의 수소 이온 운반 단백질 개수, 그리고 반대쪽인 바닥면의 중탄산염 운반 단백질 개수를 조절함으로써 H+
분비를 늘리거나 줄인다. 흥미롭게도 이러한 조절 기제는 pH가 아니라 중탄산염 완충계의 나머지 두 성분인 이산화탄소와 중탄산염 농도에 반응하는 것으로 보인다. 토리쪽곱슬세관 세포의 바닥면과 맞닿는 용액의 이산화탄소 분압이 높으면 외포작용이 활발하게 일어나 세포막에 이온 운반 단백질이 많아져 내강으로 H+
를 많이 분비하고, 이산화탄소 분압이 낮으면 반대로 운반 단백질이 덜 활성화되어 H+
를 적게 분비한다. 바닥쪽 표면과 맞닿는 용액의 중탄산염 농도가 낮거나 높은 경우에도 마찬가지이다.[64]
토리쪽곱슬세관 세포에서는 산염기 변동에 반응하여 암모니아생성도 조절한다. 이 경우 변화를 야기하는 것은 세포 내 pH 변화로, 세포내액이 산성화되면 암모니아생성에 관여하는 각종 효소의 활성이 증가한다. 미토콘드리아의 글루탐산분해효소가 활성화되면 글루타민이 암모늄과 글루탐산으로 분해되는 반응이 더 활발하게 일어난다. 포스포에놀파이루브산 카르복실레이스(PEPCK) 효소가 활성화되면 포도당신생합성이 촉진되어, 글루탐산 탈아미노화의 산물인 α-케토글루타르산을 포도당으로 전환하는 반응이 더 활발하게 일어난다. 이로써 산혈증 상황에서 암모늄 생성·분비가 촉진된다.[64]
한편 집합세관에는 A형과 B형 사이세포라는 두 종류 세포가 있다. A형 사이세포는 꼭대기면에 양성자 펌프가 있고 바닥면에 Cl−
-HCO−
3 교환체가 있어 내강으로 H+
를 분비한다. B형 사이세포는 꼭대기면과 바닥면의 이온 운반 단백질 분포가 이와 반대로 되어 있어 내강으로 HCO−
3를 분비한다. 산혈증이 만성적으로 지속되면 집합세관에 A형 사이세포가 늘고 B형 사이세포가 줄어 H+
분비가 촉진된다. 반대로 만성 알칼리혈증 상황에서는 B형 사이세포가 많아지고 A형 사이세포가 적어져 H+
분비가 억제되고 오히려 HCO−
3가 분비된다.[64]
스튜어트 해석
[편집]스튜어트 산염기 이론에서는 콩팥의 역할을 전혀 다르게 설명한다. 수소 이온과 탄산수소 이온은 다른 요인에 의해 농도가 결정되는 종속변인이므로, 콩팥이 H+
를 배출하거나 HCO−
3를 재흡수·생성함으로써 산염기 균형을 유지한다는 서술은 부적절하다.[33] 만일 세포막을 가로질러 이동하는 이온이 오로지 H+
뿐이라면, 막 안팎의 H+
농도가 변하는 것이 아니라 전하분리로 말미암아 막 전위가 변동할 것이다. 전하분리가 아주 조금만 더 일어나더라도 막 전위의 크기는 급격하게 증가한다. 따라서 막을 가로질러 일어나는 H+
의 이동은 전기적으로 중성이 되도록 다른 이온의 움직임을 동반하여야 한다. 막 안팎의 산염기 상태가 변화하는 것은 H+
의 이동 그 자체 때문이 아니라, 강한 이온이 H+
와 짝지어 움직이는 탓에 막 안팎의 강이온차이 SID가 변화하기 때문이다.[65]
콩팥이 산염기 항상성에 관여하는 기제는 그러므로 강한 이온의 출입을 조절하는 것일 수밖에 없다.[62][66] 체액보다 SID가 큰 소변을 내보내면 체액의 SID는 줄고, 체액보다 SID가 작은 소변을 내보내면 체액의 SID는 커진다. 콩팥은 강한 양이온을 재흡수하고 강한 음이온을 분비함으로써 소변의 SID를 줄여, 대사·음식 섭취 등으로 체액의 SID가 감소하는 것을 거슬러 항상성을 유지한다.[67] 또한 산혈증과 같은 변동이 있으면 소변 SID를 키워 체액 pH를 정상으로 되돌린다.[66][68]
스튜어트 이론의 해석에 따르면, 세뇨관 벽에 있는 갖가지 H+
및 HCO−
3 수송 단백질은 직접적으로든 간접적으로든 강한 이온을 함께 옮긴다.[68] 강한 음이온 없이 나트륨이나 칼륨 이온을 재흡수할 때마다, 혹은 강한 양이온 없이 염화 이온 하나를 분비할 때마다 소변 SID는 감소한다.[62][66] 예컨대 먼쪽곱슬세뇨관에서 H+
분비와 Na+
재흡수가 긴밀하게 연관되어 있다는 사실은 잘 알려졌으며[69], 소변의 산염기 상태가 변화하는 것은 바로 H+
와 짝지어 움직이는 Na+
때문이다.[70] 다만 Na+
는 체액 부피 항상성 조절과, K+
는 막 전위 항상성 조절과 깊이 엮여 있으므로, 산-염기 항상성을 유지하는 데에 가장 중요한 기제는 Cl−
의 출입 조절이리라고 추측하였다.[62][66][71] 암모니아생성이 중요한 것은 이런 까닭이다. 암모늄 이온 하나를 분비할 때마다 Na+
없이 Cl−
만 분비할 수 있기 때문이다.[68][72]
산-염기 장애
[편집]병인에 따른 분류
[편집]
산-염기 장애는 병인에 따라 크게 호흡성(respiratory)과 대사성(metabolic)으로 구분된다. 호흡성 산-염기 장애는 호흡 이상으로 이산화탄소 분압이 달라지는 바람에 생기는 이상을 가리키고, 대사성 산-염기 장애는 이산화탄소 분압 변화 이외의 요인으로 생기는 이상을 아울러 가리킨다. 변화의 방향에 따라 산증과 알칼리증이 구분되므로, 결국 산-염기 장애를 크게 호흡성 산증, 호흡성 알칼리증, 대사성 산증, 대사성 알칼리증으로 구분할 수 있다.[50]
이산화탄소 분압은 이론상 휘발성 산이 체내에서 지나치게 많이 혹은 적게 만들어지는 탓에 변화할 수도 있지만, 이런 경우는 드물다.[51] 대개 호흡계통이 환기로써 CO
2를 제거하는 기능에 문제가 있을 때 호흡성 산-염기 장애가 발생한다. 호흡 중추나 호흡계통에 질병이 생겨 환기가 방해를 받으면 CO
2를 제거하지 못하므로 호흡성 산증이 생긴다. 반대로 호흡성 알칼리증은 환기가 지나칠 때 생기는데, 정신 질환 등으로 과호흡을 하는 경우가 그 예이다.[50] 기계환기를 시행할 때에도 흔히 발생한다.[73] 호흡성 산염기 변동에 반응하여 항상성을 유지하는 기제는 혈액의 완충 작용과 콩팥보상이다. 이들의 작용으로 호흡성 산증에서는 HCO−
3 농도가 증가하고 호흡성 알칼리증에서는 HCO−
3 농도가 감소한다.[50][73]
대사성 산-염기 장애는 CO
2 분압 변화가 아닌 이유로 체액에 산·염기가 더해지거나 빠지는 경우를 가리키며[57], 헨더슨-하셀바흐 식을 중시하는 전통적인 견해에서는 HCO−
3가 과다하거나 모자라는 상태로 이해된다.[50][51][74] 대사성 산증은 메탄올 등 비휘발성 산을 과량 섭취하거나 설사 등으로 염기를 잃어버리는 경우, 당뇨병성 케톤산증 등으로 체내에서 비휘발성 산을 많이 생성하게 되는 경우, 콩팥요세관산증이나 만성콩팥병 등으로 콩팥의 산 제거 기능이 지장을 받는 경우에 발생할 수 있다. 반대로 대사성 알칼리증은 제산제 등 염기를 과량 섭취하거나 구토 등으로 산을 잃어버리는 경우, 또는 이뇨제 투여 등으로 말미암아 콩팥에서 산 제거 및 염기 재흡수가 지나치게 활성화되는 경우에 발생할 수 있다.[50][51] 대사성 산염기 변동에 반응하여 항상성을 유지하는 기제는 호흡보상으로, 대사성 산증에서는 환기가 활발히 일어나 CO
2 분압이 감소하고, 대사성 알칼리증에서는 환기가 뜸해져 CO
2 분압이 증가한다.[51] 물론 대사성 변동이 애초에 콩팥의 문제 때문에 생겼던 것이 아니라면, 콩팥보상 역시 대사성 산-염기 장애에 대응하는 데에 기여할 수 있다.[50][57]
산-염기 장애가 한 가지 병인으로 말미암은 것일 때 단순(simple)하다고 하며, 여러 병인이 함께 있으면 복합(mixed) 산-염기 장애라고 한다.[50][51] 그런데 산염기 변동이 일어나면 여러 보상 기제가 작동하는 것이 정상이기 때문에, 복합 산-염기 장애를 따지는 것은 다소 까다롭다. 분명한 것은 산혈증이나 알칼리혈증이 나타났다면 적어도 한 가지 산증이나 알칼리증이 있었을 테고, 그에 반응하여 일어난 보상 현상의 정도는 원인이 된 산염기 변동을 완전히 정상으로 되돌리기에 부족했으리라는 점이다. 따라서 가장 정도가 심한 산-염기 장애를 일차성(primary)이라고 부른다.[74] 나머지 변동 가운데 정상적인 보상 현상에 못 미치거나 그를 넘어서는 정도로 일어난 것을 가리켜 이차성(secondary)이라고 부르며[74], 단순한 보상이 아니라 참으로 이차성인 변동이 동반된 경우만 복합 산-염기 장애라고 일컫는다.[51]
코펜하겐 접근법: 대사성 장애의 척도
[편집]
2 등치선 및 완충선과 같은 특정한 곡선을 기준으로 생각하기보다는 오히려 그림처럼 넓은 영역을 기준으로 대강 판단하는 것이 더 합당하다고 본다. 그리고 도표보다 경험적 수식을 우선시해야 한다고 강조한다.[51]
환자의 산염기 상태를 평가하려면 무엇보다도 병력 청취와 진찰을 철저하게 하여 임상적 판단을 내려야 한다. 하지만 과거력만 가지고 산-염기 장애의 병인을 알아내기가 꼭 쉬운 일은 아니며, 특히 복합 산-염기 장애가 있으면 까다롭다.[75] 이런 경우 정량적으로 따지는 것이 도움이 된다. 호흡성 장애의 유무와 정도는 CO
2 분압으로 판단하면 되므로 간단하다. 대사성 장애를 평가하려면 비휘발성 산·염기가 많은지 적은지 알아내야 하는데, 갖가지 화학종의 농도를 모조리 측정할 수는 없으므로 간접적인 방법을 써야 한다. 전통적인 중탄산염 중심 접근법에서는 비휘발성 산을 중화하는 것이 주로 HCO−
3이므로 대략 HCO−
3가 정상보다 감소한 만큼 비휘발성 산이 유입되었다고 간주할 수 있다고 본다.[76]
물론 실제로는 중탄산염 완충계뿐만 아니라 혈액 속 다른 완충계도 산염기 변동을 중화하는 데에 기여한다. 더군다나 비휘발성 산·염기 출입 없이 CO
2 분압만 변하더라도, 중탄산염 완충계의 평형이 이동하기 때문에 HCO−
3 농도 역시 변하기 마련이다. 따라서 HCO−
3 감소량이 꼭 비휘발성 산 유입량을 나타낸다고 볼 수 없다. 덴마크 학자들은 이론적 모형으로써 CO
2 분압 및 다른 완충계의 영향을 보정하고 비휘발성 산의 출입량을 정확하게 평가하고자 하였다. 이들이 발전시킨 방법론을 코펜하겐 접근법(Copenhagen approach)이라고 부른다.[76]
코펜하겐 접근법의 이론적 배경에 대해서는 위에서도 기술하였으나, 다시 요약하면 이러하다. 혈액 속 완충계를 크게 중탄산염 완충계와 나머지로 나누어 생각할 때[57], 두 계의 평형 조건은 각각 헨더슨-하셀바흐 방정식과 밴슬라이크 방정식으로 표현된다.[43] pH를 가로축에, 를 세로축에 나타낸 데이븐포트 그림에서 두 수식은 각각 지수함수 꼴의 CO
2 등치선과 직선형의 완충선으로 나타내어지며, 체액의 산염기 상태는 두 곡선이 만나는 지점으로 정해진다.[32][43] 순수한 호흡성 산염기 변동은 오로지 중탄산염 완충계의 평형 조건에만 영향을 미치므로, 데이븐포트 그림에서 CO
2 등치선이 이동하는 것으로 표현된다. 혈중 CO
2 분압을 측정하면 등치선의 위치를 알 수 있고, 따라서 호흡성 산-염기 장애를 평가할 수 있다. 한편 순수한 대사성 산염기 변동은 나머지 완충계의 평형 조건에만 영향을 미치므로, 데이븐포트 그림에서 완충선이 이동하는 것으로 표현된다. 따라서 완충선의 세로 절편에 해당하는 염기과잉 값을 대사성 산-염기 장애의 척도로 삼는다.[57]
보스턴 접근법: 보상 반응에 대한 경험적 규칙
[편집]코펜하겐 학파의 모형에는 몇 가지 흠이 있다. 하나는 염기과잉 개념이 혈액만을 고려하여 만들어졌기 때문에, 혈액이 저보다 완충 능력이 낮은 조직 간질액과 평형을 이루고 있음을 간과한다는 것이다. 또 하나는 정상적인 보상 반응과 이차성 장애를 구분하지 못한다는 것이다. 미국 학자들은 이를 비판하며 이론적인 모형보다는 경험에 의존하자고 제안하였는데 이를 보스턴 접근법(Boston approach)이라고 부른다. 이들은 다양한 산-염기 장애 환자에서 보상 반응이 얼마나 일어나는지 관찰하여 규칙으로 정리하였다.[76] 규칙에 들어가는 수치가 정확히 얼마인지는 학자마다 조금씩 다르게 기술하곤 하지만, 대강 다음과 같다.[77][78]
- 대사성 산증에 대한 호흡보상: (윈터스 공식(Winters's formula))
- 대사성 알칼리증에 대한 호흡보상:
- 급성 호흡성 산증에 대한 대사성 보상: ("10 당 1씩 오른다")
- 만성 호흡성 산증에 대한 대사성 보상: ("10 당 4씩 오른다")
- 급성 호흡성 알칼리증에 대한 대사성 보상: ("10 당 2씩 내린다")
- 만성 호흡성 알칼리증에 대한 대사성 보상: ("10 당 5씩 내린다")
이러한 비판에 맞서 코펜하겐 학파에서는 조직 사이질과의 평형까지 고려한 표준염기과잉(standard base excess, SBE) 개념을 고안하였다. 조직 사이질의 세포외액 때문에 헤모글로빈이 '희석'된다고 간주하여 밴슬라이크 방정식의 에 실제 측정치보다 더 낮은 값을 대입하여 염기과잉을 계산한 값으로, 단순하게 계산한 염기과잉보다 믿을 만하다고 여겨져 임상에서 더 널리 쓰인다.[55] 코펜하겐 학파는 또한 표준염기과잉을 기준으로도 얼마든지 경험적 규칙을 도출할 수 있다고 응수하였다.[78][79][80]
- 대사성 산증에 대한 호흡보상:
- 대사성 알칼리증에 대한 호흡보상:
- 급성 호흡성 산-염기 장애에 대한 대사성 보상: (염기과잉 개념의 정의상 순수한 호흡성 장애에서는 변동하지 않음)
- 만성 호흡성 산-염기 장애에 대한 대사성 보상:
스튜어트 접근법: 비휘발성 약산의 역할
[편집]스튜어트 이론은 전통적인 관점에서 크게 벗어나는 만큼 산-염기 장애를 이해하는 방식 역시 사뭇 다르다. 쟁점이 많지만[16][23][68], 스튜어트 접근법의 한 가지 중요한 특징은 비휘발성 약산을 중요하게 여긴다는 것이다.[21] 기존 산염기 생리학에서는 혈액 pH의 값 자체보다는 그 변화에 주목하였으므로, 알부민·인산 등 혈장의 비휘발성 약산은 완충능력이 헤모글로빈에 비해 미미하기 때문에 산-염기 항상성을 이해하는 데에 덜 중요하다고 보았다.[42] 반면 스튜어트 이론에서는 비휘발성 약산 자체가 혈액을 산성화한다고 강조한다. 예컨대 pH 7.4인 혈장에 알부민이 4.4 g/dL의 농도로 존재할 때 그 전하량 총합은 약 -10 ~ -13 mEq/L에 이르는 것으로 추산된다.[35][47][68] 강이온차이가 일정할 때, 알부민 농도가 높아지면 음전하가 많아지므로 HCO−
3는 '쥐어짜져서' 적어지고 혈액은 산성화될 것이다.[35] 반대로 알부민이 적어지면 이러한 효과가 덜해지므로 혈액이 알칼리화될 것이다.[68]
| 분류 | 호흡성 | 대사성 | |||
|---|---|---|---|---|---|
| 이상 변인 | SID | ATOT | |||
| 수분[주해 6] | 강이온 | 알부민 | 인산염 | ||
| 산증 | CO 2 과다 | 수분 과다 | Cl− 또는 기타 음이온 과다 | 고알부민혈증 | 고인산혈증 |
| 알칼리증 | CO 2 부족 | 탈수 | Cl− 부족 | 저알부민혈증 | |
일부 학자는 스튜어트 이론에서 대사와 관련된 독립변수가 강이온차이 SID와 비휘발성 약산 총량 ATOT 두 가지이므로, 각 변인의 증감에 따라 대사성 산-염기 장애를 네 가지로 구분하자고 제안하였다. 이 관점에 따르면 기존에 분류했던 대사성 산증·알칼리증은 SID가 감소·증가하는 경우에 해당한다. 여기에 더해 고알부민혈증이나 고인산혈증 등 ATOT이 증가해서 생기는 대사성 산증이 있고, 저알부민혈증 등 ATOT이 감소해서 생기는 대사성 알칼리증이 있다.[81][82][83] 특히 중환자들에게서는 저알부민혈증이 흔히 나타나므로, 알부민 감소로 인한 알칼리증을 고려하지 않으면 통상적인 대사성 산증이 함께 발병했을 때 제대로 알아보기 어렵다고 주장하였다.[35][82]
전통적인 중탄산염 중심 접근법을 지지하는 학자들은 혈장 단백질이나 인산 농도의 변화를 산염기 현상으로 보아서는 안 된다고 반론했다.[84] 인체에서는 pH가 정상인데 약산 농도와 강이온차이가 둘 다 변화해 있는 경우가 흔히 보인다.[33] 이를 스튜어트 이론에 맞추어 “저알부민혈증으로 대사성 알칼리증이 발생했고, 이에 대한 반응으로 SID가 감소하여 보상적 대사성 산증이 함께 나타났다.”는 식으로 설명할 수도 있겠지만, 적절한 해석인지는 의문의 여지가 있다.[84] 예컨대 콩팥증후군 때문에 알부민과 강한 양이온이 짝을 지어 대량으로 소실된 경우, SID와 ATOT이 둘 다 감소하겠지만 이를 산염기 변동이라고 부르기는 어려워 보인다.[85]
전통적인 관점과 스튜어트 관점을 가르는 핵심 쟁점은 생체에서 혈장 pH를 정상으로 되돌리기 위해 조절되는 독립변수가 SID인지 ATOT인지 하는 문제이다. 시험관에서라면 둘 중 어느 것이든 조작할 수 있겠지만, 생체에서는 SID가 콩팥에 의해 빠르게 조절되는 반면 알부민 농도는 간에 의해 느리게 (기껏해야 하루에 약 0.1 g/dL만큼) 조절된다. 그러므로 저알부민혈증이 있는데 SID 값은 정상인과 비슷해서 알칼리증이 나타난 환자가 있다면, 간이 알부민 농도를 잘못 조절해서가 아니라 콩팥이 충분히 보상 작용을 하지 못해서 산-염기 장애가 발생했다고 보는 편이 합당하다.[86] 스튜어트 이론의 지지자 가운데 일부는 이러한 지적을 반영하여, SID의 정상 값이 상황에 따라 달라질 수 있다고 인정한다. 저알부민혈증 등으로 ATOT이 감소하면 SID가 따라 감소해서 pH를 일정하게 유지하는 것이 정상이며, 실제 SID가 새로운 정상 값에서 벗어난 정도인 야말로 참으로 대사성 산-염기 장애의 척도이다.[85][86][87] 이렇게 정의한 는 코펜하겐 학파의 염기과잉과 같은 개념이 된다.[85][86]
다만 해석의 차이가 있을지언정, 비휘발성 약산의 증감이 어떤 식으로든 체액의 산염기 균형에 영향을 미친다는 스튜어트 이론의 통찰은 틀림없는 사실이다. 간의 알부민 합성 기능을 산-염기 항상성 기제로 보기 어렵다고 하더라도, 저알부민혈증은 간 질환에서 나타나는 산염기 변동을 이해할 때 고려해야 할 중요한 요인 가운데 하나이다.[88][89] 또 설령 전통적인 방식을 따라 산-염기 장애를 평가한다고 하더라도, 대사성 산-염기 장애의 원인과 정도를 정확히 파악하려면 결국 알부민 농도를 감안하여야 한다.[37][90][91]
역사
[편집]
혈액의 산염기 성질
[편집]물질 가운데 산성인 것과 염기성인 것이 존재한다는 사실은 고대에도 알려져 있었다. 산(라틴어: acidus→시다)은 신맛을 내는 물질로 정의되었고, 알칼리(아랍어: اَلْقِلْي→재)는 산의 작용을 거슬러 중화할 수 있는 물질로 생각되었다. 산과 알칼리의 개념이 생리학·의학에 영향을 미치기 시작한 것은 16세기부터였다. 화학이 연금술과 구별되는 독자적인 학문 분과로 갈라지면서 파라켈수스 등 의화학(iatrochemistry)을 내세우는 사람들이 나타났다.[17] 이들은 전통적인 갈레노스 의학에 맞서 다양한 주장을 새롭게 내놓았다. 예컨대 소화를 열 때문에 음식물이 익는 과정으로 간주한 통설에 반대하여, 음식물이 산성 위액을 만나 일종의 발효가 일어나는 것이 소화라고 보았다. 의화학자들에게 소화 이론은 생명 현상을 화학 반응으로 설명하는 한 가지 틀을 제공해 주었다. 얀 밥티스타 판 헬몬트는 모든 물질이 산 아니면 알칼리이며 화학적·생리학적 과정이란 대개 산-알칼리 반응으로 말미암아 일어난다고 주장했다. 17세기 의화학자들은 판 헬몬트의 이론을 널리 받아들여 산과 알칼리의 관점에서 건강과 질병을 바라보았다.[92] 이를테면 프란시스퀴스 실비우스는 질병이란 모두 산이나 알칼리의 과잉 때문에 생기는 것이며, 반대 성질을 띠는 약물을 투여함으로써 교정할 수 있다고 생각했다.[93]
의화학자들은 위액을 비롯하여 각종 체액의 산-알칼리 성질을 밝히려고 했다.[94] 특히 이들은 갈레노스 의학의 사체액설을 대체할 이론을 마련하고자 했으므로 혈액의 화학적 조성을 규명하는 일을 중요하게 여겼다.[95] 로버트 보일은 혈액을 증류하여 알칼리 성분을 추출했다고 기술했고[95][주해 8], 이 성분이 생리학적으로 중요한 역할을 할지도 모른다고 추측했다.[94] 의화학자들로부터 이어진 노력의 결실로, 19세기에 이르러 혈액의 알칼리성은 화학계에서 널리 알려진 사실로 자리 잡았다.[27][96] 이와 더불어 혈액이 산·염기를 중화하는 능력이 매우 뛰어나다는 사실 또한 밝혀졌는데, 이 무렵의 산·염기 이론은 정의가 다소 모호하였으므로 연구 결과를 올바로 해석하기가 어려웠다. 예컨대 용액의 '산성도'를 지시약의 색이 바뀔 때까지 첨가해 주어야 하는 염기의 양으로 측정하곤 했다. 이처럼 산·염기의 세기와 양이 잘 구분되지 않았기 때문에, 산이든 염기든 효과적으로 중화하는 혈액의 성질은 한동안 수수께끼였다.[27]

한편 산과 염기가 만나 물과 염을 만든다는 도식[97]은 수용액에서 산·염기·염이 어떤 상태로 있는지 이해하기 어렵게 만들었다. 19세기에 혈액을 이루는 유기물이 차례로 규명되었던 반면 무기 화합물의 혈중 조성과 역할에 대한 연구는 진전이 늦었다. 혈액 속 무기 화합물은 염으로 존재한다고 생각되었으므로 '포타시(칼리, 영어: potash)', '소다(영어: soda)' 등으로 불리고 측정되었다. 스반테 아레니우스가 수용액에서 염이 해리하는 이치를 밝힌 공로로 1903년에 노벨 화학상을 받고서부터야 이온과 전해질의 개념을 바탕으로 혈액의 산염기 성질을 설명하려는 시도가 탄력을 받기 시작했다.[15]

산염기 생리학의 태동
[편집]아레니우스는 자신의 이온화 이론에 입각하여 수용액에서 수소 이온을 내놓는 물질이 산, 수산화 이온을 내놓는 물질이 염기라고 정의했다.[17] 이로써 산·염기의 세기 개념이 양 개념과 어떻게 서로 다른지 해명할 수 있었다. 쉽게 해리하여 이온을 많이 내놓을수록 강한 산·염기이고, 잘 이온화하지 않아 수소 이온을 적게 내놓을수록 약한 산·염기라는 것이다.[15] 아레니우스의 이론에 고무된 학자들이 수소전극으로 혈액의 이온 조성을 측정해 본 결과, 혈액이 실제로는 수소 이온과 수산화 이온이 거의 같은 농도로 존재하여 중성에 상당히 가까운 용액이라는 사실이 밝혀졌다.[27]
| “ | 일부 드문 예외를 빼면, 혈액을 비롯하여 동물의 체액은 산이든 염기든 대량으로 중화하여 중성을 유지하는 비상한 능력이 있다. 이는 산-염기 평형과 관련하여 가장 중요하고 또 틀림없이 가장 놀라운 성질이다. | ” |
— 로런스 조지프 헨더슨, 《Das Gleichgewicht zwischen Basen und Säern im Tierischen Organismus》(1909)[98] | ||

19세기 말 세포대사 과정에서 황산·인산·탄산·젖산 등이 만들어진다는 사실이 실험으로 확인되었다.[27] 그럼에도 혈액이 중성을 유지하는 원리가 무엇인지 다양한 추론이 이어졌다. 한 가지 가설은 혈액 속 단백질이 산·염기와 결합하여 중화한다는 것이었다. 한편 중탄산염 완충계도 후보로 주목 받았다. 이전부터 약산의 염이 강산의 작용을 완화하는 현상이 알려져 있었고, 20세기 초에는 중탄산염 용액을 탄산으로 포화시키면 마치 혈액처럼 산성도 변화에 저항한다는 사실이 밝혀졌다. 산이 많으면 중탄산나트륨이 중화하고 염기가 많으면 탄산이 중화하는 식으로 혈액의 중성이 유지된다는 가설이 제기되었다.[99] 갖가지 관찰과 추측을 종합하여 완충용액의 이론으로 아우른 사람은 하버드 대학교의 생화학자 로런스 조지프 헨더슨이었다.[17] 헨더슨은 처음에 인산 나트륨 용액이 중성을 유지하는 성질에 관심이 있었으나, 이후 약산과 그 염으로 이루어진 용액이라면 무엇이든 같은 원리로 설명할 수 있음을 깨달았다. 그는 화학 평형에 대한 질량작용의 법칙을 바탕으로 용액의 수소 이온 농도가 산과 염의 농도 비에 의존한다는 수식을 이끌어냈다. 용액에 다른 산이나 염기를 첨가하더라도 이 농도 비가 비교적 일정하기에 용액의 중성이 유지된다는 것이 완충 작용에 대한 헨더슨의 설명이었다.[15][100]
헨더슨은 이어서 서로 다른 여러 완충계가 함께 존재하는 용액의 경우를 고찰하여, 완충계가 한 종류만 있는 용액보다 더 효율적으로 중성을 유지함을 밝혔다.[101] 이러한 연구 끝에 헨더슨은 혈액의 완충 작용이야말로 생체가 산염기 변동에 대응하는 제1방어선이라고 결론 지었다. 이때 혈액의 여러 완충계 가운데 가장 중요한 것은 중탄산염 완충계, 버금가는 것은 인산염 완충계이며, 그 밖에 헤모글로빈 등 단백질이 부수적으로 기여한다고 보았다.[15][17][101]
완충용액이 제아무리 효과적으로 산염기 변동에 저항한들, 부족한 성분을 보충하고 축적된 성분을 제거하지 않으면 완충 능력은 언젠가 바닥나기 마련이다. 헨더슨이 완충용액의 이론을 정립하던 무렵, 혈액의 장기적인 산-염기 항상성에 허파와 콩팥이 중요하다는 사실은 잘 알려져 있었다.[98][101] 내부 환경(프랑스어: milieu intérieur)의 개념을 창안한 생리학자 클로드 베르나르는 일찍이 허파와 콩팥의 역할을 인지했던 학자 중 하나로[17][102], 동물 실험을 통해 식단에 따라 소변의 산성도가 변화함을 관찰하였다.[102][103][104]
| “ | 산이나 알칼리가 지나치게 많을 때 이를 제거하여 혈액을 언제나 알칼리성으로 유지해 주는 것은 바로 콩팥이다. 콩팥을 비롯한 분비 기관들은 혈액의 항상성을 유지하는 위대한 균형자(great equilibrator)이다. | ” |
— 클로드 베르나르[105] |
한편 헨더슨과 동시대에 활동한 영국 생리학자 존 스콧 홀데인은 호흡수를 조절하는 기제에 관심을 기울였다. 그는 호흡이 혈액의 pH 및 산소 분압을 정상으로 유지하는 방향으로 조절된다고 결론 지었다.[17][106] 20세기 초에 이루어진 초창기 연구 가운데는 오늘날의 기준에서 볼 때 모호하거나 세부사항이 부정확한 것도 더러 있었으나, 이 무렵 산염기 생리학의 주요 쟁점이 모두 확립되었다는 것은 틀림없다.[98]
추정과 측정: 대사성 산-염기 장애를 평가하다
[편집]헨더슨이 산-염기 생리학의 기틀을 닦기는 했지만, 임상적 응용이 곧바로 이어졌던 것은 아니다. 임상에서 쓸 만한 간단한 개념적 도구도, 실제로 혈액의 산-염기 상태를 평가할 기술도 부족했기 때문이다.[15][107] 1909년 쇠렌 쇠렌센은 pH를 정의했고, 1916년 카를 알베르트 하셀바흐는 헨더슨의 수식 양변의 상용로그를 취하여 오늘날 잘 알려진 꼴의 헨더슨-하셀바흐 방정식을 얻었다. 하셀바흐와 동료 학자들은 최초로 혈액의 pH를 정확하게 측정하는 성취를 이루었는데, 이는 기술적으로 상당히 어려운 일이었다. 당시 수소 전극을 가지고 혈액의 pH를 재려면 산소를 모두 제거한 다음 수소 기체로 포화시키는 과정을 거쳐야 했다. 당시 한 논문에서는 “전기적 측정에 의한 pH 결정은 궁극적인 기준이 되는 방법이지만, 물자·시간·경험이 너무나 많이 필요하기에 보통은 생리학 연구에서만 쓰게 된다.”고 언급했다.[107]

1920년대 이후 반 세기 동안 산-염기 생리학의 이론 및 방법론에 주도적으로 기여한 학자는 도널드 밴슬라이크였다.[15][107] 그는 혈액에서 방출된 기체의 압력을 효과적으로 측정하는 “밴슬라이크 압력 측정 장치(manometric Van Slyke apparatus)“를 개발했다. 각종 기체를 연구할 수 있었는데, 한 가지 쓰임새는 혈중 탄산수소 이온 농도를 측정하는 것이었다. 혈액에 산을 첨가해 HCO−
3가 H
2CO
3으로 전환되도록 하면서 방출되어 나오는 이산화탄소 기체의 총량을 측정하면, 혈중 HCO−
3 및 H
2CO
3 농도의 합을 알 수 있었다. 생리학적인 상황에서 HCO−
3는 H
2CO
3보다 20배 많기 때문에, 밴슬라이크 장치로 측정한 이산화탄소 총량(total CO
2)은 혈중 HCO−
3 농도와 대략 일치하게 된다.[15][96] 밴슬라이크는 HCO−
3 농도가 높은지 낮은지만 가지고 대사성 알칼리증과 대사성 산증을 판단하더라도 대강은 들어맞을 것이라고 제안했다. 만일 그렇다면 어렵게 pH를 측정하지 않고서도 대사성 산-염기 장애를 진단할 수 있었던 것이다.[108][109][110] 밴슬라이크 장치를 이용한 진단법은 근사적이고 간접적이기는 했지만 사실상 실제로 사용 가능한 유일한 방법이었으므로, 1960년경까지 거의 모든 생리학 및 임상의학 실험실의 표준으로 자리를 지켰다.[15][107]
밴슬라이크는 한편으로 pH 측정 없이도 산-염기 상태를 평가하는 다양한 방법을 고안했지만, 또 한편으로는 pH를 추정하는 방법도 고민했다. 헨더슨-하셀바흐 방정식을 이용하면 와 값으로부터 pH를 셈할 수 있으니 를 함께 측정하면 되었겠지만 기술적으로 어려웠다.[107] 어림 방법을 찾기 위해 밴슬라이크는 값을 이미 알고 있는 여러 다른 기체와 혈액이 차례로 평형을 이루도록 하면서 pH와 의 변화를 관찰하였고, 그 결과 pH와 사이에 거의 선형인 관계가 성립함을 확인했다.[주해 9] 이로써 밴슬라이크 장치를 통한 측정만으로 혈중 이산화탄소 분압과 pH까지 추정할 수 있게 되었다.[주해 10] 이후 존 퍼넷 피터스(John Punnett Peters)는 pH― 관계보다 ― 관계가 더욱 선형에 가깝다고 지적했다.[112] 이 관계식을 가지고도 유사하게 외삽법으로 pH를 추정할 수 있다.[113]

혈액의 pH를 간접적으로 추정하지 않고 직접 측정하는 것은 유리 전극 기술이 발달하고 나서 가능해졌다. 용액에 얇은 유리 막을 집어넣었을 때 전위차가 발생하며 그 크기는 막 안팎의 산 농도차에 비례한다는 사실이 1906년에 보고되었고, 1909년에는 프리츠 하버와 지그문트 클레멘세비치(폴란드어: Zygmunt Klemensiewicz)가 유리 전극을 만들어 그 효과를 시험했다. 1930년대에 이르러 혈액의 pH를 측정하기 위한 유리 전극이 제작되어 판매되기 시작했다. 이후 검체가 식거나 데워지면 pH도 달라지기 때문에 이를 보정해야 한다는 의견이 대두하여[주해 11], 1950년대 중반에 이르면 온도의 영향을 보정한 pH 값을 보고하는 유리 전극이 상업적으로 판매되었다.[96][107][114]
| “ | 개체의 산-염기 상태는 다음 값에 의해 하나로 결정된다. 첫째, 동맥혈의 실제 pH. 둘째, 동맥혈의 실제 pCO 2, 즉 호흡 성분. 셋째, 호흡을 제외한 요인을 반영하는 양. 세 번째에 해당하는 값으로는 혈청 CO 2 총량이나 CO 2 결합능력이 쓰이곤 한다. 하지만 이들은 모두 시료의 pCO 2와 산소 포화도에 따라 달라지므로 부적합하다. | ” |
— Jørgensen & Astrup, 《Standard Bicarbonate, its Clinical Significance, and a new Method for its Determination》(1957)[115] | ||
유리 전극이 통용되고 혈액의 pH를 측정하기가 한결 쉬워지면서 주목 받기 시작한 한 가지 문제는 대사성 산-염기 장애의 척도를 찾는 일이었다. 공기 중 이산화탄소 분압이 변하면 곧 환자의 산-염기 상태가 변하니, 이것을 호흡성 산-염기 장애로 정의하자는 데에는 모두 동의했다. 그렇다면 호흡을 제외한 나머지 요인만을 따졌을 때 산-염기 상태가 어떠한지를 평가하는 가장 적절한 방법을 찾으려고 다양한 시도가 이어졌다.[16] 일찍이 하셀바흐는 혈액의 를 40 mmHg로 맞춘 상태에서 측정한 pH인 “환원 pH(reduced pH)”를 후보로 제안했지만, 측정이 어려워 널리 받아들여지지 않았던 것으로 보인다.[107] 밴슬라이크는 실용적인 이유로 를 기준으로 삼았지만, 가 변하면 도 변하므로 단순하게 판단하는 것이 부정확함을 잘 알았다.[109] 따라서 다양한 다른 척도를 내세웠는데, 이를테면 pH를 7.4로 맞춘 상태에서 측정한 를 “알칼리 예비력(alkali reserve)”으로 정의했다.[107]
하지만 기술적·이론적 발전이 이루어지는 동안에도 임상에서 환자의 동맥혈을 채취하는 일은 흔치 않았으며 혈액의 pH를 측정하려는 시도조차 드물었다. 상황이 뒤바뀐 계기는 1952년 덴마크 코펜하겐에 발발한 심각한 소아마비 유행이었다.[107]
1952년 소아마비 유행과 코펜하겐 접근법의 발전
[편집]
1952년 코펜하겐에 닥친 소아마비 유행으로 10월부터 12월 사이에만 3천여 명의 환자가 입원했다. 대부분 블레그담 병원(덴마크어: Blegdamshospitalet)에 입원했는데, 이 가운데 3백여 명이 호흡마비 증세를 보였다. 환자들의 혈액에서는 이산화탄소 총량이 높아져 있었다. 를 대략 대사성 산-염기 이상의 척도로 보던 관행에 따르면 이는 원인 미상의 대사성 알칼리증을 시사했다. 마취과 의사 비외른 입센은 오히려 호흡성 산증 때문에 이산화탄소 총량이 증가했다고 추론하였고, 감염병 중앙 실험실 총책임자였던 폴 아스트럽(덴마크어: Poul Astrup)은 pH를 측정하여 이를 확증했다. 입센이 기관절개술로 인공 환기를 실시하자 이산화탄소 총량은 곧 감소했다.[107][116][117][118]
| “ | 폴 아스트럽 교수는 코펜하겐 블레그담 병원의 소아마비 환자들에게 환기를 시행해 주겠노라고 자원했다고 말했다. 호흡 장치는 수동이었으며, 앉아서 펌프질을 하면서 그는 다음과 같은 고민을 했다. “너무 빠른가, 너무 느린가, 아니면 꼭 알맞게 하고 있나? 궁금증에 대한 쉬운 해답을 어디서 얻을 수 있을까? 환자의 상황을 수 시간 뒤가 아니라 지금 당장 알아야 하는데.” | ” |
— J. Kofstad, "100 years of blood gas and acid base analysis in clinical medicine" (2012)[119] | ||
아스트럽은 환자들의 산-염기 상태와 호흡 상태를 정확히 평가할 필요를 느꼈다. 그는 먼저 ― 관계뿐만 아니라 pH― 관계 역시 선형임을 확인했다. 그런 다음 밴슬라이크와 피터스 등이 발전시킨 외삽법을 변형하여, 가 저마다 다른 기체와 혈액이 평형을 이루도록 한 다음 유리 전극으로 pH를 측정함으로써 미지 시료의 를 추정하는 방법을 고안하였다. 이렇게 해서 환자들이 호흡을 통해 이산화탄소를 적절하게 제거하고 있는지 평가하고 필요에 따라 인공환기 속도를 조절할 수 있었다.[107][117]
아스트럽은 소아마비 유행을 극복한 데서 그치지 않고 산-염기 장애를 평가하는 새로운 도구를 마련하고자 하였다. 그는 용액에 강염기나 강산을 첨가하면 pH― 관계를 나타내는 직선 자체가 평행이동한다는 사실을 관찰했다.[118] 밴슬라이크의 완충선이 정상 위치에서 얼마나 벗어나 있는지야말로 호흡을 뺀 나머지 요인만을 반영한 산-염기 상태의 척도가 되어 줄 수 있었다. 이에 착안하여 아스트럽과 올레 시고르-안데르센(덴마크어: Ole Siggaard-Andersen)은 혈액의 를 40 mmHg로 맞춘 상태에서 pH를 7.40으로 되돌리기 위해 첨가해 주어야 하는 강산의 양을 염기과잉으로 정의하였다.[16][43][118] 20세기 중반까지 대사성 산-염기 상태의 척도로 제안되었던 숱한 후보 가운데 오늘날까지 살아남아 임상에서 널리 쓰이는 것은 사실상 염기과잉뿐이다.[80]
물론 임상에서 실제로 중화 적정을 실시하기는 번거로우므로, 시고르-안데르센은 정의와 별개로 혈액에서 측정 가능한 변수만 가지고 염기과잉 값을 계산할 수 있는 공식을 연구해 내세웠다.[120] 이때 pH― 완충선의 기울기를 구한 밴슬라이크의 연구 결과를 활용했으므로, 시고르-안데르센은 이를 밴슬라이크 방정식이라고 부르자고 제안했다. 이제 혈액의 산-염기 상태는 헨더슨-하셀바흐 방정식과 밴슬라이크 방정식이라는 두 가지 수식에 의해 결정된다고 말할 수 있었다.[43][118]
횡대서양 산염기 대논쟁
[편집]1960년대 초에 덴마크 학자들은 산염기 방법론을 빠르게 발전시켜 널리 알렸다. 이 무렵에 “코펜하겐 학파”라는 이름이 등장했으며, 환자의 산-염기 상태를 평가하기 위해 검사를 맡기는 것을 단순히 “아스트럽”이라고 표현하는 경우도 있었다.[119] 1963년 시고르-안데르센은 pH, , 헤모글로빈 측정값을 가지고 염기과잉 값을 계산하도록 도와주는 계산도표를 고안했다. 도표에 자를 가져다대어 봄으로써 염기과잉 값이 헤모글로빈 수치에만 의존하고 와 무관함을 한눈에 알아볼 수 있었다. 시고르-안데르센의 정렬 계산도표(Siggaard-Andersen alignment nomogram)는 곧 임상 및 교육 현장에서 널리 쓰이게 되었다.[107]
| “ | pH, pCO2, 혈장 탄산수소 이온 농도를 측정하는 전통적인 방법은 여전히 산-염기 장애를 분석할 때 가장 믿을 만한 생화학적 지침이다. 일차성 호흡성·대사성 장애에 대한 보통 환자의 예상 반응을 알고, 적절한 임상 정보와 이러한 측정 값을 함께 고려하면, 가장 복잡한 산-염기 장애조차도 합리적으로 평가할 수 있다. | ” |
— Schwartz & Relman, 〈A Critique of the Parameters Used in the Evaluation of Acid-Base Disorders — Whole-Blood Buffer Base and Standard Bicarbonate Compared with Blood pH and Plasma Bicarbonate Concentration〉(1963)[76] | ||
코펜하겐 접근법이 전세계적으로 알려짐에 따라 이를 비판하는 연구도 속속 발표되었다.[119] 1963년 보스턴 터프츠 대학교의 내과의사였던 윌리엄 슈바르츠와 아놀드 렐만은 코펜하겐 접근법을 두 가지 측면에서 거세게 비판했다.[121] 첫 번째 비판은 생체 내에서 혈액은 완충 능력이 상대적으로 떨어지는 간질액과 맞닿아 있으므로, 혈액만 분리하여 시험관 내에서 산염기 성질을 평가해서는 안 된다는 것이었다. 두 번째 비판은 호흡성 산염기 장애가 만성적으로 지속되는 경우에 대사성 보상이 일어나는데, 염기과잉 계산에서는 정상적인 보상이 별도의 대사성 산염기 장애처럼 다루어지므로 부적절하다는 것이었다.[16][80] 이들은 대신 정상적인 보상 반응의 정도를 경험적으로 관찰함으로써 도출한 6가지 간단한 규칙을 사용해서 산-염기 장애를 평가하자고 제안했다.[77] 보스턴 방법에 따르면 이러한 규칙으로 계산된 정상적인 보상 반응을 고려하고도 남는 만큼의 이산화탄소·탄산수소 이온 농도 변화만이 산-염기 장애라고 간주된다.[80]

'코펜하겐 학파'와 '보스턴 학파'의 대립은 횡대서양 산염기 대논쟁(great trans-atlantic acid base debate)이라고 불렸다.[122] 두 학파는 염기과잉 개념의 유용성, 이론과 경험의 중요성 등을 놓고 첨예하게 맞섰다. 한 예로 1962년 어느 세미나에서 아놀드 렐만이 산염기 장애의 처치에 대해 발표하다가, 그 자신은 어떤 치료법을 쓰느냐는 질문을 받고서 “환자에게 무엇인가 줘 보고 무엇이 일어나는지 지켜본다”고 답했다. 그러자 이론적 접근을 중시하던 폴 아스트럽이 격분하여 연단에 뛰어올라 마이크를 가로채고 렐만에 반대하는 장광설을 펼쳤다.[107]
이처럼 격렬하게 이어지던 논쟁을 중재하려는 시도가 없었던 것은 아니다. 코펜하겐 학파의 학자들은 표준염기과잉 수치를 기반으로 보스턴 학파와 비슷하게 경험적 규칙을 도출하기도 했고[79][80], 시고르-안데르센의 정렬 계산도표에 보스턴 학파의 규칙을 반영하여 개선한 도표를 선보이면서 “데탕트”를 제의하기도 했다.[123] 그러나 두 학파의 견해차는 여전히 이어지고 있다.[124] 오늘날 두 학파 가운데 어느 쪽이 우세한지는 분명하지 않다. 의료기기와 교과서에서 염기과잉 개념을 활용하지 않는 경우가 많으니 보스턴 학파의 경험적 접근이 우세해졌다고 보는 입장이 있는가 하면[16][80], 혈액 기체분석 장치는 여전히 대부분 염기과잉 값을 계산해 주어 임상 현장에서 널리 활용된다는 보고도 있다.[24][125]
스튜어트의 물리화학적 접근
[편집]
1980년대에 캐나다의 생리학자 피터 스튜어트는 중탄산염 중심의 전통적인 접근법이 불만족스럽다고 느끼고, 산-염기 생리학을 새롭게 이해하는 방법을 고안했다.[19] 독립변수인 이산화탄소 분압 , 비휘발성 약산 총량 ATOT, 강이온차이 SID의 값이 주어지면 체액의 산염기 상태는 다음 6가지 방정식에 의해 하나로 결정된다.
- 물의 자동 이온화 반응(H2O H+
+OH−
)의 평형 조건: . - 탄산 해리 반응의 평형 조건, 즉 헨더슨-하셀바흐 방정식: .
- 탄산수소 이온 해리 반응(HCO−
3 H+
+CO2−
3)의 평형 조건: . 이 반응은 사실상 무시할 수 있는 것으로 간주된다. - 비휘발성 약산 전체를 HA로 뭉뚱그려 생각할 수 있다고 했을 때, 그 해리 반응(HA H+
+A−
)의 평형 조건: . - 비휘발성 약산 전체의 질량 보존 법칙: . 이 값은 물질의 출입에 의해 변할 뿐 반응이 진행함에 따라 변하지는 않는 상수이다.
- 전기 중성 원리: .
모두 연립하면

![{\displaystyle K={\frac {[{\ce {H+}}][{\ce {HCO3-}}]}{s\cdot P_{{\ce {CO2}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f65d3658960f8596de87146465bec9c900c3685c)


![{\displaystyle {\textrm {pH}}={\textrm {p}}K+\log \left({\frac {[{\ce {HCO3-}}]}{s\cdot P_{{\ce {CO2}}}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cff1012a4f2da67b8514e1861ceb9bf0b6191d05)


![{\displaystyle {\rm {[HCO_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1bda2ec0f1f506b6e14c99a9010b187afec6bf17)




![{\displaystyle [{\ce {CO2}}]=s\cdot P_{{\ce {CO2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef165af257822168a771c7bd8984c871b160c43e)
![{\displaystyle {\textrm {pH}}={\textrm {p}}K+\log \left({\frac {[{\ce {HCO3-}}]}{s\cdot P_{{\ce {CO2}}}}}\right)={\textrm {p}}K_{a}+\log \left({\frac {[{\ce {HPO4^{2-}}}]}{[{\ce {H_2PO4-}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18bb555543e88af3f57c51eb8e64e3bc0a711164)

![{\displaystyle \mathrm {SID} =([{\ce {Na+}}]+[{\ce {K+}}]+[{\ce {Ca^2+}}]+[{\ce {Mg^2+}}])-([{\ce {Cl-}}]+[{\text{젖 산 }}^{-}]+[{\text{기 타 강 한 음 이 온 }}^{-}])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e028de2b6770e2f7fe5d072bf62ca436937adcae)
![{\displaystyle {\ce {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)
![{\displaystyle {\ce {[ OH- ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47ec603f73c7358a2cb0ed5c6f06a98872b67428)
![{\displaystyle [{\rm {HCO_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb25f5bed761c45155b75d66993174fd3c451e96)
![{\displaystyle {\rm {SID+[H^{+}]-[HCO_{3}^{-}]-[CO_{3}^{2-}]-[A^{-}]-[OH^{-}]=0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50741795f624fc9f096b747517ce2c8dedd3c683)
![{\displaystyle {\ce {[ CO3^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebfc4cb858171a74ff86026e3bf5753e7d6924fd)
![{\displaystyle {\rm {SID=[HCO_{3}^{-}]+[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4af7c623e57cbcf004cde6807d1ad3d6858a1c47)




![{\displaystyle K_{a}={\frac {[{\rm {{H}^{+}][{\rm {{B}^{(n)}]}}}}}{[{\rm {{HB}^{(n+1)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39d209345dbb72e22b176784bee8c88e79414680)
![{\displaystyle [{\rm {{HB}^{(n+1)}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc4795c3e081cbdd18713f15903783297ce1576b)
![{\displaystyle [{\rm {{B}^{(n)}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/931826ed24d8611164386783d9171ebbe31c68a5)
![{\displaystyle [{\textrm {H}}^{+}]=K_{a}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87fa2a27792f8ce7e5f9ff72db1205a29c60fb41)



![{\displaystyle [{\ce {HCO3-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c8aba00eb9617fb3aaa72a8540542626c371a0a)

![{\displaystyle [{\ce {HCO3-}}]=s\cdot P_{{\ce {CO2}}}\cdot 10^{{\textrm {pH}}-{\textrm {p}}K}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c9f2b60633c0bf8388b25e6f4313bcbbb3e3219)
![{\displaystyle {\rm {BB=[HCO_{3}^{-}]+[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2921b7735326a786c32843de876bf587f75e4a66)
![{\displaystyle {\rm {[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b203f58db0a108fd5f7589dc2c9def073568749a)


![{\displaystyle {\rm {{\mathit {\Delta }}[HCO_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a480d8571242f34269c7e284e88a45d454b4b9c0)
![{\displaystyle {\rm {{\mathit {\Delta }}[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d81089519e95a7a7cab8031d9261e2c1f29b769a)
![{\displaystyle {\rm {{\mathit {\Delta }}(BB)={\mathit {\Delta }}[HCO_{3}^{-}]+{\mathit {\Delta }}[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/509dcc3e1ff1376ac78733f35c6dcedf0737af5d)
![{\displaystyle {\rm {{\mathit {\Delta }}(BB)={\mathit {\Delta }}[HCO_{3}^{-}]+\beta \cdot {\mathit {\Delta }}(pH)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14ce5e80ecbf2017d8ac0a409748ef0078222742)

![{\displaystyle {\rm {{\mathit {\Delta }}[HCO_{3}^{-}]=-\beta \cdot {\mathit {\Delta }}(pH)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a722c7f156c099d3225f6390a649c6001dd5635)
![{\displaystyle {\rm {{\mathit {\Delta }}[HCO_{3}^{-}]=-\beta \cdot {\mathit {\Delta }}(pH)+{\mathit {\Delta }}(BB)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/363591bd119ec93798cb5a1f5e0a7ab153ac555c)
![{\displaystyle {\rm {{\mathit {\Delta }}[HCO_{3}^{-}]=-\beta \cdot {\mathit {\Delta }}(pH)+BE}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3934eeed01c53683bfeea29f14159f9545054638)
![{\displaystyle {\rm {{\mathit {\Delta }}[HCO_{3}^{-}]=-(2.3\times [Hb]+7.7)\cdot {\mathit {\Delta }}(pH)+{\frac {BE}{1-0.023\times [Hb]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12fb4d3e61fdded7d960df7be54d19d08e65bcb7)






![{\displaystyle P_{{\ce {CO2}}}=1.5\times [{\ce {HCO3-}}]+8}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85a87f83ec06a9c748656ba85eb5fc8d144a92c2)
![{\displaystyle P_{{\ce {CO2}}}=0.7\times [{\ce {HCO3-}}]+21}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ef8915a1bb368fe514fac05f43bccf3f9c93a98)
![{\displaystyle [{\ce {HCO3-}}]=24+\left(P_{{\ce {CO2}}}-40\right)\times {\frac {1}{10}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b87a3b2c5e623a90051ddbe7634c549341b04cd)
![{\displaystyle [{\ce {HCO3-}}]=24+\left(P_{{\ce {CO2}}}-40\right)\times {\frac {4}{10}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/560f913ff27a22741143986f94d7e088214abd3f)
![{\displaystyle [{\ce {HCO3-}}]=24-\left(P_{{\ce {CO2}}}-40\right)\times {\frac {2}{10}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0815a55fba2cabc4f67dd308f451382b1ef278d5)
![{\displaystyle [{\ce {HCO3-}}]=24-\left(P_{{\ce {CO2}}}-40\right)\times {\frac {5}{10}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82ca0704d751a8eea75aa61bc22004571ed7e91d)
![{\displaystyle {\rm {[Hb]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8fce9c136239a64b01e70bf5fb025d64e50f8f5)






![{\displaystyle {\rm {\log[HCO_{3}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c8e1af36559f2c144b2c9e7c1f357480d5bce34)
![{\displaystyle [{\textrm {H}}^{+}][{\textrm {OH}}^{-}]={K_{w}}'}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73439fc4c3344d5ac1008e63d2dfbadb02c32c5c)
![{\displaystyle [{\textrm {H}}^{+}][{\textrm {HCO}}_{3}^{-}]=10^{-6.1}\times 0.03\times P_{\rm {{CO}_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29251b4633a0972389a48e3747519a45530f0dfa)
![{\displaystyle [{\textrm {H}}^{+}][{\textrm {CO}}_{3}^{2-}]=K_{c}[{\textrm {HCO}}_{3}^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c37f0f57b28108c3b8d2f6fb4b18f084acc8d75)
![{\displaystyle [{\textrm {H}}^{+}][{\textrm {A}}^{-}]=K_{\rm {A}}[{\rm {{HA}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81010e23ac235a0b0e248757dc8ca60da941049a)
![{\displaystyle {\rm {[HA]+[A^{-}]=A_{TOT}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/42038adfdd4e36bb0a5ab496299819e10ffbc480)