酸(さん、英: acid)は、化学において、水素イオンを与える、または電子対を受け取る性質をもつ物質である。塩基と対になってはたらく。
一般に、プロトン(H+)を与える、または電子対を受け取る物質である。歴史上、概念の拡大を伴いながら、幾つかの定義が考えられた。
酸・塩基は相対的な概念である。ある物質に対する酸が、他の物質に対して塩基であることが多い。例えば、水はアンモニアに対して酸である(H+を与える)が、塩化水素に対して塩基である(H+を奪う)。


ただし、日常的に「酸」といえば、水に対する酸を意味するため、その場合にて水は「中性の物質」といえる。
酸としてはたらく性質を酸性(さんせい)という[1]。酸の強さは、一般に酸性度定数 Ka またはその負の常用対数 pKa によって定量的に表される。酸解離定数の大きい酸を強酸、小さい酸を弱酸と呼ぶ。純硫酸より強い酸を、特に超酸(超強酸)と呼ぶことがある。
酸性水溶液は、pHを7未満とし、一般に酸味を呈する。酸のなかには、硝酸や硫酸、三酸化硫黄など、酸化反応でできるものがある。
酸は、文脈によって「求電子剤」「求電子性」とも言及される。
以下に、それぞれの定義を概略のみ述べる。
- アレニウス酸 (Arrhenius acid)
- アレニウスの定義による酸。水溶液中においてプロトン (
 ) を出す物質。下式において、塩化水素 (HCl) はアレニウス酸としてはたらいている。
) を出す物質。下式において、塩化水素 (HCl) はアレニウス酸としてはたらいている。 
- ブレンステッド酸 (Brønsted acid)
- ブレンステッド-ローリーの定義による酸。反応する相手「B」に対しプロトンを与える物質。下式の反応で「AH」、あるいは「A+H」がブレンステッド酸。


- ルイス酸 (Lewis acid)
- ルイスの定義による酸。電子対を受け取る物質。下式の反応で「A」がルイス酸。
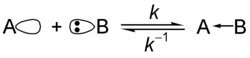
酸の1分子中に含まれる水素原子のうち、金属原子で置き換えられる水素原子の数をその酸の塩基度といい、塩基度2以上の酸を多塩基酸と呼ぶ。
一塩基酸は中和反応において、一分子につきひとつのプロトンを出す。
(例:HA=一塩基酸):
 Ka
Ka
多塩基酸は中和反応でその塩基度の数だけプロトンを出すことができる。
(例:H2A=二塩基酸)
 Ka1
Ka1 Ka2
Ka2
ここで一般的にKa1 > Ka2となる。
多塩基酸の濃度分率は一般にα
![{\displaystyle \alpha _{\mathrm {H} _{n-i}\mathrm {A} ^{i-}}={{[\mathrm {H} ^{+}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}} \over {\displaystyle \sum _{i=0}^{n}{\Bigl (}[\mathrm {H} ^{+}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}}{\Bigr )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d018f7d83c84427afd3971242598c2a1a188683)
で求めることができる。
- 無機酸
- スルホン酸
- カルボン酸
- ビニル性カルボン酸
- 核酸

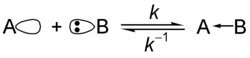






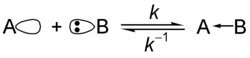



![{\displaystyle \alpha _{\mathrm {H} _{n-i}\mathrm {A} ^{i-}}={{[\mathrm {H} ^{+}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}} \over {\displaystyle \sum _{i=0}^{n}{\Bigl (}[\mathrm {H} ^{+}]^{n-i}\displaystyle \prod _{j=0}^{i}K_{j}}{\Bigr )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d018f7d83c84427afd3971242598c2a1a188683)