ベンゼン

| ベンゼン | |
|---|---|
 |  |
 |  |
benzene | |
別称 ベンゾール シクロヘキサ-1,3,5-トリエン | |
| 識別情報 | |
| CAS登録番号 | 71-43-2 |
| PubChem | 241 |
| ChemSpider | 236 |
| UNII | J64922108F |
| KEGG | C01407 |
| ChEBI | |
| ChEMBL | CHEMBL277500 |
| RTECS番号 | CY1400000 |
| |
| |
| 特性 | |
| 化学式 | C6H6 |
| モル質量 | 78.11 g mol−1 |
| 外観 | 無色透明の液体 |
| 密度 | 0.8765(20) g/cm3 [1] |
| 融点 | 5.5 °C, 279 K, 42 °F |
| 沸点 | 80.1 °C, 353 K, 176 °F |
| 水への溶解度 | 1.8 g/L (15 °C) [2][3][4] |
| 粘度 | 0.652 cP (20 °C) |
| 双極子モーメント | 0 D |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0015 |
| GHSピクトグラム |      |
| GHSシグナルワード | 危険(DANGER) |
| EU分類 | Carc. Cat. 1 Muta. Cat. 2 |
| 主な危険性 | 潜在的発がん物質 可燃性 |
| 経口摂取での危険性 | 高い |
| 呼吸器への危険性 | 高い |
| 眼への危険性 | 高い |
| 皮膚への危険性 | 高い |
| NFPA 704 | |
| Rフレーズ | R45 R46 R11 R36/38 R48/23/24/25 R65 |
| Sフレーズ | S53 S45 |
| 引火点 | -11 °C, 262 K |
| 発火点 | 562.22℃ (自然発火の条件下で) |
| 関連する物質 | |
| 関連物質 | トルエン ボラジン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |

ベンゼン(英: benzene)は、分子式 C6H6、分子量 78.11 の最も単純な芳香族炭化水素である。原油に含まれており、石油化学における基礎的化合物の1つである。分野によっては慣用としてドイツ語 (Benzol:ベンツォール) 風にベンゾールと呼ぶことがある。ベンジン(benzine、主として炭素数5 - 10の飽和炭化水素からなる混合物)とはまったく別の物質であるが、英語では異綴の同音異義語である。
化学的性質[編集]
構造および性質が類似する4物質、ベンゼン (Benzene)、トルエン (Toluene)、エチルベンゼン (Ethylbenzene)、キシレン (Xylene) の頭文字をとってBTEXと称されることがある。ベンゼン・トルエン・キシレンの3つをBTXとも呼ぶ。
ベンゼン環[編集]


6個の炭素原子が平面上に亀の甲(六角形)状に配置し、各炭素はsp2混成軌道をとっている。炭素原子間の結合距離は1.397 Åであり、C−C間の1.534 ÅとC=C間の1.337 Åの中間である。これは、全ての炭素同士の結合が等価になっていることを意味する。ケクレ構造式では交代する二重結合と単結合で表されているが、実際にはσ電子とπ電子が非局在化しているため、π電子は特定の結合に寄与していない。非局在化した電子は環の上下に環状のπ電子雲を形成する。ベンゼンが対称な構造をもつことは、この分子のσ電子とπ電子の相互作用による。よって、ベンゼンは平面構造を取る。非局在化していることを強調するためにベンゼン環を六角形の中に丸を書いた形(構造式右図)で表示することがある。
π電子が非局在化すると、単なる二重結合・単結合の並びに比べて安定性が高くなる。このようにπ電子を非局在化した環状炭化水素のうち、π電子が (4n+2) 個(6個、10個、14個、……)あるものはすべてのπ電子が結合性軌道に入るため特に安定性が高くなる。ベンゼン環を含む、このような安定した化合物を芳香族化合物と呼ぶ。
ベンゼン環はベンゼン核とも呼ばれるが、現在ではあまり一般的ではない。置換基となる場合はフェニル基 (phenyl group) と呼ばれる。
フェニル基の暗号としてはPhが用いられる。芳香族炭化水素の置換基はアリール基と呼ばれ、フェニル基はナフチル基と同様にアリール基に属する。
反応[編集]
構造式の見かけ上ベンゼンは二重結合を持つが、アルケンと異なり付加反応よりも置換反応の方が起こりやすい。
- 置換反応 - ハロゲン化(フッ素化、塩素化、臭素化、ヨウ素化。生成物の例: クロロベンゼン、ブロモベンゼン)、スルホン化(ベンゼンスルホン酸)、ニトロ化(ニトロベンゼン)、アルキル化、アセチル化
- 付加反応 - 紫外線を当てながら塩素 (Cl2) と反応させると、ベンゼンヘキサクロリド(略称 BHC、1,2,3,4,5,6-ヘキサクロロシクロヘキサン)が生成。水素 (H2) とも反応してシクロヘキサンを生成。
- 五酸化二バナジウム (V2O5) を触媒として酸化すると、開環反応を起こしマレイン酸が生成。
危険性[編集]
WHOの下部機関IARCより発癌性がある (Type1) と勧告されており、米国・カナダ・EU・オランダなど各国でも独自に人体影響を研究評価している[5]。日本でも大気汚染に係る環境基準が定められている。また1973年にはベンゼンから生ずる中毒の危害に対する保護に関する条約が発効した。なお、ムコン酸は、ヒトがベンゼンに曝露された時の指標とされる。ただし、ヒトがベンゼンに曝露されると、他にフェノール、カテコール、ヒドロキノンなども代謝産物として生ずることが知られている[6]。
代謝と毒性[編集]
代謝は肝臓で行われ代謝の中間産物としてフェノール、カテコール、ヒドロキノン等が生成され代謝産物が骨髄で毒性を発現する[7][8]。
健康被害と産業界への影響[編集]
1950年代、サンダル工場で接着作業に従事していた工員が継続的なベンゼンの吸入により、造血器系の傷害(白血病等)を受け死亡する事象が発生した。この事象を契機としてベンゼンの毒性・発癌性が問題視されるようになり、有機溶剤としては代替品で毒性の比較的低いトルエンやキシレンが使用されるようになった。しかし、これら代替溶剤は故意の吸入(いわゆるシンナー遊び)という、別の弊害を生むことになった。現在においても化学工業・理化学実験では使用が忌避される傾向にある。ベンゼン含有量を削減したガソリンなどがその代表例である。
2006年春以降英国などの諸外国で清涼飲料水からベンゼンが低濃度検出されることが公表され、10ppbを越える製品の自主回収が要請された。生成の原因は保存料である安息香酸と酸化防止剤であるビタミンCの反応によるもの、とされている。日本でも厚生労働省医薬食品局食品安全部が市販の清涼飲料水を調査し、1つの製品で70ppbを超える濃度が検出され、自主回収を要請した[9]。
地下水汚染[編集]
都市ガス製造時に生成しガス製造施設で高濃度のベンゼンによる土壌汚染[10]や地下水汚染[11]が公表されている。
製法[編集]
ベンゼンは炭素の豊富な素材が不完全燃焼すると生産される。自然界では火山噴火や森林火災でも発生し、タバコの主流煙・副流煙にも含まれる。
ベンゼンの工業的製造法には以下のものがある。
第二次世界大戦までは、製鉄産業においてコークスの副産物としてベンゼンが生産された。その後1950年代になると、特にプラスチック産業の成長によりベンゼンの需要は増大し、石油からベンゼンを生産することが求められた。今日ではベンゼンの9割以上は石油化学工業で生産され、石炭からの生産は相対的に少なくなった。
粗製ベンゼンの2016年度日本国内生産量は474,969t、工業消費量は227,755t、純ベンゼンの2016年度日本国内生産量は4,072,574t、工業消費量は1,957,946tである[12]。
石炭蒸し焼きによる一酸化炭素を主成分とする都市ガス製造過程でも、ベンゼンが生成する。このため、都市ガスを製造した工場跡地において、ベンゼンなどによる土壌汚染や地下水汚染が起こることがある。
- 接触改質 (catalytic reforming)
- 沸点が80–200℃の炭化水素の混合物を水素ガスと混合する。そして、塩化白金あるいは塩化ロジウム触媒と500–525℃、8–50atmで作用させる。この条件下では、脂肪族炭化水素は環を形成し、水素を失って芳香族炭化水素になる。反応生成物を蒸留、およびジエチレングリコールやスルホランなどによる溶媒抽出によって分離精製して純粋なベンゼンを得る。
- 水蒸気クラッキング (steam cracking)
- 脂肪族炭化水素からエチレンや他のオレフィンを生成する過程である。ナフサなどを原料とすると芳香族に富む分解ガソリンを副生する。これを蒸留および溶媒抽出によって分離精製して純粋なベンゼンを得る。
- トルエンの水素脱アルキル化 (toluene hydrodealkylation)
- トルエンを水素と混合させ、クロム、モリブデンまたは酸化白金触媒に500–600℃、40–60気圧で作用させる。場合によっては、触媒の代わりにより高い圧力が使用される。反応式を以下に示す。
- 通常、反応の収率は95%を超える。場合によってはトルエンの代わりにキシレンやもっと分子量の大きい芳香族化合物が使用されるが、変換効率は悪い。
- トルエンの不均化
- トルエン2分子の反応によってベンゼンとキシレンを生成する。トルエンと比較すると、ベンゼンとキシレンは化学原料としての需要が多いので経済的に成立するプロセスである。反応式を以下に示す。
この他に、アセチレン3分子から赤熱した鉄触媒(あるいは石英触媒)でも得ることができる(ヘキストワッカー法)。具体的には、赤熱させた鉄管もしくは石英管にアセチレンガスを通すと得られる。
用途[編集]
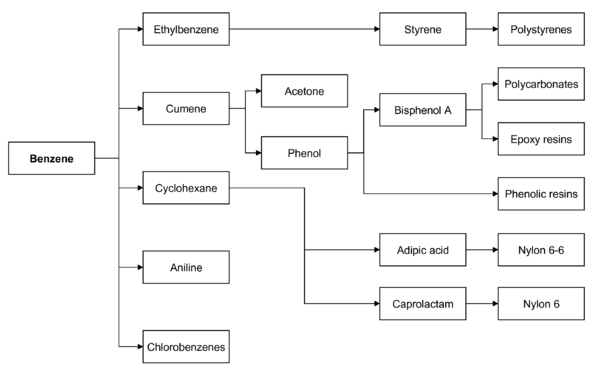
現在ベンゼンは他の化学物質を製造するための材料として利用されている。用途の大部分を占めるのが、プラスチック原料としてのスチレンや、樹脂や接着剤の原料としてのフェノール、ナイロン製造に用いるシクロヘキサンなどである。その他、ゴム、潤滑剤、色素、洗剤、医薬品、爆薬、殺虫剤などの製造に用いられている。
かつては強力な有機溶剤として利用され、特に金属部品からグリースを除くのに使われていた。またペンキはがし、染み抜き、ゴム糊などの家庭用製品にも広く使われていた。毒性が明らかになるにつれ、より毒性の少ないトルエンなどの他の溶剤に取って代わられた。日本では労働安全衛生法および特化則により溶剤としての利用は原則禁止されている。1950年代に四アルキル鉛に代わるまで、オクタン価を上げてノッキングを防ぐためガソリンに添加されていた。世界的に有鉛ガソリンが廃止される過程で、再びベンゼン添加が行われるようになった国もある。
歴史[編集]
1825年、ファラデーによって、鯨油を熱分解したときの生成物の中から初めて発見された[13][14]。
1833年、ミチェルリヒが安息香酸(benzoic acid)と生石灰を蒸留して得た物質にbenzinと名付けたのが名前の由来となった[15][16]。
1845年、アウグスト・ヴィルヘルム・フォン・ホフマンの下にいたCharles Mansfieldがコールタールからベンゼンを単離し、4年後に工業規模の製造を始めた。化学者の間では次第にベンゼンに関連する化合物が大きなグループを形成するという考えが醸成され、1855年にホフマンが芳香族という名称を付けることになる。
そして1865年にドイツの化学者アウグスト・ケクレによって、炭素原子からなる六員環構造をもち、各炭素原子に1つずつ水素原子が結合し、さらに、炭素原子間には単結合と二重結合が交互に配列した「ベンゼンの環状構造式」(ケクレ構造式)が提案された[17][18]。 ケクレはベンゼンの1置換体は常に1種類だけ生じ、一方2置換体は3種の異性体(オルト・メタ・パラ)が生じることを根拠にこの構造を提唱している。この構造は、ケクレが夢の中でヒントを得たとされている。猿が手を繋いでいたとか、蛇(ウロボロス)が自分の尻尾を噛んでぐるぐる回っていたなどといわれているが、その真偽については疑問が持たれている(詳細はケクレの項目を参照)。この構造(ケクレ構造)を持つ分子をケクレ分子という。

ケクレ以外にもデュワーやバンバーガーをはじめとして多くのベンゼン構造式が提唱されてきた。
これらのうち、デュワーのベンゼン式に相当する置換化合物(フォトピリドン (photopyridone) など)が発見されており、デュワー式に相当するベンゼンの類縁体の総称してデュワーベンゼンと呼称されることがある。ヘキサメチルデュワーベンゼンは市販もされている。
日本の法規制[編集]
- 化学物質の審査及び製造等の規制に関する法律(化審法):優先評価化学物質(45)
- 特定化学物質の環境への排出量の把握等及び管理の改善の促進に関する法律(化管法):特定第一種指定化学物質(1-400)
- 消防法:危険物第四類第一石油類
- 労働基準法:がん原性化学物質、疾病化学物質
- 労働安全衛生法:危険物(引火性の物)、特定化学物質(特定第2類物質、第3類物質等、特別管理物質)、名称等を表示すべき有害物、名称等を通知すべき有害物、管理濃度 1 ppm(ただし、ベンゼンゴムのりについては、製造等禁止物質)
- 環境基本法:
- 水質汚濁に係る環境基準 0.01 mg/L
- 地下水の水質汚濁に係る環境基準 0.01 mg/L
- 土壌汚染に係る環境基準 0.01 mg/L (溶出試験検液濃度)
- 大気の汚染に係る環境基準 0.003 mg/m3 (年平均値)
- 水道法:水質基準 0.01 mg/L
- 下水道法:水質基準 0.1 mg/L
- 水質汚濁防止法:有害物質、排水基準 0.1 mg/L
- 大気汚染防止法:特定物質、有害大気汚染物質 (優先取り組み物質)、環境基準 0.003 mg/m3(年平均値)
- 土壌汚染対策法:特定有害物質、土壌溶出基準 0.01 mg/L
- 海洋汚染等及び海上災害の防止に関する法律(海洋汚染防止法):有害液体物質C 類
- 船舶安全法:引火性液体類
- 航空法:引火性液体
- 港則法:引火性液体類
- 廃棄物の処理及び清掃に関する法律(廃棄物処理法):特別管理産業廃棄物、判定基準 1 mg/L (廃酸・廃塩基、含有量)、0.1 mg/L(汚泥など、溶出量)
- 建築物における衛生的環境の確保に関する法律(建築物衛生法):水質基準 0.01 mg/L
- 高圧ガス保安法:毒性ガス、可燃性ガス
文字コード[編集]
| 記号 | Unicode | JIS X 0213 | 文字参照 | 名称 |
|---|---|---|---|---|
| ⌬ | U+232C | - | ⌬⌬ | BENZENE RING |
| ⏣ | U+23E3 | - | ⏣⏣ | BENZENE RING WITH CIRCLE |
脚注[編集]
- ^ David R. Lide, ed.. “"Physical Constants of Organic Compounds", in CRC Handbook of Chemistry and Physics, Internet Version 2005”. CRC Press.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). “Solubility of Benzene in Water.”. Industrial & Engineering Chemistry Chemical & Engineering Data Series 3: 253. doi:10.1021/i460004a016.
- ^ Breslow, R; Guo, T (1990). “Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers.”. Proceedings of the National Academy of Sciences of the United States of America 87 (1): 167–9. doi:10.1073/pnas.87.1.167. PMC 53221. PMID 2153285.
- ^ A. Kayode Coker, Ernest E. Ludwig (2007). Ludwig's applied process design for chemical and petrochemical plants, Volume 1. Elsevier. p. 114. ISBN 075067766X
- ^ https://unit.aist.go.jp/riss/crm/mainmenu/zantei_0.4/benzene_0.4.pdf
- ^ ベンゼン benzene
- ^ Snyder, Robert; Sammett, David; Witmer, Charlotte; Kocsis, James J (1982). “An overview of the problem of benzene toxicity and some recent data on the relationship of benzene metabolism to benzene toxicity”. Genotoxic Effects of Airborne Agents (Springer US): 225-240. doi:10.1007/978-1-4613-3455-2_18. ISBN 978-1-4613-3455-2.
- ^ a b c 「ベンゼンに係る環境基準専門委員会報告」『大気環境学会誌』第32巻第4-2号、大気環境学会、1997年、19-33頁、doi:10.11298/taiki1995.32.4-2_19。
- ^ 厚生労働省:清涼飲料水中のベンゼンについて 2014年9月5日閲覧
- ^ 豊洲新市場予定地における土壌汚染対策等に関する専門家会議〈東京都〉
- ^ 豊洲新市場予定地における土壌汚染対策等に関する専門家会議〈東京都〉
- ^ 経済産業省生産動態統計年報 化学工業統計編
- ^ M. Faraday (1825). “On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained during the Decomposition of Oil by Heat”. Philosophical Transactions of the Royal Society of London 115: 440–466. doi:10.1098/rstl.1825.0022. JSTOR 107752.
- ^ R. Kaiser (1968). “Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968”. Angewandte Chemie International Edition in English 7 (5): 345–350. doi:10.1002/anie.196803451.
- ^ E. Mitscherlich (1834). “Über das Benzol und die Säuren der Oel- und Talgarten”. Annalen der Pharmacie 9 (1): 39–48. doi:10.1002/jlac.18340090103.
- ^ A. J. Rocke (1985). “Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory”. Annals of Science 42 (4): 355–81. doi:10.1080/00033798500200411.
- ^ F. A. Kekulé (1865). “Sur la constitution des substances aromatiques”. Bulletin de la Société Chimique de Paris 3: 98–110.
- ^ F. A. Kekulé (1866). “Untersuchungen uber aromatische Verbindungen”. Liebigs Annalen der Chemie 137 (2): 129–36. doi:10.1002/jlac.18661370202.
関連項目[編集]
- 芳香族化合物
- 1,3,5-シクロヘキサトリエン - ベンゼンが共鳴構造をとらず、電子が局在化していると仮定したときの、仮想の物質、ベンゼンの別名
- ナフタレン
- アントラセン
- フェナントレン
- ボラジン - 無機ベンゼンとも呼ばれる窒素・ホウ素化合物
- トリプリズマン - 三角柱型をしたベンゼンの異性体
- クラウスベンゼン
- π-π相互作用
- 環境基準、地下水汚染、 土壌汚染
- シクロオクタテトラエン
- ベンゼンから生ずる中毒の危害に対する保護に関する条約
外部リンク[編集]
- 化学物質ファクトシート2011年版 ベンゼン[1] - 環境省
- 化学物質の初期リスク評価書 No.104 ベンゼン (PDF) - 新エネルギー・産業技術総合開発機構
- 国際化学物質安全性カード ベンゼン (ICSC:0015) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 『ベンゼン』 - コトバンク



