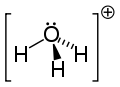
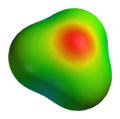
ヒドロニウム(英: hydronium)とは化学式 H3O+ と表されるカチオンおよびその塩である。H3O+ はオキソニウムイオンの一種であり、オニウムイオンの一種でもある。水やアルコールなどプロトン受容性酸素原子を持つ分子からなる溶液中では酸としてはたらく。溶媒和されたプロトンという見方もでき、実際にはさらに水和された H9O4+ として水溶液中に存在していると考えられている。
ヒドロニウム塩の例には過塩素酸一水和物 ( ) などがある[1]。
) などがある[1]。
ヒドロニウムイオンとアンモニアは等電子的である。
水溶液中におけるヒドロニウムイオン[編集]
水溶液中においては、自己解離または溶媒よりも強酸を加えることによって生じる:
 または
または 
 はライオニウムとしてはたらき、リエイトである水酸化物イオン濃度とは25 °Cにおいて以下の関係が成り立つ[2]。
はライオニウムとしてはたらき、リエイトである水酸化物イオン濃度とは25 °Cにおいて以下の関係が成り立つ[2]。
![{\displaystyle K_{\mathrm {w} }=[\mathrm {H_{3}O} ^{+}][\mathrm {OH} ^{-}]=10^{-14}~\mathrm {mol^{2}~L^{-2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2929815b0ce64c7ffd493628fc0afa3fd39afec)
 は水のイオン積または水の自己解離定数と呼ばれる。
は水のイオン積または水の自己解離定数と呼ばれる。
水溶液の酸性度を表すpHは  の活量により定義される。
の活量により定義される。

希薄水溶液中では近似的に活量は濃度に等しく、計算を簡単にするために通常は下記のように活量の代わりにモル濃度を用いることが多い。
![{\displaystyle \mathrm {pH} =-\log _{10}{\frac {[\mathrm {H_{3}O^{+}} ]}{\mathrm {mol~L^{-1}} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/499b2f1eb14ec7d4150b8cd9b0fa044a8ffd8862)
酸塩基平衡に関する化学反応式においては便宜的に H+(水素イオン、プロトン)で表されることが多い。
参考文献[編集]
- ^ F.A. コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年
- ^ 田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年
関連項目[編集]







![{\displaystyle K_{\mathrm {w} }=[\mathrm {H_{3}O} ^{+}][\mathrm {OH} ^{-}]=10^{-14}~\mathrm {mol^{2}~L^{-2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2929815b0ce64c7ffd493628fc0afa3fd39afec)


![{\displaystyle \mathrm {pH} =-\log _{10}{\frac {[\mathrm {H_{3}O^{+}} ]}{\mathrm {mol~L^{-1}} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/499b2f1eb14ec7d4150b8cd9b0fa044a8ffd8862)