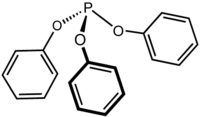
Trifenilfosfito

| Trifenilfosfito | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C18H15O3P |
| Massa molecolare (u) | 310,28 |
| Aspetto | liquido incolore[1] |
| Numero CAS | |
| Numero EINECS | 202-908-4 |
| PubChem | 7540 |
| SMILES | C1=CC=C(C=C1)OP(OC2=CC=CC=C2)OC3=CC=CC=C3 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,19[1] |
| Indice di rifrazione | 1,5900[2] |
| Solubilità in acqua | si decompone lentamente[1] |
| Temperatura di fusione | 22–25 °C (295–298 K)[1] |
| Temperatura di ebollizione | 360 °C (633 K) dec.[1] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 444 oral rat[1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 188 ºC[1] |
| Simboli di rischio chimico | |
  | |
| attenzione | |
| Frasi H | 302 - 315 - 317 - 319 - 410 [1] |
| Consigli P | 273 - 280 - 333+313 - 337+313 - 391 - 501 [1] |
Il trifenilfosfito è il composto chimico di formula P(OC6H5)3. Può essere considerato l'estere fenolico dell'acido fosforoso. A temperature maggiori di 25 ºC il composto si presenta come un liquido incolore con odore simile a quello del fenolo.
Sintesi[modifica | modifica wikitesto]
Il trifenilfosfito si ottiene da tricloruro di fosforo e fenolo in presenza di una base:
- PCl3 + 3 C6H5OH → P(OC6H5)3 + 3 HCl
Proprietà[modifica | modifica wikitesto]
Il trifenilfosfito ha un punto di fusione di 22-25 ºC e può quindi essere solido o liquido a seconda della temperatura ambientale. Ha un odore simile a quello del fenolo ed è scarsamente infiammabile. In acqua si decompone lentamente formando una soluzione fortemente acida. Per riscaldamento oltre 360 ºC si decompone formando monossido di carbonio, diossido di carbonio e ossidi di fosforo.[1]
Reagendo con bromuro di metilmagnesio forma trimetilfosfina:[3]
- P(OC6H5)3 + 3CH3MgBr → P(CH3)3 + 3C6H5OMgBr
Applicazioni[modifica | modifica wikitesto]
Il trifenilfosfito è usato industrialmente come additivo antiossidante e complessante per la stabilizzazione termica di PVC.[4] Nei laboratori chimici è usato per convertire alcoli in alogenuri alchilici, per produrre ossigeno singoletto a bassa temperatura, e come legante in composti organometallici.[5]
Tossicità / Indicazioni di sicurezza[modifica | modifica wikitesto]
Il trifenilfosfito è disponibile in commercio. Non sono noti dati sulla tossicità nell'uomo. Da studi su animali ci si possono attendere irritazioni agli occhi e alle mucose; i rischi sono maggiori nel caso di ingestione, con effetti al sistema nervoso centrale dovuti al rilascio di fenolo. Non risultano rischi di cancerogenicità. Il composto è classificato come pericoloso per l'ambiente acquatico.[1]
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h i j k GESTIS 2018
- ^ Lide 2005
- ^ Leutkens et al. 1990
- ^ Mesch 1998
- ^ Sigma-Aldrich 2017
Bibliografia[modifica | modifica wikitesto]
- GESTIS, Triphenyl phosphite, su gestis-en.itrust.de, 2018. URL consultato il 18 maggio 2018. Pagina del trifenilfosfito nel data base GESTIS.
- (EN) M. L. Leutkens Jr., A. P. Sattelberger, H. H. Murray, J. D. Basil e J. P. Fackler Jr., Trimethylphosphine, in Inorg. Synth., vol. 28, 1990, pp. 305-310, DOI:10.1002/9780470132593.ch76.
- (EN) K. A. Mesch, Heat stabilizers, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- Sigma-Aldrich, Triphenyl phosphite, su sigmaaldrich.com, 2017.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su trifenilfosfito
Wikimedia Commons contiene immagini o altri file su trifenilfosfito