Tetrafluoruro di rutenio

| Tetrafluoruro di rutenio | |
|---|---|
 | |
| Nome IUPAC | |
| tetrafluoruro di rutenio | |
| Nomi alternativi | |
| fluoruro di rutenio(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | F4Ru |
| Peso formula (u) | 177,06 |
| Aspetto | solido rosa[1] |
| Numero CAS | |
| PubChem | 167109 |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | reazione violenta |
| Indicazioni di sicurezza | |
Il tetrafluoruro di rutenio è il composto inorganico con formula RuF4. In questo fluoruro il rutenio è nello stato di ossidazione +4. In condizioni normali è un solido di colore rosa.[1][2] È un composto estremamente reattivo e reagisce violentemente in presenza di acqua.
Sintesi[modifica | modifica wikitesto]
Il composto fu preparato per la prima volta nel 1963 da Holloway e Peacock, che ottennero un solido giallo riducendo il pentafluoruro di rutenio con iodio usando pentafluoruro di iodio come solvente.[3]
- 10 RuF5 + I2 → 10 + 2 IF5
Studi successivi hanno indicato che RuF4 prodotto per questa via risulta impuro. Il composto puro, di colore rosa, è stato isolato per la prima volta nel 1992 facendo reagire K2RuF6 con AsF5 a 20 ºC in acido fluoridrico anidro, con rigorosa esclusione di acqua e ossigeno.[2] Questa sintesi sfrutta le fortissime capacità accettrici di ioni fluoruro dell'acido di Lewis AsF5.
- K2RuF6 + 2 AsF5 → RuF4 + 2 KAsF6
Struttura[modifica | modifica wikitesto]
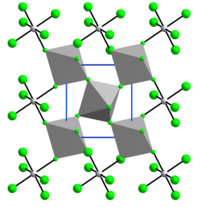
RuF4 allo stato solido è polimerico, con una struttura tridimensionale a strati corrugati contenenti ottaedri RuF6 uniti da atomi di fluoro condivisi (vedi figura).[1] La struttura cristallina è simile a quella di VF4 e risulta monoclina, gruppo spaziale P21/n, con costanti di reticolo a = 560,7 pm, b = 494,6 pm e c = 514,3 pm, β = 121,27°, due unità di formula per cella elementare.[2]
Proprietà e reattività[modifica | modifica wikitesto]
RuF4 è un composto estremamente reattivo che scurisce immediatamente a contatto con umidità, e reagisce violentemente con l'acqua depositando diossido di rutenio. Si può conservare in recipienti di vetro, che vengono però attaccati se il campione è riscaldato oltre 280 ºC.[3]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) W. J. Casteel Jr., A. P. Wilkinson, H. Borrmann, R. E. Serfass e N. Bartlett, Preparation and structure of ruthenium tetrafluoride and a structural comparison with ruthenium trifluoride and ruthenium pentafluoride, in Inorg. Chem., vol. 31, n. 14, 1992, pp. 3124–3131, DOI:10.1021/ic00040a024.
- (EN) F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley-Interscience, 1999, ISBN 978-0471199571.
- (EN) J. H. Holloway e R. D. Peacock, Ruthenium Tetrafluoride, in J. Chem. Soc., 1963, pp. 3892-3893, DOI:10.1039/JR9630003879.