Stenosi aortica

| Stenosi aortica | |
|---|---|
 | |
| Specialità | cardiologia |
| Classificazione e risorse esterne (EN) | |
| MeSH | D001024 |
| MedlinePlus | 000178 |
| eMedicine | 150638 |
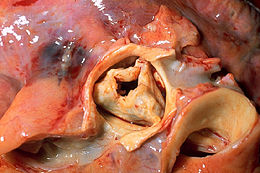
Per stenosi aortica si indica un restringimento dell'anulus aortico, molto diffuso soprattutto in soggetti con difetti valvolari. Nelle persone apparentemente sane, ovvero senza sintomi, il rischio è maggiore dopo i 60 anni di età, con la naturale modifica che interviene con l'invecchiamento. Questo restringimento determina un gradiente pressorio che impone al ventricolo sinistro di sviluppare una maggiore pressione con la sistole al fine di mantenere una gittata cardiaca adeguata alle richieste metaboliche. Il miocardio nel corso degli anni e man mano che la stenosi si fa più grave, sviluppa un'ipertrofia concentrica come meccanismo di compenso.
Segni e sintomi[modifica | modifica wikitesto]
La classica triade di sintomi nei pazienti con stenosi aortica è:
- Sincope, che avviene durante lo sforzo, causata dalla caduta della pressione arteriosa sistolica quando vi è vasodilatazione sistemica in presenza di un volume d'eiezione fisso (o che comunque non può aumentare rispetto alle esigenze sistemiche, a causa della diminuita area valvolare)
- Dolore toracico (angina pectoris), che tipicamente si presenta sotto sforzo e diminuisce a riposo
- Dispnea, dapprima da sforzo, poi ortopnea, dispnea parossistica notturna.
I sintomi, specie i primi due, si manifestano tardivamente, o comunque quando è presente un certo grado di insufficienza ventricolare sinistra.
I segni tipici rilevabili durante la visita clinica sono:
- Polso arterioso parvus et tardus, ovvero di bassa ampiezza (parvus), con un picco ritardato e a plateau e una discesa graduale (tardus).
- Sdoppiamento paradosso del secondo tono, dato dalla ritardata chiusura della valvola aortica
- Soffio sistolico in focolaio aortico, dalla tonalità aspra, tipicamente in crescendo-decrescendo (a diamante) che inizia subito dopo il primo tono, raggiunge la massima intensità a metà sistole e scompare un attimo prima di udire il secondo tono. Si può irradiare al collo ed alla punta (segno di Gallavardin).
- Quarto tono accentuato, causato dall'energica contrazione atriale contro un ventricolo sinistro ipertrofico e quindi poco distensibile
- Click d'eiezione, comune nei bambini e giovani portatori di stenosi aortica congenita
- Pulsus alternans, in caso di disfunzione sistolica del ventricolo sinistro
Eziologia[modifica | modifica wikitesto]
Cause maggiori[modifica | modifica wikitesto]
In un grande numero di casi la stenosi è da degenerazione e calcificazione dei lembi valvolari. Tali alterazioni, in era pre-antibiotica, potevano dipendere da un attacco di febbre reumatica da infezione da streptococco, in altri casi da sclerosi idiopatica o da cardiopatica congenita.
La stenosi cronica può comportare una insufficienza del ventricolo sinistro - con relativo scompenso cardiaco - quando si è superato il tempo giusto per la sostituzione chirurgica della valvola, che rappresenta l'unica terapia definitiva per la cura di queste affezioni.
Cause minori[modifica | modifica wikitesto]
Cause rare della stenosi sono: artrite reumatoide, iperlipoproteinemia omozigote di tipo II, lesioni da radioterapia, malattia di Paget e infine il lupus eritematoso sistemico.
La valvola aortica bicuspide[modifica | modifica wikitesto]

La valvola aortica bicuspide è un difetto congenito che consiste nell'assenza di una cuspide, con normale funzionamento delle cuspidi rimanenti. Tale difetto interessa fino al 2% della popolazione generale.[1] Talora può esservi insufficienza.
Tale difetto può predisporre, per l'aumento delle turbolenze del sangue, a fibrosi e alla calcificazione prematura dei lembi valvolari. Normalmente l'ispessimento e la calcificazione delle valvole, inizia dalla sesta-settima decade, come espressione dell'invecchiamento naturale dell'organismo; in presenza del difetto congenito, tale deposito viene generalmente anticipato.
Fisiopatologia[modifica | modifica wikitesto]
La stenosi aortica porta ad un aumento della resistenza che il ventricolo deve vincere per mantenere il flusso sanguigno costante, pertanto il gradiente pressorio fra ventricolo ed aorta aumenterà proporzionalmente al grado di stenosi. Questo sovraccarico di pressione per il cuore viene compensato con ipertrofia concentrica: le pareti del ventricolo si ispessiscono ma non aumenta il volume della cavità. Tale processo permette di mantenere una buona capacità contrattile del cuore, per far fronte ai bisogni perlomeno a riposo. L'ipertrofia concentrica va a scapito però della compliance ventricolare, con un incremento proporzionale del consumo di ossigeno. L'ipertrofia coinvolge poi anche l'atrio perché deve accrescere la forza di contrazione per riempire ottimamente il ventricolo, dove la pressione è aumentata.
Il flusso nei vasi coronarici è inoltre ostacolato da queste alta pressione diastolica endocavitaria, essendo maggiormente compressi.
In caso di sforzo pertanto:[2]
- aumenta la richiesta d'ossigeno, mentre la perfusione è ostacolata;
- aumenta la pressione sistolica ventricolare, perché non è sufficientemente controbilanciata dalla diminuzione delle resistenze periferiche a seguito di vasodilatazione; inoltre nemmeno la portata è aumentata a causa della stenosi che limita il flusso;
- aumenta il postcarico, causato dall'aumento di pressione ventricolare sistolica, che impedisce una corretta espusione in sistole di tutto il sangue giunto durante la diastole.
Tutto questo può portare ad aggravamento con congestione polmonare, manifesta con dispnea, dilatazione del ventricolo, insufficienza ventricolare sinistra e mitrialica.
Tipologia[modifica | modifica wikitesto]
L'ostruzione può essere valvolare, sopravalvolare oppure sottovalvolare (o membranosa). Le ostruzioni valvolari sono conseguenza di processi infiammatori o degenerativi, talvolta sovrapposte a problemi di origine congenita, pertanto tipiche dell'età avanzata, metre le stenosi sopravalvolari e sottovalvolari sono sempre d'origine congenita, manifestandosi quindi in età infantile o giovanile.[3]
Stenosi valvolare aortica[modifica | modifica wikitesto]
La stenosi valvolare è a sua volta suddivisa in congenita, reumatica o anche calcifica (o degenerativa); in questi casi, se non associata ad una stenosi mitralica, si correla alla tipologia congenita o degenerativa[4]
- Stenosi aortica calcificata, la si può osservare in persone con età superiore a 35 anni ed è conseguenza della calcificazione di una valvola che per patologia congenita o reumatica è divenuta soggetta ad alterazioni degenerative.
Stenosi aortica sopravalvolare[modifica | modifica wikitesto]
È una forma congenita della stenosi, accompagnata di solito da ispessimento intimale e ipertrofia della media. Si crea un gradiente pressorio intra-aortico (mentre nella stenosi valvolare il gradiente è tra ventricolo sinistro ed aorta).
Stenosi aortica sottovalvolare[modifica | modifica wikitesto]
Questa tipologia si riscontrata in circa 20% di tutte le stenosi aortiche, suddivise in tre varietà anatomiche principali:
- A diaframma, dove è presente una membrana fibrosa circolare. Il diaframma può essere completo od incompleto. La zona di competenza varia da pochi mm a 2–3 cm sempre sotto la valvola aortica.
- A tunnel, con restringimento fibromuscolare diffuso della parte di efflusso del ventricolo sinistro
- Fibromuscolari, con presenza di un “collare” o di uno sperone subaortico.
Tali forme vengono distinte dalla cardiomiopatia ipertrofica ostruttiva, ma in una persona, anche se raramente, le si possono ritrovare entrambe[5]
La terapia radicale di queste forme è esclusivamente chirurgica.
Esami[modifica | modifica wikitesto]
L'esame necessario per seguire l'evoluzione della patologia è l'ecocardiogramma Doppler: esame non-invasivo e ripetibile ogni sei-dodici mesi, a seconda del grado di ostruzione, permette di valutare sede ed entità della stenosi, oltre che la presenza di calcificazioni. L'angiografia delle coronarie viene eseguita esclusivamente come dato pre-intervento chirurgico.

L'ECG evidenzia ipertrofia ventricolare, d'ingandimento atriale sinistro, mentre alla radiografia si apprezza un cuore globoso, con l'aorta ascendente spesso dilatata.
Prognosi[modifica | modifica wikitesto]
La stenosi può rimare silente e senza sintomi per molto tempo (grazie alla riserva funzionale del ventricolo sinistro). Dopo la comparsa, solitamente con angina, sincopi e dispnea, si assiste ad una rapida involuzione del quadro. La morte è improvvisa nel 15-20% dei casi, mentre arriva dopo 2-6 anni se non si procede con un intervento chirurgico.[6]
Terapie[modifica | modifica wikitesto]
Se il paziente è asintomatico, la stenosi non è severa (velocità massima del sangue attraverso la stenosi, rilevata con ecodoppler, <4 m/s, gradiente medio di pressione transvalvolare <40 mmHg, area dell'orifizio aortico > 1 cm2) e la frazione di eiezione è superiore al 50%, il paziente viene seguito nel tempo. Si attua comunque, a scopo cautelativo, la profilassi antibiotica per evitare l'endocardite infettiva.
Se la stenosi è sintomatica ed è severa (velocità massima del sangue attraverso la stenosi, rilevata con ecodoppler, >4 m/s, gradiente medio di pressione transvalvolare >60-70 mmHg, area dell'orifizio aortico < 1 cm2) è necessario l'intervento chirurgico.
Altri ritengono che il gradiente medio debba essere portato a 80-100 mmHg. Secondo le linee guida americane 2006 sul management del paziente con valvulopatie, discriminante è la frazione di eiezione. Se risulta <50%, si ha indicazione all'intervento chirurgico anche se il paziente è asintomatico.
La terapia chirurgica è in genere legata alla sostituzione della valvola.
Le valvole tissutali possono avere una durata di 10-20 anni.[7] Tuttavia, tendono a deteriorarsi più rapidamente nei pazienti più giovani.[8] Sono attualmente oggetto di studio nuovi modi per preservare il tessuto più a lungo. Uno di questi trattamenti di conservazione è attualmente utilizzato in una valvola cardiaca tissutale disponibile in commercio. Negli studi condotti su pecore e conigli, il tessuto (chiamato tessuto RESILIA™) ha presentato una calcificazione inferiore rispetto al tessuto di controllo.[9][10] Tuttavia, non sono ancora disponibili dati sulla durabilità a lungo termine nei pazienti.[11]
Le valvole tissutali sono con o senza stent. Le valvole con stent sono disponibili in dimensioni comprese tra 19-29 mm.* Sabiston, Sabiston and Spencer's Surgery of the Chest E-Book, Elsevier Health Sciences, 16 dicembre 2010, ISBN 978-1-4557-0009-7. Le valvole senza stent vengono direttamente suturate alla radice aortica. Il vantaggio principale delle valvole senza stent è che limitano la discrepanza paziente-protesi (quando l’area della valvola protesica è troppo piccola rispetto alle dimensioni del paziente, aumentando la pressione all’interno della valvola[12]) e possono essere utili quando si tratta di una piccola radice aortica. Il loro svantaggio è che necessitano di più tempo per l’impianto rispetto alle valvole con stent.* Sabiston, Sabiston and Spencer's Surgery of the Chest E-Book, Elsevier Health Sciences, 16 dicembre 2010, ISBN 978-1-4557-0009-7.
Tuttavia, il rischio di formazione di coaguli di sangue è maggiore con le valvole meccaniche rispetto alle valvole tissutali. Pertanto, i portatori di valvole cardiache meccaniche devono assumere farmaci anticoagulanti (fluidificanti del sangue), come il warfarin, per il resto della loro vita, rendendoli più inclini a emorragie.[13] Talvolta, il suono della valvola può essere avvertito (spesso sotto forma di clic) e può essere inquietante.[14]
La scelta della valvola è una decisione ponderata tra la minore durata delle valvole tissutali e il maggior rischio di coaguli di sangue ed emorragie a cui espongono le valvole meccaniche. Le linee guida suggeriscono che quando si sceglie una valvola è necessario considerare l’età, lo stile di vita e l’anamnesi medica del paziente. Le valvole tissutali si deteriorano più rapidamente nei pazienti giovani e durante la gravidanza, ma sono preferibili per le donne che desiderano avere figli poiché la gravidanza aumenta il rischio di coaguli di sangue. In genere, una valvola tissutale è considerata per i pazienti di età superiore a 65 anni.
Uno dei maggiori svantaggi delle valvole cardiache meccaniche è la loro associazione a un maggior rischio di coaguli di sangue. I coaguli formati da globuli rossi e piastrine danneggiati possono ostruire i vasi sanguigni con gravi conseguenze. Le persone con valvole meccaniche devono assumere anticoagulanti (fluidificanti del sangue), come il warfarin, per il resto della loro vita.[15]
Le valvole cardiache meccaniche possono inoltre causare anemia emolitica meccanica, una condizione in cui i globuli rossi rimangono danneggiati mentre attraversano la valvola.[16]
Alcuni pazienti portatori di valvole meccaniche riescono a percepire dei clic quando la loro valvola si chiude, che alcuni di loro trovano inquietanti.[17] Può presentarsi, poi, il fenomeno della cavitazione, che consiste nella formazione di microbolle a causa di una caduta di pressione al di sotto della pressione di vaporizzazione ad una data temperatura. La cavitazione nella circolazione sanguigna può portare a guasti meccanici della valvola cardiaca[18], pertanto, i test di cavitazione sono una parte essenziale del processo di verifica della progettazione della valvola.
Dal 2007 in Italia, esiste un'ulteriore modalità di trattamento, l'impianto valvolare aortico transcatetere (meglio nota come TAVI). Si tratta di una tecnica simile all'angioplastica, nel senso che la valvola nativa viene lasciata in loco e tramite catetere, senza quindi toracotomia/sternotomia tradizionale, si impianta la protesi.[19] Questo trattamento è indicato per pazienti con stenosi aortica severa, come sopra descritta, con rischio proibitivo, elevato o intermedio nel trattamento chirurgico tradizionale.[20]
Diagnosi correlate[modifica | modifica wikitesto]
I soggetti con stenosi aortica, secondaria ad una reazione immunitaria con aggressione delle strutture valvolari, possono essere soggetti ad arteriosclerosi.
Note[modifica | modifica wikitesto]
- ^ Claudio Rugarli, Filippo Crea, Medicina interna sistematica. Estratto. Malattie del sistema circolatorio, Vignate, Edra, 2019, pag 164
- ^ Claudio Rugarli, Filippo Crea, Medicina interna sistematica. Estratto. Malattie del sistema circolatorio, Vignate, Edra, 2019, pag 165
- ^ Claudio Rugarli, Filippo Crea, Medicina interna sistematica. Estratto. Malattie del sistema circolatorio, Vignate, Edra, 2019, pag 163
- ^ Dare AJ, Veinot JP, Edwards WD, New Observation on the etiology of aortic valvue disease 24,133
- ^ Maron BJ, Redwood DR, Roberts WC, Henry WL, Morrow AG, Epstein SE, Tunnel subaortic stenosis left ventricular outflow tract obstruction produced by fibromuscolar tubular narrowing 54, 404
- ^ Claudio Rugarli, Filippo Crea, Medicina interna sistematica. Estratto. Malattie del sistema circolatorio, Vignate, Edra, 2019, pag 167
- ^ Christopher Harris, Beth Croce e Christopher Cao, Tissue and mechanical heart valves, in Annals of Cardiothoracic Surgery, vol. 4, n. 4, 7 ottobre 2015, p. 399, DOI:10.3978/6884, ISSN 2225-319X, PMC 4526499, PMID 26309855.
- ^ Douglas R. Johnston, Edward G. Soltesz, Nakul Vakil, Jeevanantham Rajeswaran, Eric E. Roselli, Joseph F. Sabik, Nicholas G. Smedira, Lars G. Svensson e Bruce W. Lytle, Long-Term Durability of Bioprosthetic Aortic Valves: Implications From 12,569 Implants, in The Annals of Thoracic Surgery, vol. 99, n. 4, 2015, pp. 1239-1247, DOI:10.1016/j.athoracsur.2014.10.070, PMC 5132179, PMID 25662439.
- ^ Willem Flameng, Hadewich Hermans, Erik Verbeken e Bart Meuris, A randomized assessment of an advanced tissue preservation technology in the juvenile sheep model, in The Journal of Thoracic and Cardiovascular Surgery, vol. 149, n. 1, 2015, pp. 340-345, DOI:10.1016/j.jtcvs.2014.09.062, ISSN 0022-5223, PMID 25439467.
- ^ Hao Shang, Steven M. Claessens, Bin Tian e Gregory A. Wright, Aldehyde reduction in a novel pericardial tissue reduces calcification using rabbit intramuscular model, in Journal of Materials Science: Materials in Medicine, vol. 28, n. 1, 20 dicembre 2016, p. 16, DOI:10.1007/s10856-016-5829-8, ISSN 0957-4530, PMC 5174141, PMID 28000112.
- ^ Krzysztof Bartuś, Radosław Litwinowicz, Mariusz Kuśmierczyk, Agata Bilewska, Maciej Bochenek, Maciej Stąpór, Sebastian Woźniak, Jacek Różański e Jerzy Sadowski, Primary safety and effectiveness feasibility study after surgical aortic valve replacement with a new generation bioprosthesis: one-year outcomes, in Kardiologia Polska, vol. 76, n. 3, 19 dicembre 2017, pp. 618-624, DOI:10.5603/KP.a2017.0262, ISSN 0022-9032, PMID 29297188.
- ^ P Pibarot, Prosthesis-patient mismatch: definition, clinical impact, and prevention, in Heart, vol. 92, n. 8, 1º agosto 2006, pp. 1022-1029, DOI:10.1136/hrt.2005.067363, ISSN 1355-6037, PMC 1861088, PMID 16251232.
- ^ Tillquist, Tillquist e Tom Maddox, Cardiac crossroads: deciding between mechanical or bioprosthetic heart valve replacement, in Patient Preference and Adherence, vol. 5, 2011, pp. 91-9, DOI:10.2147/PPA.S16420, ISSN 1177-889X, PMC 3063655, PMID 21448466.
- ^ Golczyk, Karl Jan., Heart valve sound of various mechanical composite grafts, and the impact on patients' quality of life, [Verlag nicht ermittelbar], 2010, OCLC 742549155.
- ^ (EN) Tillquist, Tillquist e Tom Maddox, Cardiac crossroads: deciding between mechanical or bioprosthetic heart valve replacement, in Patient Preference and Adherence, vol. 5, 2011, pp. 91-9, DOI:10.2147/PPA.S16420, ISSN 1177-889X, PMC 3063655, PMID 21448466.
- ^ (EN) Sethi Pooja, Ghulam Murtaza, Zia Rahman, Syed Zaidi, Thomas Helton e Timir Paul, Valvular Hemolysis Masquerading as Prosthetic Valve Stenosis, in Cureus, vol. 9, n. 4, 8 aprile 2017, pp. e1143, DOI:10.7759/cureus.1143, ISSN 2168-8184, PMC 5422110, PMID 28491484.
- ^ H Koertke, Does the noise of mechanical heart valve prostheses affect quality of life as measured by the SF-36® questionnaire?, in European Journal of Cardio-Thoracic Surgery, vol. 24, n. 1, 2003, pp. 52-58, DOI:10.1016/s1010-7940(03)00172-6, ISSN 1010-7940, PMID 12853045.
- ^ (EN) Peter Johansen, Mechanical heart valve cavitation, in Expert Review of Medical Devices, vol. 1, n. 1, 2004, pp. 95-104, DOI:10.1586/17434440.1.1.95, ISSN 1743-4440, PMID 16293013.
- ^ attualità cappato.qxd Archiviato il 28 febbraio 2013 in Internet Archive.
- ^ Valvular Heart Disease (Management of), su escardio.org. URL consultato il 18 ottobre 2017 (archiviato dall'url originale il 19 gennaio 2021).
Bibliografia[modifica | modifica wikitesto]
- Joseph C. Segen, Concise Dictionary of Modern Medicine, ISBN 978-88-386-3917-3
- Hurst IL CUORE, IL MANUALE 11ª edizione - capitolo 23
- Acc/Aha 2006 Guideline Revision
- "Principi di cardiochirurgia", Giovanni Ruvolo, 2006, Poletto Editore
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su stenosi aortica
Wikimedia Commons contiene immagini o altri file su stenosi aortica
| Controllo di autorità | Thesaurus BNCF 52821 · LCCN (EN) sh85005871 · BNF (FR) cb146410344 (data) · J9U (EN, HE) 987007294042705171 · NDL (EN, JA) 01167602 |
|---|