Polarità

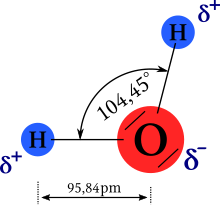
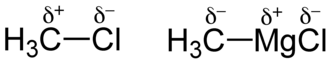
In chimica, la polarità è una proprietà delle molecole per cui una molecola (detta polare) presenta una carica parziale positiva su una parte della molecola e una carica parziale negativa sulla parte opposta di essa. Le molecole che non presentano il fenomeno della polarità sono dette apolari o non polari.
In genere in molecole con più di due atomi, quando gli atomi sono tutti uguali fra loro e legati ad un atomo centrale di tipo diverso, (ad esempio CH4), la molecola non presenta comportamento polare, poiché la simmetria della molecola fa sì che le cariche siano distribuite in maniera abbastanza uniforme sul contorno della molecola.
Un esempio di molecola polare è la molecola dell'acqua (H2O), in cui una carica parziale negativa è presente in prossimità dell'atomo di ossigeno (O) e una carica parziale positiva è presente in prossimità dei due atomi di idrogeno (H).
Il grado di polarità di un legame covalente dipende dalla capacità relativa degli atomi legati di attrarre gli elettroni. La differenza vettoriale dell'elettronegatività dei singoli atomi permette di stimare il grado di polarità di un legame. Perciò il grado di polarità varia all'aumentare della differenza di elettronegatività tra gli atomi coinvolti nel legame.
La polarità inoltre determina la miscibilità tra due sostanze: in genere due sostanze entrambe polari o entrambe apolari sono miscibili tra loro.
Momento di dipolo[modifica | modifica wikitesto]
La polarità viene espressa quantitativamente dal suo momento di dipolo, che si ottiene moltiplicando la carica parziale presente ai due estremi per la distanza tra le cariche.
La polarità in una molecola si presenta se gli elettroni di legame tra due atomi diversi A e B non sono equamente condivisi a causa della diversa elettronegatività dei due atomi.
Si viene pertanto a creare un dipolo elettrico di momento:
dove d è la distanza tra le due cariche +q e -q che costituiscono il dipolo elettrico
nel caso sia B più elettronegativo di A.
Poiché il momento di legame e la distanza di legame si possono misurare sperimentalmente, è possibile determinare la carica dipolare q e quindi la percentuale di carattere ionico di un legame covalente.
Il momento elettrico delle molecole poliatomiche sarà dato dalla somma vettoriale dei momenti dipolari dei singoli legami e degli eventuali doppietti solitari; quindi il momento risultante, che indicherà se la molecola sarà polare o meno, dipenderà anche dalla geometria della molecola.
Per esempio le molecole dell'anidride carbonica (CO2), trifluoruro di boro (BF3), tetrafluoruro di carbonio (CF4) non sono polari a dispetto degli elevati momenti dipolari dei singoli legami coinvolti. Invece le molecole dell'ammoniaca (NH3), trifluoruro di azoto (NF3), acqua (H2O) e trifluorometano (CHF3) sono polari.
Bibliografia[modifica | modifica wikitesto]
- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 18-20, ISBN 88-08-09414-6.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «polarità»
Wikizionario contiene il lemma di dizionario «polarità» Wikimedia Commons contiene immagini o altri file sulla polarità
Wikimedia Commons contiene immagini o altri file sulla polarità
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) polarity, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) IUPAC Gold Book, "polarity", su goldbook.iupac.org.

