Esafluoruro di tungsteno

| Esafluoruro di tungsteno | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Esafluoruro di tungsteno Fluoruro di tungsteno(VI) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | WF6 |
| Massa molecolare (u) | 297,83 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 232-029-1 |
| PubChem | 522684 |
| SMILES | F[W](F)(F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 13,2 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | 2,3 °C (275,45 K) |
| Temperatura di ebollizione | 17,1 °C (290,25 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 23/24/25, 34 |
| Frasi S | 26, 36/37/39, 45 |
L'esafluoruro di tungsteno è il composto chimico tra tungsteno e fluoro con formula WF6. In condizioni normali è un gas incolore corrosivo, con una densità di circa 13 g/L[1][2] (circa 11 volte più pesante dell'aria), ed è quindi uno dei gas più pesanti in condizioni normali.[3] WF6 è disponibile in commercio ed è usato soprattutto nella produzione di semiconduttori, circuiti integrati utilizzando il metodo della deposizione chimica da vapore: le molecole di WF6 si decompongono e lasciano un residuo di tungsteno metallico. Questo strato serve per creare connessioni a bassa resistenza.[4]
Proprietà fisiche e struttura molecolare[modifica | modifica wikitesto]
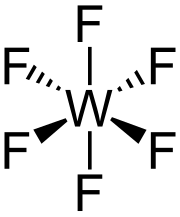
WF6 è un composto molecolare. A pressione atmosferica e al di sopra di 17 °C è un gas incolore diamagnetico.[5] La molecola WF6 ha struttura ottaedrica con simmetria Oh. Le distanze W–F sono 183,2 pm.[6] Tra 2,3 e 17 °C condensa in un liquido giallo chiaro, che ha una densità di 3,44 g/cm3 at 15 °C. A 2,3 °C solidifica formando un solido bianco con struttura cristallina cubica, con costante di reticolo di 628 pm e una densità calcolata di 3,99 g/cm3. A −9 °C la struttura si trasforma in ortorombica con costanti di reticolo a = 960,3 pm, b = 871,3 pm, and c = 504,4 pm, e densità di 4,56 g/cm3. In questa fase la distanza W–F è 181 pm, e il più prossimo contatto intermolecolare medio è 312 pm. I valori di densità di WF6 allo stato liquido e solido sono piuttosto modesti, mentre allo stato gassoso WF6 risulta uno dei più pesanti gas noti, con una densità maggiore del radon, che è l'elemento gassoso più pesante (9,73 g/L).[7]
Sintesi[modifica | modifica wikitesto]
Di solito WF6 è prodotto tramite la reazione esotermica tra fluoro gassoso e polvere di tungsteno a temperature comprese tra 350 e 400 °C:[8]
- W + 3 F2 → WF6
Il prodotto gassoso viene condensato e separato per distillazione da WOF4, un'impurezza comune. Il fluoro gassoso della reazione precedente può essere sostituito con altri fluoruranti come ClF, ClF3 o BrF3. Alternativamente si può far reagire triossido di tungsteno (WO3) con HF, BrF3 or SF4. Si può ottenere WF6 anche per conversione dell'esacloruro di tungsteno WCl6:[3]
- WCl6 + 6 HF → WF6 + 6 HCl
- WCl6 + 2 AsF3 → WF6 + 2 AsCl3
- WCl6 + 3 SbF5 → WF6 + 3 SbF3Cl2
Reattività[modifica | modifica wikitesto]
A contatto con acqua e umidità WF6 reagisce formando fluoruro di idrogeno (HF) e ossifluoruri di tungsteno, e alla fine triossido di tungsteno:[3]
- WF6 + 3 H2O → WO3 + 6 HF
A differenza di altri fluoruri metallici, WF6 non è un utile agente fluorurante e neanche un ossidante energico.[9]
Applicazioni[modifica | modifica wikitesto]
Le applicazioni principali di WF6 sono nell'industria dei semiconduttori, dove è molto usato per depositare tungsteno metallico utilizzando il metodo della deposizione chimica da vapore (CVD). Lo sviluppo dell'industria negli anni 80 e 90 ha provocato un aumento mondiale del consumo di WF6, che si aggira in circa 200 tonnellate all'anno. Il tungsteno metallico è interessante per la sua stabilità chimica e termica, nonché per la bassa resistività elettrica (5.6 µΩ·cm) e la bassa elettromigrazione. WF6 risulta anche più conveniente di composti analoghi come WCl6 e WBr6 perché ha una pressione di vapore più elevata che garantisce una maggior velocità di deposizione. Sin dal 1967 sono stati sviluppati due metodi di deposizione, la decomposizione termica e la riduzione con idrogeno.[10] A seconda dell'applicazione, è richiesto WF6 gassoso di elevata purezza, tra 99,98% e 99,9995%.[3]
Le molecole di WF6 devono essere scisse nel processo CVD. La decomposizione è in genere facilitata mescolando WF6 con idrogeno, silano, germano, diborano, fosfina, e altri gas simili contenenti idrogeno.
Silicio[modifica | modifica wikitesto]
WF6 reagisce a contatto con un substrato di silicio.[3] La decomposizione di WF6 sul silicio dipende dalla temperatura:
- 2WF6 + 3 Si → 2W + 3 SiF4 sotto 400 °C e
- WF6 + 3 Si → W + 3 SiF2 sopra 400 °C.
Questa dipendenza è cruciale perché a temperatura più elevata viene consumato il doppio di silicio. La deposizione avviene selettivamente solo su silicio puro, non su ossido o nitruro di silicio, e quindi la reazione è estremamente sensibile alla contaminazione o al pretrattamento del substrato. La reazione di decomposizione è veloce, ma si arresta quando lo spessore dello strato di tungsteno raggiunge i 10–15 micrometri, perché questo strato di tungsteno non permette alle molecole di WF6 di raggiungere il substrato di silicio che è l'unico catalizzatore per la decomposizione di WF6.[3]
Se la deposizione non è condotta in atmosfera inerte ma in presenza di ossigeno (in aria) si ha la deposizione di uno strato di ossido di tungsteno.[11]
Idrogeno[modifica | modifica wikitesto]
Con idrogeno il processo di deposizione richiede temperature tra 300 e 800 °C e porta alla formazione di vapori di fluoruro di idrogeno:
- WF6 + 3 H2 → W + 6 HF
La cristallinità degli strati di tungsteno prodotti si può regolare variando il rapporto WF6/H2 e la temperatura del substrato: rapporti e temperature bassi producono cristalliti di tungsteno con orientazione (100) mentre valori più elevati favoriscono l'orientazione (111). La formazione di HF è uno svantaggio, dato che HF vapore è molto aggressivo e incide la maggior parte dei materiali. Inoltre il tungsteno depositato ha scarsa adesione al diossido di silicio che è il principale materiale passivato usato nell'elettronica dei semiconduttori. Per questo motivo, SiO2 deve essere ricoperto con uno strato tampone addizionale prima della deposizione del tungsteno. D'altra parte, l'incisione chimica con HF può essere utile per rimuovere strati di impurezze.[3]
Silano e germano[modifica | modifica wikitesto]
Alta velocità, buona adesione e uniformità di ricopertura sono le caratteristiche della deposizione utilizzando WF6/SiH4. Gli svantaggi sono il pericolo di esplosione e la grande sensibilità della velocità di deposizione e della morfologia a parametri di processo come rapporto della miscela, temperatura del substrato, ecc. Per questo motivo il silano si usa in genere per creare un sottile strato di nucleazione di tungsteno. Si passa quindi all'idrogeno, che rallenta la deposizione e ripulisce lo strato.[3]
La deposizione con miscele WF6/GeH4 è simile a quelle con WF6/SiH4, ma lo strato di tungsteno è contaminato maggiormente dal germanio (rispetto al silicio). Il germanio può raggiungere concentrazioni del 10–15% e la resistenza del tungsteno cresce a valori di 5–200 µΩ·cm.[3]
Altri usi[modifica | modifica wikitesto]
WF6 può essere usato per produrre carburo di tungsteno.
Come gas pesante, WF6 può essere usato per moderare reazioni allo stato gassoso. Ad esempio, rallenta la cinetica della fiamma Ar/O2/H2 e ne riduce la temperatura.[12]
Sicurezza[modifica | modifica wikitesto]
WF6 è un composto molto corrosivo e attacca tutti i tessuti. L'esposizione nell'uomo dapprima colpisce occhi e apparato respiratorio causando irritazione, perdita della vista, tosse, eccessiva salivazione ed espettorato polmonare. A contatto con i fluidi corporei il gas forma acido fluoridrico che brucia la pelle e le mucose dell'apparato respiratorio. L'esposizione prolungata produce edema polmonare e può essere fatale. Non è considerato cancerogeno.[2]
Curiosità[modifica | modifica wikitesto]
Nel suo libro Zio Tungsteno, Oliver Sacks descrive come suo zio, grande appassionato del tungsteno e della sua chimica, gli avesse parlato dell'esafluoruro di tungsteno e della sua elevata densità. In occasione del suo 65º compleanno Sacks pensò di riempire un palloncino di WF6, ma si astenne dal farlo sapendo che a contatto con l'umidità atmosferica avrebbe reagito formando acido fluoridrico.[13] (Inoltre WF6 avrebbe reagito con la maggior parte dei materiali organici, gomma inclusa. Solo il Teflon sarebbe stato adatto allo scopo.)
Note[modifica | modifica wikitesto]
- ^ Qualiflow, Gas chart (PDF), su qualiflow.com. URL consultato il 16 maggio 2011.
- ^ a b Linde Gas, MSDS di WF6 (PDF), su orcbs.msu.edu. URL consultato il 3 luglio 2017 (archiviato dall'url originale il 12 febbraio 2010).
- ^ a b c d e f g h i E. Lassner, W.-D. Schubert, http://books.google.com/?id=foLRISkt9gcC&pg=PA168#v=onepage&q=, in Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds, Springer, 1999, pp. 111, 168, ISBN 0-306-45053-4.
- ^ TimeDomain CVD Inc., Tungsten and tungsten silicide chemical vapor deposition, su timedomaincvd.com. URL consultato il 17 maggio 2011.
- ^ T. W. Pernrice, Tungsten compounds, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- ^ D. R. Lyde (a cura di), CRC Handbook of Chemistry and Physics, 86ª ed., Boca Raton (FL), CRC Press, 2005, pp. 4-93, ISBN 0-8493-0486-5.
- ^ J. H. Levy, J. C. Taylor, P. W. Wilson, The structures of fluorides XIII: The orthorhombic form of tungsten hexafluoride at 193 K by neutron diffraction, in J. Solid State Chem., vol. 15, n. 4, 1975, pp. 360-365, DOI:10.1016/0022-4596(75)90292-3. URL consultato il 17 maggio 2011.
- ^ H. F. Priest, Anhydrous Metal Fluorides, in Inorg. Synth., vol. 3, 1950, pp. 171–183, DOI:10.1002/9780470132340.ch47. URL consultato il 17 maggio 2011.
- ^ N. N. Greenwood, A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- ^ J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, J. P. Cuer, Fluorine Compounds, Inorganic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005.
- ^ R. U. Kirss, L. Meda, <155::AID-AOC688>3.0.CO;2-Z Chemical vapor deposition of tungsten oxide, in Appl. Organomet. Chem., vol. 12, n. 3, 1998, pp. 155-160, DOI:10.1002/(SICI)1099-0739(199803)12:3<155::AID-AOC688>3.0.CO;2-Z. URL consultato il 17 maggio 2011.
- ^ P. Ifeacho, Semi-conducting metal oxide nanoparticles from a low-pressure premixed H2/O2/Ar flame: synthesis and characterization (Dissertazione, Università di Duisburg-Essen), Göttingen, Cuvillier, 2008, ISBN 3-86727-816-4.
- ^ O. Sacks, Zio Tungsteno, Milano, Adelphi, 2002, ISBN 978-88-459-2113-1.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Esafluoruro di tungsteno
Wikimedia Commons contiene immagini o altri file su Esafluoruro di tungsteno
