Colesterolemia

Per colesterolemia si intende la concentrazione del colesterolo nel plasma. Poiché il colesterolo, a causa della sua insolubilità in acqua, circola esclusivamente incorporato nelle lipoproteine plasmatiche, la colesterolemia viene distinta in colesterolemia totale (TC), colesterolemia LDL, colesterolemia non-HDL (TC - HDL) e colesterolemia HDL. Livelli elevati dei primi tre parametri sono considerati dannosi per la salute, mentre alla colesterolemia HDL è riconosciuto un ruolo protettivo. Il colesterolo non-HDL include VLDL, IDL e LDL; in generale i livelli plasmatici del colesterolo non-HDL corrispondono al valore delle LDL + 30 mg/dl.[1] Valori eccessivi di colesterolemia costituiscono uno dei maggiori fattori di rischio cardiovascolare (CV).
Valori di riferimento[modifica | modifica wikitesto]

I valori di riferimento (o valori normali) per i parametri medici vengono normalmente rilevati da un campione di persone sane. Del parametro rilevato si determinano la media aritmetica semplice m e la deviazione standard , una misura della dispersione dei singoli valori. Il valore di riferimento corrisponde di solito a m±2, valore che include circa il 97% della popolazione: in generale, l'intervallo di valori considerati normali è compreso tra il 2,5 percentile e il 97,5 percentile.[2] Il caso del colesterolo fa però eccezione.
Esempio: per l'intera popolazione tedesca è m=210, =30; perciò l'intervallo di valori normali sarà 210 +/- 60 ovvero da 150 a 270 mg/dl. Poiché questi valori "normali" sono eccessivamente alti, per la determinazione dei livelli ottimali di colesterolemia nella Consensus Conference del 1984 e nelle successive linee guida ATP (National Cholesterol Education Program Adult Treatment Panel) si è preferito seguire il criterio del rischio di malattia coronarica (coronary heart disease o CHD), per cui sono considerati elevati quei valori per i quali il rischio coronarico è elevato. Il Pschyrembel, la "bibbia" dei medici tedeschi, dà un valore di riferimento di TC da 115 a 220 mg/dl.[3]

Su raccomandazioni dell'organizzazione mondiale della sanità (OMS), i valori consigliati di colesterolemia nella popolazione generale sono:[4][5]
- colesterolemia totale <200 mg/dl (per i soggetti con più fattori di rischio cardiovascolare le varie linee guida indicano limiti più restrittivi)[6]
Numerosi studi epidemiologici (MRFIT, CARDIA, CHH, Progetto CUORE) hanno, infatti, dimostrato che, nella popolazione generale, la più bassa mortalità cardiovascolare si registra negli individui con TC <200 mg/dl, pressione arteriosa <120/80, indice di massa corporea (BMI) <25 Kg/m2, non fumatori e non diabetici.[7]
La valutazione dei livelli della colesterolemia secondo il Third Report of the National Cholesterol Education Program Adult Treatment Panel (NCEP ATP III) è riportata in tabella.[8]
Influenza di età, sesso e area geografica[modifica | modifica wikitesto]


I diversi parametri lipidici variano in base a età, sesso, etnia e area geografica.[9][10]
La colesterolemia totale (TC) aumenta in entrambi i sessi dalla nascita fino alla tarda infanzia, quindi subisce una modica riduzione durante l'adolescenza, per poi tornare a crescere nell'età adulta, fino a raggiungere un plateau dopo gli anni 50-55, seguito da una modesta diminuzione. I valori di TC sono superiori nell'uomo dai 20-25 anni fino a 50-55, prima e dopo sono più alti quelli delle donne.
Le LDL mostrano un incremento continuo con l'età, mentre le HDL subiscono più modeste variazioni.[11][12][13] Negli uomini, le HDL dopo l'adolescenza si abbassano a livelli costanti fino ai 50-65, quando subiscono un repentino innalzamento; nella donna, le HDL iniziano ad aumentare, con andamento gradualmente progressivo, dopo i 25 anni. I valori della colesterolemia HDL sono simili nei due sessi fino alla pubertà, poi sono più alti nel sesso femminile.[12][14]
Numerosi studi hanno dimostrato che le differenze nei livelli medi di colesterolemia tra le varie nazioni dipendono in larga misura dalla dieta,[15][16][17] dal momento che i migranti tendono ad assumere la stessa colesterolemia media del paese ospitante.[18][19] Non vanno, comunque, ignorate le possibili differenze genetiche tra le diverse popolazioni, come nel caso dei popoli scandinavi nei quali è prevalente l'apolipoproteina E4 (ApoE4), che comporta una colesterolemia più elevata, o degli Africani nei quali si registra una maggiore prevalenza delle mutazioni del gene PCSK9 (proprotein convertase subtilisin kexin 9).[20][21]
Colesterolemia e alimentazione[modifica | modifica wikitesto]
Contrariamente all'opinione comune, non è tanto il colesterolo introdotto con l'alimentazione ad aumentare la colesterolemia, quanto piuttosto il consumo di alcuni acidi grassi saturi (SFA) contenuti negli alimenti, anche se non tutti gli SFA agiscono nello stesso modo: quelli contenenti da 12 a 16 atomi di carbonio (C12:0-C16:0), in particolar modo l'acido laurico (C12:0) e l'acido miristico (C14:0), presente principalmente nel latte e derivati, aumentano il livello di LDL e di HDL, mentre l'acido stearico (C18:0) non ha questi effetti.[22][23]
Al contrario, gli acidi grassi cis-insaturi, sia acidi grassi monoinsaturi (MUFA) che polinsaturi (PUFA), abbassano i livelli plasmatici di LDL e di HDL.[24][25][26][23] Gli acidi grassi trans-insaturi (TFA) aumentano le LDL, diminuiscono le HDL e inibiscono l'assorbimento degli acidi grassi cis-insaturi, quali gli omega-3 che aumentano le HDL.[22][27][28] I TFA sono poco diffusi in natura: sono prodotti dai batteri presenti nel rumine (rTFA) di bovini e ovini (e per questo si trovano in piccole quantità nelle loro carni e nel loro latte), ma soprattutto si formano nel processo di idrogenazione industriale (iTFA) dei normali acidi grassi cis-insaturi (es. produzione di margarine). Di conseguenza i TFA della dieta provengono principalmente dai prodotti dolciari e dai condimenti salati di produzione industriale, sotto forma di oli vegetali parzialmente idrogenati (partially hydrogenated vegetable oil o PHVO). Gli studi clinici si sono concentrati soprattutto sugli iTFA.[29]
Le linee guida Dietary Guidelines for Americans (2010)[30] e quelle AHA/American College of Cardiology Guideline on Lifestyle Management to Reduce Cardiovascular Risk (2013)[31] raccomandano, al fine di ridurre l’incidenza di eventi cardiovascolari (CV), un apporto giornaliero di colesterolo <300 mg, di SFA pari al 5-6% delle calorie totali, con TFA a <1% delle calorie totali. Le raccomandazioni (2010) della FAO/WHO (Food and Agriculture Organization/World Health Organization) includono: consumo di grassi totali pari al 20-35% dell'apporto calorico giornaliero, SFA <10%, PUFA totali 6-11%, n-6 PUFA 2,5-9%, n-3 PUFA 0,5-2%, TFA <1%.
Di conseguenza è necessario limitare l’apporto di SFA, la cui fonte principale sono i grassi animali e, in misura minore, gli oli tropicali. La riduzione degli SFA della dieta comporta necessariamente la loro sostituzione con altri nutrienti, per cui non è sufficiente ridurre l’apporto di SFA, ma, a parità di calorie, è molto importante la scelta delle sostanze alimentari che andranno a sostituirli.[32] Rispetto ai carboidrati gli SFA aumentano il colesterolo totale (TC), LDL e HDL, senza significative differenze sul rapporto TC/HDL; rispetto agli SFA i PUFA abbassano TC, LDL e HDL, ma anche il rapporto TC/HDL, senza effetti sui trigliceridi.[33]
In una tipica dieta statunitense di 2000 calorie, l’apporto di SFA è di circa 24,5 g (circa l’11% delle calorie totali[34]), praticamente il doppio di quanto consigliato dalle linee guida, quello di MUFA è di 27 g (12% delle calorie) e quello di PUFA è di 16 g (7% delle calorie). A questo proposito è utile ricordare che i pesci grassi, come salmone, trota e aringa, nonché le noci sono particolarmente ricchi di PUFA e, in particolare, di n-6 PUFA. La sostituzione di 84 g di carne con un’equivalente quantità di salmone riduce di 8 g l’apporto di SFA e aumenta di 3 g quello di PUFA; la sostituzione di un cucchiaio da cucina (15 g) di burro con uno di soia riduce l’apporto di SFA di 5 g.[32]
Colesterolo alimentare[modifica | modifica wikitesto]

Gli effetti del colesterolo della dieta sulla colesterolemia sono complessi, per il fatto che la relazione tra questi due parametri è influenzata da numerosi fattori: composizione della dieta (contenuto in acidi grassi totali, SFA, MUFA e PUFA; fibre; fito- e sito-steroli; ecc.), consumo abituale medio di colesterolo (nei bassi consumatori l’assorbimento è maggiore), variazioni individuali nella capacità di assorbimento intestinale (iper- e ipo-assorbenti) e nella sensibilità della regolazione della sintesi endogena di colesterolo (iper- verso ipo-responders) (per maggiori dettagli vedi Colesterolo: assorbimento intestinale/biosintesi). Si spiegava così, fino agli novanta del XX secolo, il fatto che alcuni popoli che si nutrono prevalentemente di prodotti animali, come gli Inuit delle regioni polari o i Masai delle steppe africane, hanno colesterolemie minori rispetto a europei o statunitensi. L'adattamento di queste popolazioni a vivere in tali ambienti ha determinato comunque una pressione genetica atta a selezionare mutazioni che consentissero tale alimentazione (si veda il paradosso inuit).
Nel 15-25% della popolazione la soppressione della sintesi endogena è particolarmente marcata (soggetti iper-rispondenti) e la colesterolemia non aumenta con l'aumentare del consumo di colesterolo alimentare. Particolarmente iper-rispondente si è rivelata la popolazione dei Masai: la colesterolemia e la prevalenza dell’aterosclerosi sono basse nonostante che l'apporto di colesterolo possa raggiungere i 2000 mg/die per l’elevato consumo di prodotti derivati dagli zebù.[35]
Gli studi sperimentali in volontari, durante i quali è stata somministrata una quantità definita di colesterolo e sono stati misurati i livelli di colesterolemia, hanno registrato, almeno sino a 1000 md/die di colesterolo,[36] una relazione direttamente proporzionale tra colesterolo della dieta e colesterolemia.[37] Tuttavia, grazie ai meccanismi omeostatici che regolano l’assorbimento e la sintesi del colesterolo, mantenendoli quanto più possibile in equilibrio, l'incremento della colesterolemia rimane contenuto.

Secondo una metanalisi del 2001,[38] per ogni incremento di 100 mg/die di colesterolo dietetico, la TC aumenta in media soltanto di circa 2,2 mg/dl, sebbene le oscillazioni siano marcate,[35] il colesterolo LDL aumenta di 1,93/dl e quello HDL di 0,3 mg/dl e il rapporto TC/HDL aumenta di 0,02 unità. Un incremento della colesterolemia di queste proporzioni è relativamente modesto, se si considera che la colesterolemia totale normale oscilla intorno ai 200 mg/dl, ma non per questo è da ritenersi irrilevante: dai dati epidemiologici (sia pure con tutti i loro limiti) risulta che 1 mg/dl di aumento della colesterolemia totale innalza il rischio CV di circa l’1%.
Risultati simili ha ottenuto la meta-analisi di McNamara (2000), comprendente 167 studi dal 1960 al 1999 per complessivi 3519 individui. In essa per ogni 100 mg di colesterolo dietetico giornaliero si è verificato un aumento medio di 2,2 mg/dl di TC, di 1,9 mg/dl di LDL e di 0,4 mg/dl di HDL e un aumento del rapporto LDL/HDL di 0,01 unità.[39]
Una metanalisi del 1992 ha messo in evidenza come l'innalzamento della colesterolemia in risposta ai più elevati contenuti di colesterolo dietetico (>1000 mg/die) segua un andamento curvilineare, nel senso che la variazione della colesterolemia è progressivamente più contenuta.[40]
Sulla base di queste evidenze, il Dietary Guidelines Advisory Committee del 2015 afferma che non esistono apprezzabili relazioni tra consumo di colesterolo dietetico e colesterolemia.[41] Le raccomandazioni dell'American Heart Association Nutrition Committee (2006) prevedono comunque di limitare l'introito giornaliero di colesterolo a <300 mg,[42] mentre le linee guida Dietary Guidelines for Americans 2015-2020 consigliano il più basso consumo possibile di colesterolo.[43]
Altri grassi alimentari[modifica | modifica wikitesto]
Dagli studi sperimentali è emerso che la percentuale di calorie giornaliere assunte in forma di SFA è strettamente correlata con l'aumento della colesterolemia totale, LDL e HDL: sono state elaborate alcune equazioni (es. Keys, Hegsted) che permettono di calcolare le variazioni della colesterolemia in funzione del contenuto di SFA e PUFA della dieta.[44]
L'OMS, nel suo Food and health in Europe: a new basis for action[45] del 2004, sintetizza i risultati degli studi su colesterolo e alimentazione: gli SFA influiscono, anche se in maniera diversa a seconda della loro lunghezza, sul livello del colesterolo, aumentando le LDL e in minor misura le HDL.[46] Rispetto ai carboidrati gli SFA aumentano TC, LDL e HDL senza significative differenze sul rapporto TC/HDL.[33] In una metanalisi di studi clinici (Mensink, 2003), per ogni punto percentuale di apporto calorico sotto forma di SFA, il colesterolo LDL aumenta di circa 12.7–17.4 mg/l e quello HD di 4.3–5.0 mg/l.[26]

In particolare, sia gli SFA a catena corta (6:0-10:0) che quelli a catena lunga (18:0) hanno scarsi effetti sulla colesterolemia, mentre quelli a catena di lunghezza intermedia (12:0-16:0) hanno la massima influenza. Nel dettaglio:[47][32]
- l'acido laurico (C12:0), contenuto negli oli di piante tropicali e in piccole quantità nel latte, determina il massimo aumento delle LDL e delle HDL e riduce nettamente il rapporto TC/HDL;
- l'acido miristico (C14:0), contenuto nel latte vaccino intero (non scremato), è uno dei più forti stimolatori della produzione di LDL e riduce di poco il rapporto TC/HDL;
- l'acido palmitico (C16:0), contenuto nei grassi animali (carne, pesce e molluschi) e in oli di piante tropicali, e alcuni acidi trans-insaturi (C18:1n-9) sono forti stimolatori della produzione di LDL;[48][49]
- l'acido stearico (C18:0), contenuto nel grasso di manzo e nel lardo di suino, non aumenta il colesterolo LDL, possiede il più debole effetto sulle HDL e riduce modestamente il rapporto TC/HDL.[50]
L'aumento della concentrazione delle LDL indotto da questi SFA è dipendente sia da una maggiore produzione epatica di lipoproteine, sia soprattutto dalla downregulation dei recettori LDL.[44][51][52] Il mancato effetto degli SFA catena corta (<C10) è dovuto al fatto che essi sono assorbiti direttamente nel sangue portale senza essere prima incorporati nei chilomicroni; gli acidi grassi 18:0 sono invece desaturati e convertiti in 18:1.[23]
I TFA aumentano le LDL, riducono l'apporto di PUFA, soprattutto di omega-3, e, quindi, riducono indirettamente le HDL.[23][28] Tali grassi (principalmente l'acido elaidico C18:1n-9, derivato dall'acido linoleico) sono generati soprattutto nell'idrogenazione parziale dei grassi insaturi, processo utilizzato per la produzione di margarine industriali a partire da oli vegetali.
I PUFA e i MUFA abbassano i livelli delle LDL e hanno effetti modesti sulle HDL. In particolare l'effetto sulle HDL è tale che SFA > MUFA > PUFA.[44][23] Sebbene tutti gli SFA innalzino le HDL, l'effetto aumenta con il diminuire della loro lunghezza.[33] I PUFA riducono il rapporto LDL/HDL, mentre i MUFA hanno effetto ridotto o non hanno effetto.[53] È dunque la qualità dei grassi, e non il loro apporto totale, a determinare il rapporto LDL/HDL. Tuttavia anche un eccesso di PUFA può essere dannoso, in quanto i doppi legami sono altamente reattivi e, quando esposti all'aria e al calore, combinandosi con l'ossigeno, possono formare perossidi.
Studi osservazionali[modifica | modifica wikitesto]
Rispetto agli studi clinici, gli studi epidemiologici che prendono in esame ampie popolazioni sono, ovviamente, di interpretazione molto più complessa. In primo luogo per la difficoltà di definire con precisione la composizione quantitativa e qualitativa della dieta. A questo riguardo il gold standard (la metodica ottimale) per definire l'introito alimentare è rappresentato dalla registrazione di 4-7 giorni di dieta, ma più frequentemente si ricorre ai meno attendibili questionari o interviste telefoniche.
Ad esempio, il Ministero della Salute tedesco, tra il 1987 e il 1988, ha condotto uno studio epidemiologico di tipo osservazionale (studio di popolazione), il Verbundstudie Ernahrungserhebung und Risikofaktoren-Analytic (VERA) o Nutrition Survey and Risk Factor Analysis Study, che ha preso in esame le abitudini nutrizionali e ha effettuato rilevazioni antropometriche ed ematochimiche. Lo studio VERA (1993), che ha riguardato circa 2000 individui adulti, non ha rilevato alcuna correlazione significativa tra contenuto abituale di colesterolo nella dieta (latte, panna, uova, burro, grassi animali ecc.) e colesterolemia.[54]
Colesterolo e acidi grassi della dieta e rischio CHD[modifica | modifica wikitesto]
Gli studi epidemiologici tesi a rilevare le influenze del contenuto in colesterolo della dieta sulla mortalità CHD hanno fornito dati contrastanti e ciò è legato sia alle interferenze dovute ad altri componenti della dieta (SFA, fibre) sia agli effetti relativamente modesti del colesterolo della dieta sulla colesterolemia, come evidenziato dalle metanalisi di Weggemans e di McNamara riportate sopra.[55]
Anche gli studi epidemiologici prospettici finalizzati a definire la relazione tra SFA della dieta e CHD non hanno permesso di ottenere conclusioni univoche.[56] Neppure due importanti metanalisi hanno trovato un’associazione significativa tra SFA e CHD;[56][57] tuttavia nessuna di esse ha considerato i macronutrienti che erano assunti in sostituzione degli SFA.
Dall'esame di una serie di studi clinici è emerso che la sostituzione degli SFA con PUFA riduce la mortalità da CHD, mentre la sostituzione con carboidrati raffinati non ottiene significativi vantaggi e incerti sono i benefici di una sostituzione con MUFA.[32] Una metanalisi (Pooling Project of Cohort Studies on Diet and Coronary Disease) di 11 studi osservazionali prospettici, comprendente circa 345.000 individui adulti di entrambi i sessi seguiti per 4-10 anni, ha preso in considerazione gli alimenti assunti in alternativa agli SFA. Questo lavoro ha rilevato come l’apporto dietetico di SFA sia associato a un più elevato rischio CHD rispetto ai PUFA, ma non rispetto ai carboidrati o ai MUFA; anzi la sostituzione degli SFA con i carboidrati rifiniti comporta un maggiore rischio CHD.[58] È stato calcolato che la sostituzione del 5% dell’introito calorico come SFA con un’equivalente quantità di PUFA può ridurre gli eventi CV del 13%, mentre la sostituzione con carboidrati raffinati ne causa un aumento del 7%.[58]
Nei 25 anni dello studio policentrico Seven Countries Study (vedi sotto "I grandi studi trasversali") il contenuto in SFA della dieta era fortemente correlato alla mortalità CHD, mentre lo erano in minor grado i MUFA e il colesterolo. Tuttavia, nello studio, a parità di colesterolemia la mortalità CHD presentava notevoli differenze fra le diverse popolazioni.
La relazione tra dieta e colesterolemia spiega solo in parte gli effetti della dieta sulla mortalità CHD. È anche da considerare che a un dato valore di colesterolemia totale corrispondono differenze nel numero di particelle LDL e differenti livelli di LDL ossidate (le vere responsabili dell'aterosclerosi) e che differenze qualitative e quantitative nella composizione della dieta potrebbero avere notevole influenza sul grado di ossidazione delle LDL (es. le vitamine antiossidanti C, E e beta-carotene oppure i flavonoidi). La dieta mediterranea[59] e quella giapponese, a basso contenuto di SFA e ricche di antiossidanti e PUFA, oltre a un effetto diretto sui livelli delle LDL, potrebbero avere azioni favorevoli sia sulla loro ossidazione che sulla trombogenesi. Naturalmente, oltre alla dieta, altri fattori, ambientali e genetici, hanno un ruolo nel creare le differenze di mortalità CHD tra le varie popolazioni.
A queste considerazioni va ricondotto il cosiddetto "paradosso francese": la relativamente bassa incidenza di CHD in Francia rispetto ad altri paesi industrializzati con simile introito dietetico di SFA e colesterolo. Questo apparente contrasto è stato definito il "paradosso francese" (anche se è stato rilevato in altri paesi). Sebbene non si abbia certezza sulle cause di tale discrepanza, sono state invocate abitudini dietetiche, quali un consistente consumo di vegetali e un'assunzione di quantità moderate di vino rosso.
Colesterolemia e stress[modifica | modifica wikitesto]
Esiste una teoria secondo la quale fattori psicologici, in particolare lo stress emotivo, influenzerebbero la colesterolemia. I suoi sostenitori affermano che avrebbe un ruolo l'aumento di ormoni e neurormoni, come catecolamine (adrenalina e noradrenalina) e cortisolo.[60][61][62] Le catecolamine e il cortisolo stimolano la lipolisi nel tessuto adiposo e in questo modo aumentano l'apporto di acidi grassi liberi (FFA) al fegato e la sintesi epatica di VLDL.[63][64] Il cortisolo stimola la sintesi epatica del colesterolo e inibisce l'attività dei recettori LDL epatici (il che fa aumentare la colesterolemia e peggiora la relazione LDL/HDL).[65][66]
Colesterolemia e rischio cardio-vascolare[modifica | modifica wikitesto]
Nella trattazione del rapporto tra colesterolemia e malattie cardiovascolari è necessario tenere distinti due livelli: il livello di popolazione e il livello individuale.
Il rischio cardio-vascolare di popolazione[modifica | modifica wikitesto]
Sono stati gli studi osservazionali a documentare, a livello di popolazione, la relazione positiva tra colesterolemia totale (TC), colesterolemia LDL e la mortalità per malattie cardiache e per malattie vascolari.
L'associazione è particolarmente stretta per la cardiopatia ischemica (CHD o CAD) con una relazione di tipo esponenziale: col crescere di TC la mortalità CHD aumenta sempre di più di quanto incrementino i livelli di colesterolo. L'importanza di TC come fattore di rischio si riduce con l'età, nel senso che, a parità di colesterolemia, il numero di morti da CHD nella fascia più alta di età è proporzionalmente minore rispetto alla fascia di età più bassa (rischio relativo), anche se il numero assoluto di morti è, ovviamente, superiore per i soggetti più vecchi (rischio assoluto).
Nella metanalisi PSC (Prospective Studies Collaboration) i valori del colesterolo non-HDL e ancora di più quelli del rapporto TC/HDL si sono rivelati indici di rischio di mortalità CHD più sensibili rispetto a TC.[67]
La relazione con TC si mantiene positiva per lo stroke (ictus) ischemico dovuto ad aterosclerosi delle grandi arterie, mentre è più debole o assente per lo stroke ischemico lacunare (stroke delle piccole arterie) e per quello embolico. La correlazione è, invece, inversa per lo stroke emorragico: la bassa colesterolemia è un fattore di rischio per lo stroke emorragico.[68]
Per quanto riguarda il rapporto tra mortalità cardiovascolare (CV) e TC, dalla metanalisi di Jacobs (1992) è emersa una correlazione a J, con un aumento netto della mortalità per i valori più alti di TC e un aumento modesto per i valori più bassi.[69] Nella più recente metanalisi PSC per la mortalità vascolare, stroke e CHD esclusi, è stata rilevata una modesta correlazione a J solo al di sotto dei 70 anni, che comunque scompare se vengono esclusi dall'analisi i primi 5 anni degli studi esaminati.[67]
Nella metanalisi PSC la mortalità da tutte le cause non-vascolari è correlata negativamente con TC (più è alto il colesterolo totale, minore è la mortalità da cause diverse da quelle vascolari), anche se si specifica che questa correlazione negativa può essere largamente o totalmente non causale.
Nella metanalisi di Jacobs la correlazione tra mortalità totale (da tutte le cause, incluse quelle CV) e TC assume nel sesso maschile un andamento a U: cioè la mortalità totale aumenta sia per i valori più bassi di TC, sia per quelli più alti (vedi paragrafo 'i possibili pericoli per la salute della bassa colesterolemia'); in particolare la mortalità totale negli uomini era del 15-20% superiore sia per i valori di TC <160 mg/dl che per quelli >240 mg/dl rispetto ai valori di 160-199 mg/dl. Simile correlazione è risultata in altri studi, in particolare nel MRFIT (vedi sotto).[70][71]
Per quanto riguarda la fascia di popolazione ultrasessantenne è stata osservata una correlazione inversa tra TC e mortalità totale e una relazione a U o inversa tra TC e mortalità CHD:[72][73][74] come dimostrato nella metanalisi PSC, nei soggetti di età >70 anni la colesterolemia totale perde parte della sua importanza come fattore di rischio CV.
In conclusione, sempre tenendo presente che gli studi epidemiologici osservazionali non consentono di trarre conclusioni certe sui rapporti causa-effetto tra i fenomeni esaminati, le correlazioni statistiche individuate suggeriscono che:
- valori elevati di TC, di LDL e il rapporto TC/HDL sono correlati positivamente con la mortalità dovuta a malattie cardiovascolari su base aterosclerotica (prevalentemente infarto del miocardio e ictus ischemico)
- la mortalità CHD cresce all'aumentare dei livelli di colesterolemia, senza che possa essere identificato un valore soglia
- la colesterolemia corrispondente alla minima mortalità CHD è più alta nelle donne (200-240mg/dl) che negli uomini (160–200 mg/dl)
- valori ridotti di TC, sotto una certa soglia, sono correlati con una più elevata mortalità per cause accidentali (es. suicidi) e per altre malattie (es. cancro polmonare, ictus emorragico); anche se la natura di tale relazione è fortemente discussa (vedi sotto)
- Prospective Studies Collaboration. Rapporto esponenziale tra rischio di mortalità per CHD e colesterolemia totale per fascia di età. Corretto per sesso. HR = Hazard Ratio.
- Relazione tra colesterolo e mortalità CV. Nella metanalisi PSC la scala è di tipo esponenziale e dalla mortalità CV sono esclusi stroke e CHD.
- Relazione tra colesterolemia totale e rischio di morte da tutte le cause nella metanalisi di Jacobs.
- Relazione tra mortalità per malattia coronarica (CHD) e colesterolemia totale nello studio MRFIT. RR = Rischio Relativo. 1 millimole (mmol) di colesterolo pesa 38,667 mg.
- Relazione tra colesterolemia totale e mortalità: coronarica (CHD), cardiovascolare (CV) e Totale nello studio MRFIT.
Sono stati condotti anche alcuni studi epidemiologici di carattere autoptico (Stary e McGill), dai quali è emersa una correlazione positiva tra colesterolemia e gravità ed estensione delle lesioni aterosclerotiche avanzate, mentre tale correlazione non esiste per le strie lipidiche (vedi Aterosclerosi).
Anche se vi sono numerose evidenze sull'esistenza negli adulti di una relazione positiva tra colesterolemia e CHD, sulla base dei soli studi epidemiologici osservazionali non è possibile trarre la conclusione che "basta abbassare la colesterolemia per ridurre il rischio di infarto cardiaco". Una tesi del genere non può in nessun caso essere sostenuta da uno studio epidemiologico osservazionale. Il fatto che da questo tipo di studi risulti che una colesterolemia bassa sia associata a una bassa mortalità coronarica non comporta automaticamente che abbassando una colesterolemia alta si riduca la mortalità. Per poter giungere a una simile conclusione sono stati necessari studi di intervento terapeutico, randomizzati, in doppio cieco e placebo-controllati (RTC o randomized clinical trials), che hanno valutato come obiettivo finale principale (endpoint primario) l'effetto a lungo termine di una terapia (farmacologica o di altro tipo) sulla mortalità totale e cardiovascolare e sui singoli eventi cardiovascolari, fatali e non.
Da una metanalisi di trials RTC di durata di almeno 2 anni e con almeno 1000 partecipanti ciascuno è risultato che, nei circa 170.000 soggetti esaminati nei 26 studi considerati, per ogni mmol (38,7 mg) di riduzione terapeutica di colesterolo LDL si ottiene una diminuzione di circa il 20% di eventi, fatali e non, di cardiopatia ischemica, rivascolarizzazione coronarica e ictus ischemico, mentre la mortalità totale si riduce del 10%; nessun effetto si osserva, neanche a concentrazioni molto basse di LDL, sulla mortalità per cancro o per cause non vascolari.[75]
Alcune domande attendono risposta definitiva:
- la colesterolemia può concorrere allo sviluppo di altre malattie, oltre a quelle cardiovascolari su base ischemica, come, per esempio, cancro della prostata[76][77][78] o Alzheimer?[79][80]
- per quali motivi (oltre al ruolo protettivo degli estrogeni) nelle donne il rischio coronarico è correlato con valori di colesterolemia totale più alti che negli uomini?
HDL e rischio CV[modifica | modifica wikitesto]
Le lipoproteine ad alta densità (HDL) hanno la funzione di rimuovere l'eccesso di colesterolo dai tessuti e di riportarlo al fegato (trasporto inverso del colesterolo), dove può essere riutilizzato o eliminato dall'organismo attraverso la bile. Questa è una delle proprietà (non la sola) per cui le HDL svolgono un'azione protettiva nei confronti dell'aterosclerosi, azione che è ha avuto una conferma dagli studi epidemiologici, dai quali è emerso un rapporto inverso tra livelli plasmatici di HDL e di malattie cardiovascolari (CV). Da alcuni studi epidemiologici risulta che l'aumento di 1 mg/dl di colesterolo HDL riduce il rischio CV del 2-3%.[81][82]
Oltre a rimuovere il colesterolo dalle cellule dei tessuti extraepatici, le HDL esplicano infatti un'attività antiaterogena attraverso azioni anti-ossidanti, anti-apoptosiche e anti-infiammatorie.[83]


Durante l'undicesimo esame biennale del Framingham Study, in 1023 uomini e 1434 donne, liberi da CHD, sono state misurate le concentrazioni sieriche di LDL, HDL, colesterolo totale (TC) e trigliceridi.[84] Considerato isolatamente il livello delle HDL è il singolo parametro lipidico più specifico, mentre il rapporto tra TC e HDL è risultato la variabile lipidica più specifica, nell'individuare gli individui a rischio CHD, di quanto non lo fossero TC o le LDL. Il rischio CHD aumenta, per qualsiasi valore di colesterolemia, con il crescere del rapporto TC/HDL: tanto più il rapporto è favorevole alla prima, tanto più alto è il rischio CV. Il rapporto ottimale TC/HDL è non superiore a 5 per gli uomini e a 4,5 per le donne. Questo fatto è ben documentato da studi epidemiologici recenti, che non focalizzandosi solo su uno dei due tipi di colesterolo, guardano alla loro percentuale relativa e al colesterolo LDL. L'unione dei due parametri consente una buona predittività del rischio di malattie cardiovascolari,[22] come, per esempio, risulta dal followup a 14 anni del Lipid Research Clinics Prevalence Study.[85]
Il rischio individuale di cardiopatia ischemica[modifica | modifica wikitesto]

Nonostante la stretta correlazione tra colesterolemia totale e mortalità per CHD emersa dagli studi longitudinali, i soli valori di colesterolo totale, a livello individuale, non rappresentano un indice sufficiente per individuare i soggetti a rischio di malattia coronarica, per il fatto che si tratta di una patologia dovuta al concorso di molteplici fattori eziopatogenetici, nessuno dei quali preso singolarmente ha un valore predittivo soddisfacente. Infatti, dallo studio di Framingham è emerso che le curve di distribuzione della colesterolemia, rispettivamente per gli uomini che sviluppano coronaropatia nel corso dei primi 16 anni dello studio e per quelli che ne rimangono esenti, mostrano una notevole sovrapposizione nell'ambito dei livelli di colesterolo totale compresi tra 150 e 300 mg/dl. Inoltre, circa la metà degli eventi coronarici si sono manifestati nei soggetti con colesterolemia <240 mg/dl: soltanto il 41% degli eventi CHD negli uomini e il 61% nelle donne di età 35-64 erano associati a valori pari o superiori a 240 mg/dl.
Nel tentativo di individuare markers più sensibili per valutare il rischio CHD, l'attenzione è stata rivolta allo studio dell'intero profilo lipidico. Quando i livelli di colesterolo totale sono al di sotto di 240 mg/dl, il rischio varia ampiamente in dipendenza dei valori delle HDL sieriche. Comunque anche questo marker lipidico risulta insoddisfacente per la determinazione del rischio cardiovascolare e la sua valutazione deve tener conto dell'insieme dei fattori di rischio (rischio globale) presenti nel soggetto in esame.
Sulla base di queste considerazioni appare evidente che sono necessari markers più specifici che non la sola colesterolemia, per determinare il rischio di CHD, così da evitare, in base ai livelli di colesterolo, di allarmare inutilmente soggetti che siano apparentemente a rischio elevato di CHD (falsi positivi) o, al contrario, di rassicurare falsamente individui più a rischio (falsi negativi). La stesura di carte di rischio globale, che tengono conto di un numero maggiore di fattori di rischio, assicura una migliore sensibilità nella valutazione del rischio CHD (vedi valori ottimali di colesterolemia), mentre studi epidemiologici condotti negli ultimi decenni sono stati indirizzati verso la ricerca di nuovi markers.
Linee guida per la prevenzione cardiovascolare e il trattamento della colesterolemia[modifica | modifica wikitesto]
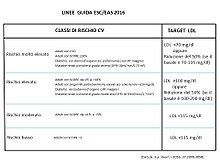

Tutte le esistenti linee guida per la prevenzione delle malattie cardiovascolari (CVD, cardiovascular diseases) prevedono la determinazione del rischio cardiovascolare (CV) individuale mediante l'utilizzo di apposite tabelle che prendono in considerazione diversi fattori di rischio CV (RF, risk factors).
Le maggiori linee guida europee sono quelle redatte dalla Società Europea di Cardiologia (ESC) e dalla Società Europea dell'Aterosclerosi (EAS). Le linee guida ESC/EAS del 2016 indicano, per ciascuna categoria di rischio CV, il target di colesterolo LDL cui deve tendere la terapia ipocolesterolemizzante (statine).[6] Il rischio CV è calcolato sulla base delle tabelle SCORE (Systemic Coronary Risk Estimation).[86] Le linee guida ESC/EAS introducono anche la nuova categoria di 'soggetti a rischio molto elevato'.

Le linee guida americane del 2013, elaborate dall'American College of Cardiology (ACC) e dall'American Heart Association (AHA), presentano un’impostazione molto differente sia dalle linee guida ESC/EAS, sia dalle raccomandazioni dell’ATP III (National Cholesterol Education Program Adult Treatment Panel III) del 2002.[87] La differenza maggiore si riconosce nella mancata indicazione di un target di LDL. Basandosi sulla constatazione che gli studi RTC non hanno mai considerato, come endpoint, un valore target di LDL, ACC e AHA preferiscono indicare le categorie di individui per i quali è raccomandata una terapia ad alta, moderata o bassa intensità di statine. Le linee guida ACC/AHA si basano esclusivamente su studi clinici randomizzati e controllati datati dal 1995 in poi; al contrario, quelle ESC/EAS si basano sia sui RTC datati a partire dagli anni 60 sia sugli studi epidemiologici. Nelle linee guida ACC/AHA, per il calcolo del rischio CV individuale, viene preso in considerazione il New Pooled Cohort Equations Risk Calculator (PCERC).[88] Questo sistema differisce dallo SCORE soprattutto per il fatto di includere il diabete e di estendere la previsione a 10 anni agli eventi CV fatali e non, mentre lo SCORE da una parte considera il diabete estraneo alla prevenzione primaria, dall'altra limita la previsione agli eventi CV fatali.
Le linee guida NICE (National Institute for Health and Care Excellence) del Regno Unito utilizzano le tabelle del sistema QRISK2, basate sul database inglese.[89]
I possibili pericoli per la salute della bassa colesterolemia[modifica | modifica wikitesto]
Nonostante l'enorme mole di dati a favore dell'importanza della elevata colesterolemia come fattore di rischio CV diverse pubblicazioni contestano l'importanza che gli studi epidemiologici assegnano al colesterolo come fattore di rischio.[90][91][92][93] Immich[94] si è dedicato allo studio di Framingham e ha notato, nel 1997, che questo studio parlava già negli anni sessanta di nessuna correlazione statisticamente significativa tra colesterolemia totale e sclerosi coronaria. Si è però evidenziato nei paragrafi precedenti come il rischio CV sia correlato soprattutto con le LDL e con il rapporto LDL/HDL e si ridimensioni nell'età avanzata.
Più controversa è stata la relazione tra colesterolemia e mortalità totale, mortalità per neoplasie, mortalità per suicidi e incidenti.
Gli studi epidemiologici hanno rilevato spesso, ma non sempre, una correlazione ad U tra mortalità totale e colesterolemia, in quanto è stato registrato un aumento della mortalità totale sia per i valori più elevati di colesterolemia, sia per quelli più bassi, suscitando incertezze sulla opportunità di intervenire con la terapia troppo drasticamente sulla colesterolemia. In alcuni studi è anche emersa una correlazione positiva tra bassa colesterolemia e morte per cause non-vascolari, neoplasie o suicidi. Trattandosi di studi epidemiologici, questi dati attestano una possibile relazione tra gli eventi, senza tuttavia indicare di che tipo essa sia, tanto meno possono dimostrare una relazione causa-effetto. Se esistono dubbi sul "pericolo" di una bassa colesterolemia "naturale", completamente diverso è il discorso della bassa colesterolemia ottenuta con il trattamento terapeutico.
A titolo di esempio, si può prendere in considerazione lo studio Norvegian HUNT2, che si è posto l'obiettivo di valutare la validità delle attuali linee guida sulla prevenzione CV attraverso l'esame delle relazioni tra TC e mortalità totale, CV e CHD nella popolazione norvegese, arruolando oltre 52.000 individui di entrambi i sessi, di età compresa fra i 20 e 74 anni ed esenti da malattie CV.[93] Dallo studio del 2012, è emerso che fra i maschi la mortalità totale e quella CV sono maggiori sia nei soggetti con più alti valori TC che in quelli con i valori più bassi (cosiddetta, correlazione ad U). Nel gruppo femminile vi è una relazione inversa tra livelli di TC e mortalità totale e CV e una relazione ad U per la mortalità coronarica: questi dati contraddicono l'assunto di una correlazione continuamente positiva tra colesterolemia totale e mortalità CV. Tuttavia, per l'interpretazione dei dati, devono essere tenute in considerazione le caratteristiche individuali e sociali del campione: lo studio Norvegian HUNT2 prende in esame una popolazione etnicamente omogenea, considera unicamente il colesterolo totale, include un numero importante di soggetti di età <35 anni (quindi a basso rischio di mortalità) e non ha valutato l'eventuale uso di terapie preventive (es. antidislipidemici). In conclusione, gli autori ritengono che l'importanza attribuita alla colesterolemia totale possa essere sovrastimata e che sia più opportuno che le linee guida prendano in considerazione solo la mortalità coronarica e che TC venga sostituito con altre frazioni lipoproteiche o con il rapporto TC/HDL, peraltro parametri già in uso.
Particolarmente significativo è uno studio policentrico italiano limitato a 4521 soggetti anziani (65-84 anni). Il quartile con TC <189 mg/dl (4.90 mmol/l) ha mostrato il più alto rischio di mortalità totale; rispetto a questo, i quartili con TC >189 mg/dl hanno fatto registrare una riduzione di circa il 50% del rischio di mortalità totale.[72] Risultati simili ha fornito uno studio svedese in individui ultrasessantenni (età media 73 anni).[74]
Il vastissimo Austrian Vorarlberg Study, condotto sulla popolazione della omonima provincia austriaca, ha fornito informazioni su circa 150.000 abitanti: i più bassi livelli di TC erano associati con la più alta mortalità totale sia negli uomini che nelle donne >50 anni.[95]
Nella metanalisi di Jacobs (1992),[69] gli uomini e, in minor misura le donne, con concentrazioni plasmatiche di TC <4,2 mmol/l (<160 mg/dL) o >6,2 mmol/l (>240 mg/dl) mostravano un aumento della mortalità totale di circa il 14%-20% rispetto ai soggetti con valori compresi tra 4,2 e 5,2 mmol/L (160–199 mg/dL) (correlazione a U). Nella stessa metanalisi, il rischio di mortalità CV negli uomini, rispetto alla classe di riferimento 160-199 mg/dl (pari a un rischio = 1), era di 1,5 per la classe >240 mg/dl e 1,04 per la classi <160 mg/dl (correlazione a J); nel sesso femminile il rischio di morte CV non variava entro l'intero range di valori TC considerati.
La più recente metanalisi del Prospective Studies Collaboration (2007), che ha preso in esame 61 studi prospettici osservazionali (circa 900.000 individui), ha confermato una debole associazione a J per la mortalità CV (escluso infarto e stroke) tra i 40 e i 70 anni (ma non oltre gli 80 anni) e ha registrato l'associazione inversa tra livelli di TC e mortalità non-CV.[67] Tale relazione negativa si presentava più debole se venivano esclusi dall'analisi i primi 5 anni degli studi, come, del resto, risulta anche da numerosi lavori clinici sulla correlazione tra cancro e bassa colesterolemia.[96][97] In questi ultimi il rapporto negativo tra bassi valori di colesterolo e cancro è evidente soprattutto nei primi anni, per poi indebolirsi o scomparire: la spiegazione ipotetica spesso avanzata è che la bassa colesterolemia possa sottendere un cancro subclinico che si manifesterebbe appunto nei primi anni degli studi, anche se non si può escludere l'intervento di altri fattori confondenti.
Sebbene il problema sia reale e ancora irrisolto, l'eccesso di mortalità totale, mortalità non-vascolare e mortalità per cancro potrebbe essere parzialmente spiegato dalla preesistenza, al basale, di malattie subcliniche e dalla coesistenza di altri fattori aggressivi sconosciuti o non misurati, correlati sia alla bassa colesterolemia che alla mortalità.[98][99][100] Ad esempio, nello studio prospettico Honolulu Heart Program, condotto su circa 8000 uomini di ascendenza giapponese, residenti a Oahu (Hawaii), nel follow-up a 16 anni, nei soggetti in cui la colesterolemia si era ridotta dai livelli medi a quelli bassi, vi era un aumento della mortalità totale e un maggior numero di morti per alcuni tipi di cancro e per malattie epatiche, mentre nei soggetti che avevano mantenuto una bassa colesterolemia stabile, tale eccesso di mortalità non era riscontrabile; dopo 23 anni di follow-up, negli individui con colesterolo totale <180 mg/dl, in assenza di elevato consumo di alcool, di fumo e di ipertensione la bassa colesterolemia non era associata né alla mortalità totale né a quella per cancro.
Alcune interpretazioni sono state formulate per spiegare la relazione bassa colesterolemia-eventi avversi:
- un ruolo causale della bassa colesterolemia nei confronti di patologie non legate all'aterosclerosi
- l'esistenza di patologie, cancro in particolare, in fase preclinica che possano provocare una riduzione della colesterolemia (causalità inversa)
- presenza di fattori sconosciuti che possano agire sia sulla colesterolemia che sulle patologie non aterosclerotiche.
Queste ultime due sono le ipotesi più accreditate.
Tali preoccupazioni sono state avallate anche dagli studi clinici di prevenzione primaria condotti prima del 1994 (anno della pubblicazione del 4S), dai quali è frequentemente emersa, nei soggetti trattati, sia una maggiore incidenza di cancro che un maggior numero di morti violente. In particolare le morti violente e accidentali sono risultate elevate nei gruppi in trattamento attivo degli studi Lipid Research Clinics Coronary Primary Prevention Trial (colestiramina, 1984) e Helsinki Heart Study (gemfibrozil, 1987).
La risposta migliore a questi dubbi è venuta dai recenti studi clinici con le statine (vedi sotto), non solo perché esse hanno permesso di raggiungere una riduzione percentuale della colesterolemia più che doppia rispetto ai trattamenti precedenti, ma anche perché si è trattato di studi di grandi dimensioni che hanno avuto la potenza statistica di evidenziare le differenze nell'incidenza della mortalità. Gli studi con le statine hanno dimostrato che, in soggetti ad alto rischio cardiovascolare, valori anche molto bassi di LDL (70–80 mg/dl) si accompagnano a riduzione degli eventi CV, senza che la mortalità totale e per cancro aumenti oppure, come nel caso dello studio HPS, facendo registrare una diminuzione della mortalità totale.[101][102][103] Resta da chiarire se questi risultati dipendano dalla sola riduzione della colesterolemia o invece dall'azione pleiotropica delle statine o dall'insieme dei due fattori (vedi ipercolesterolemia).
L'ipertensione è il più importante fattore di rischio conosciuto per tutti i tipi di stroke (ictus). Il fumo è un fattore di rischio per lo stroke ischemico e per l'emorragia subaracnoidea, mentre è meno chiara l'associazione con l'emorragia cerebrale. Per quanto riguarda il colesterolo, vi è una correlazione positiva tra colesterolemia e stroke ischemico e una correlazione negativa tra colesterolemia e stroke emorragico: il rischio di ictus emorragico aumenta al diminuire della colesterolemia. A questo proposito va sottolineato che la terapia ipocolesterolemizzante con statine ha ridotto l'incidenza dell'ictus ischemico, mentre non ha avuto effetti significativi (né positivi, né negativi) su quello emorragico.
Studi epidemiologici[modifica | modifica wikitesto]
Gli studi epidemiologici possono essere distinti in studi osservazionali e studi di intervento o sperimentali, i primi possono ulteriormente essere classificati, in base alla metodologia adottata, in: studi descrittivi; studi trasversali o di prevalenza; studi retrospettivi o di casi di malattia; studi longitudinali o prospettici o di coorte.
Gli studi longitudinali sono studi epidemiologici che prendono in esame uno o più gruppi di individui, seguendoli con esami periodici per un periodo di tempo piuttosto lungo. Gli studi prospettici sono stati ideati alla fine degli anni 40, nel tentativo di identificare le cause delle malattie croniche emergenti (malattie cardiovascolari e cancro), che si andavano affiancando prepotentemente alle malattie infettive, in primo luogo tubercolosi e sifilide. Questo tipo di studi permette di prendere in considerazione un numero notevole di caratteristiche (es. peso, pressione arteriosa, parametri ematochimici, dati elettrocardiografici, dieta, abitudini di vita, come attività fisica e fumo, tipo di occupazione) e di registrarne le variazioni e gli effetti finali nel tempo. Grazie ad essi si è giunti all'identificazione di alcuni importanti fattori di rischio per la cardiopatia ischemica, tra i quali l'elevata colesterolemia è uno dei più importanti (vedi Aterosclerosi). Si parla di fattori di rischio e non di fattori eziologici (cause) proprio perché gli studi epidemiologici non sono sperimentazioni scientifiche: il loro ruolo è limitato alla identificazione di associazioni naturali tra alcune caratteristiche e lo stato di malattia considerato, senza fornire informazioni sulla natura di tale associazione. La loro importante funzione è quella di formulare ipotesi da verificare con successive sperimentazioni scientifiche.
Gli studi epidemiologici che confrontano tra loro gruppi (popolazioni) diversi di individui (studi trasversali) hanno un limite tanto maggiore quanto più disomogenei sono i gruppi presi in esame. La disomogeneità è massima quando si prendono in considerazione popolazioni di nazioni differenti, a causa dei numerosi "fattori confondenti" (razza, abitudini alimentari e stile di vita, condizioni ambientali, livello di sviluppo sanitario, metodologia di rilevazione dei dati e di misurazione dei parametri presi in esame dallo studio, ecc.). Nonostante ciò dall'esame di tali studi emerge che nei singoli paesi esiste una correlazione positiva tra colesterolemia e mortalità per cardiopatia ischemica, nel senso che anche nei paesi dove la mortalità per cardiopatia ischemica è relativamente bassa esiste una relazione positiva tra valori di colesterolemia e mortalità per malattia coronarica, come attestato anche dagli studi prospettici internazionali, come il Seven Countries Study[104] e lo studio di Shanghai su un campione di circa 9000 cinesi di entrambi i sessi, seguiti per 8-13 anni (1991). Tuttavia, proprio per la natura multifattoriale della CHD e per la presenza di numerosi fattori confondenti, a parità di colesterolemia la mortalità mostra ampie differenze fra i diversi paesi.
I dati provenienti dallo studio trasversale MONICA illustrano bene questo aspetto. Il WHO MONICA Project Health Organization Multinational Monitoring of Trends and Determinants in Cardiovascular Disease Project (MONItoring of CArdiovascular diseases) è uno studio iniziato nel 1981 con lo scopo di rilevare l'andamento della patologia cardiovascolare e i rispettivi fattori di rischio in 38 differenti popolazioni di 21 nazioni in quattro continenti durante un periodo di 10 anni, interessando una popolazione totale di circa 13 milioni di uomini e donne di età compresa tra 35 e 64 anni (facoltativamente anche tra 25 e 35 anni). I dati demografici sono presi dai registri ufficiali e dai censimenti, mentre le informazioni sui fattori di rischio sono state ottenute da campioni delle popolazioni esaminate, effettuando due o tre screening per i fattori di rischio, in primo luogo pressione arteriosa, colesterolemia e fumo, e per molte altre caratteristiche (come il livello culturale): il primo all'inizio dello studio, il secondo verso la metà e l'ultimo al termine dei dieci anni. Inoltre sono stati effettuati due o tre screenings del trattamento dell'infarto miocardico acuto. Nel 1994 il WHO/MONICA Project ha completato la sua osservazione decennale. Più di 300.000 uomini e donne sono stati esaminati durante gli screenings e sono stati registrati 166.000 infarti del miocardio.
Le località italiane partecipanti allo studio sono state Montegiorgio, in Italia Centrale, e Crevalcore, nel Nord Italia. Nei diversi paesi coinvolti nello studio MONICA, a fronte di valori simili di colesterolemia totale si riscontrano variazioni molto ampie della mortalità da CHD. Negli uomini, gli eventi coronarici fatali e non-fatali, registrati all'inizio dello studio (1985-1987), standardizzati per l'età, mostrano un intervallo di variazione di 12 volte dai 915 casi su 100.000 nella Carelia Settentrionale (Finlandia) ai 76 casi/100.000 a Pechino (Cina); nelle donne l'intervallo di variazione è di 8,5 volte, da 256/100.000 a Glasgow (UK) a 30/100.000 in Catalogna (Spagna). Anche prendendo in considerazione altri due maggiori fattori di rischio, pressione arteriosa e fumo, nello studio MONICA rimangono inspiegabili oltre i 3/4 delle morti per CHD; questo sottolinea il fatto che l'incidenza delle malattie a base aterosclerotica, pur restando l'importanza dei tre maggiori fattori di rischio, è legata ad una più ampia costellazione di fattori sia aggressivi che protettivi.
I grandi studi trasversali[modifica | modifica wikitesto]
Gli studi internazionali hanno confrontato fra loro gruppi di individui di diversi paesi, valutando l'incidenza della mortalità per cardiopatia ischemica e la sua relazione con alcuni possibili fattori di rischio. Il Seven Countries Study (1999) è uno dei più famosi di questi studi.[105][106]
In esso sono stati indagati, per 25 anni, 12.770 uomini di età fra 40 e 59 anni, in sette paesi: Paesi Bassi, Finlandia, Grecia, Yugoslavia, Italia, Giappone e USA. La Finlandia presentava la più alta mortalità per cardiopatia ischemica ed il Giappone la più bassa. Con eccezione del Giappone, dove sia i decessi per cardiopatia ischemica sia i valori di colesterolemia erano particolarmente bassi tanto da impedire un calcolo statistico significativo, i due principali fattori di rischio emersi dallo studio sono stati l'ipertensione e la colesterolemia, a sua volta in rapporto con il contenuto di grassi della dieta.
In un famoso studio pubblicato nel 1975 (Ni-Hon-San Study) è stata rilevata l'incidenza di cardiopatia ischemica tra 12.000 uomini di origine giapponese e residenti in Giappone, Hawaii e California; è risultato che i giapponesi che vivevano nelle Hawaii e in California avevano un'incidenza di cardiopatia ischemica quasi doppia rispetto a quelli che vivevano in Giappone, ma pur sempre la metà rispetto agli statunitensi di razza caucasica. Da questi dati è emersa l'importanza dei fattori ambientali nello sviluppo della cardiopatia ischemica, ma anche la probabile partecipazione di un substrato genetico.
I grandi studi prospettici[modifica | modifica wikitesto]
Gli studi longitudinali (detti anche prospettici), cioè gli studi che hanno tenuto sotto osservazione gli stessi individui per diversi anni, hanno dimostrato che il rischio di morte per cardiopatia ischemica è strettamente proporzionale ai livelli di colesterolemia: più alti sono i valori di colesterolo maggiore è la mortalità cardiovascolare. Mentre i primi studi prospettici (Framingham Heart Study, 1971; Pooling Project, 1978; Israeli Prospective Study, 1985) suggerivano che il rischio di un nuovo evento ischemico rimanesse pressoché immodificato fino al valore soglia di 200 mg/dl di colesterolemia totale (circa 130 mg/dl di LDL), gli studi successivi di maggiori dimensioni, MRFIT in particolare, hanno chiaramente indicato che la correlazione tra colesterolemia e mortalità cardiovascolare è costantemente positiva lungo tutto l'intervallo dei valori della colesterolemia, senza che si possa individuare un valore soglia, al di sotto del quale il rischio si mantenga costantemente basso. La correlazione è di tipo curvilineare, cosicché al crescere della colesterolemia la mortalità da cardiopatia ischemica aumenta più rapidamente, in modo tale che un aumento della colesterolemia pari ad un punto percentuale corrisponde un aumento di quasi due punti percentuali della mortalità: rispetto a 200 mg/dl di colesterolemia, il tasso di mortalità è raddoppiato a 250 mg/dl e quadruplicato a 300 mg/dl.
Fra i numerosi studi longitudinali hanno una particolare importanza, per durata o per numero di individui esaminati, due studi:
- il Framingham Heart Study, iniziato nel 1949 e tuttora in corso, ha interessato inizialmente circa 5000 individui di entrambi i sessi esenti da malattie cardiache al momento del reclutamento, sottoposti a controllo ogni due anni;
- il MRFIT (Multiple Risk Factor Intervention Trial), iniziato nel 1973 e durato 16 anni, ha reclutato circa 360.000 soggetti liberi al basale da cardiopatie.

Framingham Heart Study. Il primo e il più famoso grande studio prospettico sulla CHD è il Framingham Heart Study (1948), preceduto nel 1947 dalla prima indagine prospettica di proporzioni ridotte, il Minnesota Business Men Study su 281 professionisti e uomini di affari. Lo studio di Framingham (Massachusetts), è una enorme opera epidemiologica statunitense che riempie una biblioteca intera e decorre fin dagli anni cinquanta (nel frattempo si è giunti ai nipoti dei primi partecipanti). Il follow-up a 30 anni di 1959 uomini e 2415 donne sani, di età compresa tra 31 e 65 anni, attesta che, al di sotto dei 50 anni, i livelli di colesterolo sono direttamente correlati con la mortalità totale e cardiovascolare, in misura tale che per ogni incremento di 10 mg/dl di colesterolo sierico la mortalità totale e quella cardiovascolare aumentano rispettivamente del 5% e del 9%. Questa associazione rimane statisticamente significativa negli uomini anche dopo le correzioni statistiche per pressione, fumo, peso corporeo e diabete; nelle donne l'associazione rimane positiva sebbene non raggiunga la significatività statistica. Dopo i 50 anni non vi è incremento della mortalità totale né per valori alti di colesterolemia, né per quelli bassi, ma il rapporto è confuso dalla presenza di individui in cui la colesterolemia diminuisce, probabilmente a causa dello sviluppo di gravi malattie. In quei soggetti in cui la colesterolemia diminuisce spontaneamente, per ogni mg/dl di discesa del colesterolo nei primi 14 anni di osservazione si registra un incremento entro 18 anni dell'11% della mortalità totale e del 14% di quella cardiovascolare.


Multiple Risk Factor Intervention Trial (MRFIT) è uno studio statunitense, iniziato nel 1973, in cui 361.662 uomini, di età compresa tra 35 e 57 anni, sono stati seguiti per 6 anni; nell'ambito dello studio era previsto anche un trial clinico su 12.866 soggetti ad alto rischio. L'indagine osservazionale ha evidenziato che la correlazione tra colesterolemia totale e mortalità per coronaropatia è lineare per valori compresi tra 200 e 240 mg/dl, mentre al di sopra dei 240 mg/dl diviene esponenziale, cosicché a più alte concentrazioni di colesterolo, la mortalità da CHD (Coronary Heart Disease) aumenta più rapidamente. Inoltre i dati del MRFIT sembrano negare la validità del concetto di soglia per i valori della colesterolemia, da questo studio risulta infatti che non vi è un limite per il colesterolo totale sierico, al di sotto del quale il rischio di CHD non esiste.[70] È interessante notare che nel MRFIT, come è emerso anche dal Framingham Heart Study, l'importanza del colesterolo totale come fattore di rischio si riduce con l'età. In questo studio, il rapporto tra mortalità totale e colesterolo totale è rappresentato graficamente da una curva a J, piuttosto che a U.
Prospective Cardiovascular Münster (PROCAM) Heart Study è uno dei più ampi studi prospettici europei sui fattori di rischio cardiovascolari. Lo studio, iniziato nel 1979 e completato nel 1991, ha riguardato 23.616 impiegati della Germania nord-occidentale (tra Münster e la Ruhr). Dopo un follow-up di 14 anni, il colesterolo totale, il colesterolo LDL ed il rapporto LDL/HDL mostravano una relazione esponenziale con la mortalità per CHD e una relazione a J con la mortalità totale. Ad alti livelli di colesterolo totale e LDL, l'aumento della mortalità totale era dovuto all'aumento delle morti coronariche, mentre a bassi livelli di colesterolo totale e LDL l'incremento della mortalità totale si verificava soltanto nei fumatori ed era in rapporto con una maggiore mortalità per cancro correlato al fumo.
Una meta-analisi effettuata su 18 studi epidemiologici e risalente al 1992 dimostra che la mortalità totale è minima per valori di colesterolemia totale compresi tra 160 e 200 mg/dl per gli uomini e tra 200 e 240 per le donne (le tabelle di rischio cardiovascolare fornite dal Ministero della salute ai medici di famiglia italiani tengono conto di tale differenza legata al sesso). Valori troppo bassi sono correlati ad un aumentato rischio di morte causata da alcuni tumori, ictus cerebrali e polmonari, alcune malattie infettive, incidenti, suicidi e malattie degenerative, mentre valori troppo alti sono correlati ad un aumentato rischio d'infarto miocardico acuto. Nella pratica medica si parla solo dei rischi connessi a valori elevati, ma quasi mai di quelli derivanti da valori troppo bassi, in quanto la relazione causale tra bassa colesterolemia ed eventi avversi è estremamente dubbia.
North Karelia Project. La ricerca della Carelia è uno studio epidemiologico a intervento iniziato nei primi anni 70; il governo finlandese (preoccupato dai tanti decessi cardiovascolari) ha promosso uno studio intervenendo con delle misure nutrizionali: educazione alla salute, campagna antifumo, antialcol e abbassamento farmaceutico della colesterolemia nella regione della Carelia del Nord, mentre in tutte le altre regioni non è stato fatto alcun intervento. Il risultato è stato una riduzione di circa il 20% di decessi per morte cardiovascolare. Per questo fatto lo studio viene spesso citato da coloro che sostengono e vogliono promuovere "l'abbassamento del colesterolo per minimizzare i rischi cardiovascolari". Nello stesso lasso di tempo, però, nelle altre regioni della Finlandia, i decessi cardiovascolari si sono abbassati del 22%, come illustrato da Vartiainen (vedi fonti). Nessuno sa spiegarselo, sebbene le interpretazioni addotte possano apparire anche molto fantasiose.
In base a queste e ad altre esperienze J. McCormick e P. Skrabanek sono arrivati alla conclusione che "non è possibile prevenire le malattie cardiache coronariche con degli interventi sulla popolazione".[107]
Note[modifica | modifica wikitesto]
- ^ Lee Goldman e Andrew I. Schafer, Goldman-Cecil Medicine, 25ª ed., Philadelphia, Elsevier-Saunders, 2016, p. 1395, ISBN 978-1-4557-5017-7.
- ^ A.H. Reed, Influence of statistical method used on the resulting estimate of normal range, in Clin. Chem, vol. 17, 1971, pp. 275-284.
- ^ Pschyrembel.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 25-27, ISBN 92-890-1363-X.
- ^ Lee Goldman e Andrew I. Schafer, Goldman-Cecil Medicine, 25ª ed., Philadelphia, Elsevier-Saunders, 2016, p. 2713, ISBN 978-1-4557-5017-7.
- ^ a b (EN) Alberico L. Catapano, Ian Graham, Guy De Backer, Olov Wiklund, M. John Chapman, Heinz Drexel, Arno W. Hoes, Catriona S. Jennings, Ulf Landmesser, Terje R. Pedersen, Željko Reiner, Gabriele Riccardi, Marja-Riita Taskinen, Lale Tokgozoglu, W. M. Monique Verschuren, Charalambos Vlachopoulos, David A. Wood, Jose Luis Zamorano, 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias, in European Heart Journal, 27 agosto 2016, DOI:10.1093/eurheartj/ehw272. URL consultato il 31 agosto 2016.
- ^ M.M. Gulizia, Colesterolo e rischio cardiovascolare: percorso diagnostico-terapeutico in Italia (PDF), in G. Ital. Cardiol., 17 (Suppl. 1), 2016, p. S6.
- ^ Vari, Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) (PDF), in Circulation, vol. 106, 2002, p. 3143.
- ^ F. Farzadfar, National, regional, and global trends in serum total cholesterol since 1980: systematic analysis of health examination surveys and epidemiological studies with 321 country-years and 3.0 million participants, in Lancet, vol. 377, 2011, pp. 578-586.
- ^ (EN) F.Farzadfar, National, regional, and global trends in serum total cholesterol since 1980: systematic analysis of health examination surveys and epidemiological studies with 321 country-years and 3·0 million participants (abstract), in Lancet, vol. 377, 2011, pp. 578-586.
- ^ The Lipid Research Clinics Program Epidemiology Committee, Plasma lipid distributions in selected North American populations: the Lipid Research Clinics Program Prevalence Study, in Circ, vol. 60, 1979, pp. 427-439.
- ^ a b G. Heiss, Lipoprotein-cholesterol distributions in selected North American populations: the lipid research clinics program prevalence study (PDF), in Circ., vol. 61, 1980, pp. 302-315.
- ^ W.P. Castelli, Cardiovascular risk factors in the elderly, in Am. J. Cardiol., vol. 63, 1989, pp. 12-19.
- ^ P.N. Durrington, Hyperlipidaemia. Diagnosis and management, 3ª ed., London, Hodder Arnold, 2007, p. 73, ISBN 978 0 340 807 811.
- ^ K.L. Khoo, Lipids and coronary heart disease in Asia, in Atherosclerosis, vol. 169, 2003, pp. 1-10.
- ^ X. Wan, Mortality trends for ischemic heart disease in China: an analysis of 102 continuous disease surveillance points from 1991 to 2009, in BMC Public Health, vol. 18, 2017, p. 52.
- ^ J.V. Patel, Impact of migration on coronary heart disease risk factors: comparison of Gujaratis in Britain and their contemporaries in villages of origin in India, in Atherosclerosis, vol. 185, 2006, pp. 297-306.
- ^ H. Kato, Epidemiologic studies of coronary heart disease and stroke in Japanese men living in Japan, Hawaii and California (abstract), in Am. J. Epidemiol, vol. 97, 1973, pp. 372-385.
- ^ J. Patel, Impact of migration on coronary heart disease risk factors: comparison of Gujeratis in Britain and their contempories in villages of origin in India, in Atherosclerosis, vol. 185, 2006, pp. 297-306.
- ^ D.M. Hallman, The apolipoprotein E polymorphism: a comparison of allele frequencies and effects in nine populations (PDF), in Am. J. Hum. Genet, vol. 49, 1991, pp. 338-349.
- ^ J. Cohen, Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9, in Nat. Genet, vol. 37, 2005, pp. 161-165.
- ^ a b c (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 25-27, ISBN 92-890-1363-X.
- ^ a b c d e A.H. Lichtenstein, Dietary fat, carbohydrate, and protein: effects on plasma lipoprotein patterns, in J. Lipid Res., vol. 47, 2006, pp. 1661-1667.
- ^ P.N. Durrington, Hyperlipidaemia. Diagnosis and management, 3ª ed., London, Hodder Arnold, 2007, p. 225, ISBN 978 0 340 807 811.
- ^ R.P Mensink, Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trial, in Am. J. Clin. Nutr., vol. 77, 2003, pp. 1146-1155.
- ^ a b R.P. Mensink, Effect of dietary fatty acids on serum lipids and lipoproteins. A meta-analysis of 27 trials, in Arterioscl. Thromb. Vasc. Biol., vol. 12, 1992, pp. 911-919.
- ^ I.A. Brouwer, Effect of Animal and Industrial Trans Fatty Acids on HDL and LDL Cholesterol Levels in Humans – A Quantitative Review, in PloS One, vol. 5, 2010, p. e9434.
- ^ a b A. Motard-Bélanger, Study of the effect of trans fatty acids from ruminants on blood lipids and other risk factors for cardiovascular disease, in Am. J. Clin. Nutr., vol. 87, 2008, pp. 593-599.
- ^ D.J. Baer, What do we really know about the health effects of natural sources of trans fatty acids?, in Am. J. Clin. Nutr., vol. 95, 2012, pp. 267-268.
- ^ USDA; US Department of Health and Human Services, Dietary guidelines for Americans 2010, 7ª ed., Washington (DC), US Government Printing Office, 2010.
- ^ M.D. Jensen, AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society, in Circulation, 129 (25 Suppl 2), 2014, pp. S102–138.
- ^ a b c d P.M. Kris-Etherton, Emerging Nutrition Science on Fatty Acids and Cardiovascular Disease: Nutritionists' Perspectives, in Adv. Nutr., vol. 6, 2015, pp. 326S-337S.
- ^ a b c R. Micha, Saturated fat and cardiometabolic risk factors, coronary heart disease, stroke, and diabetes: a fresh look at the evidence, in Lipids, vol. 45, 2010, pp. 893-905.
- ^ J.D. Wright, Trends in intake of energy and macronutrients in adults from 1999-2000 through 2007-2008 (PDF), in NCHS Data Brief., vol. 49, 2010, pp. 1-8.
- ^ a b K.M. Kostner, Understanding Cholesterol Synthesis and Absorption Is the Key to Achieving Cholesterol Targets (PDF), in Asia Pacific Cardiol, vol. 1, 2007, pp. 7-10.
- ^ J.D. Griffin, Dietary cholesterol and plasma lipoprotein profiles: randomized-controlled trials, in Curr. Nutr. Rep., vol. 2, 2013, pp. 274-282.
- ^ A.M. Freeman, Trending Cardiovascular Nutrition Controversies (PDF), in JACC, vol. 19, 2017, pp. 1172-1187. URL consultato il 21 ottobre 2017 (archiviato dall'url originale il 19 febbraio 2018).
- ^ R.M. Weggemans, Dietary cholesterol from eggs increases the ratio of total cholesterol to high-density lipoprotein cholesterol in humans: a meta-analysis, in Am. J. Clin. Nutr., vol. 73, 2001, pp. 885-891.
- ^ (EN) D.J. McNamara, The impact of egg limitations on coronary heart disease risk: do the numbers add up? McNamara DJ1. (abstract), in J. Am. Coll. Nutr., vol. 19, Suppl.5, 2000, pp. 540S-548S.
- ^ P.N. Hopkins, Effects of dietary cholesterol on serum cholesterol: a meta-analysis and review, in Am. J. Clin. Nutr., vol. 55, 1992, pp. 1060-1070.
- ^ Scientific Report of the 2015 Dietary Guidelines Advisory Committee https://health.gov/dietaryguidelines/2015-scientific-report/pdfs/scientific-report-of-the-2015-dietary-guidelines-advisory-committee.pdf
- ^ A.H. Lichtenstein, Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee, in Circulation, vol. 114, 2006, pp. 82-96.
- ^ 2015–2020 Dietary Guidelines for Americans, su health.gov.
- ^ a b c M.H. Stipanuk, Biochemical and physiological aspects of human nutrition, Philadelphia, W.B. Saunders Company, 2000, pp. 927-933, ISBN 0-7216-4452-X.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, ISBN 92-890-1363-X.
- ^ A.M. Salter, Dietary fatty acids and cardiovascular disease, in Animal, 7:suppl.1, 2013, pp. 163-171.
- ^ D. Mozaffarian, Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: a systematic review and meta-analysis of randomized controlled trials, in . PLoS Med., vol. 7, 2017, p. e1000252.
- ^ (EN) Muller, H. et al., Serum cholesterol predictive equations with special emphasis on trans and saturated fatty acids: an analysis from designed controlled studies, in Lipids, n. 36, 2001, pp. 783-791.
- ^ A.H. Lichtenstein, Effects of Different Forms of Dietary Hydrogenated Fats on Serum Lipoprotein Cholesterol Levels, in New Engl. J. Med., vol. 340, 1999, pp. 1933-1940.
- ^ (EN) YU, S. et al., Plasma cholesterol–predictive equations demonstrate that stearic acid is neutral and monounsaturated fatty acids are hypocholesterolemic, in American journal of clinical nutrition, n. 61, 1995, pp. 1129-1139.
- ^ J. Shepherd, Effects of saturated and polyunsaturated fat diets on the chemical composition and metabolism of low density lipoproteins in man, in J. Lipid Res., vol. 21, 1980, pp. 91-99.
- ^ M.L. Fernandez, Mechanisms by which dietary fatty acids modulate plasma lipids, in J. Nutr., vol. 135, 2005, pp. 2075-2078.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 24-27, ISBN 92-890-1363-X.
- ^ (DE) M. Kohlmeier et al., Verbreitung von klinisch-chemischen Risikofaktoren, Niederkleen, VERA-Schriftenreihe Band VII, 1993.
- ^ (EN) D.J. McNamara, The impact of egg limitations on coronary heart disease risk: do the numbers add up? McNamara DJ1. (abstract), in J. Am. Coll. Nutr., vol. 19, Suppl.5, 2000, p. 541S.
- ^ a b P.W. Siri-Tarino, A meta-analysis of prospective cohort studies evaluating the association of saturated fat with cardiovascular disease, in Am. J. Clin. Nutr., vol. 91, 2010, pp. 535-546.
- ^ A. Mente, A systematic review of the evidence supporting a causal link between dietary factors and coronary heart disease, in Arch. Intern. Med., vol. 169, 2009, pp. 659-669.
- ^ a b M.U. Jakobsen, Major types of dietary fat and risk of coronary heart disease: a pooled analysis of 11 cohort studies, in Am. J. Clin. Nutr., vol. 89, 2009, pp. 1425-1432.
- ^ A. Menotti, Le origini storiche della dieta mediterranea: il Seven Countries Study of cardiovascular diseases (PDF), in Epidemiol. Prev., vol. 39, 2015, pp. 285-288.
- ^ (EN) Rosenman R.H., Psychological Influence on the Variability of Plasma Colesterol, in Homeostasis, n. 34, 1993, pp. 129-136.
- ^ (EN) R.H. Rosenman, Relationships of neurogenic and psychological factors to the regulation and variability of serum lipids (abstract), in Stress & healt, vol. 9, 1993, pp. 133-140.
- ^ (EN) A. Shirom, Effects of work overload and burnout on cholesterol and triglycerides levels: The moderating effects of emotional reactivity among male and female employees (abstract), in J. Occupational Health Psychol., vol. 2, 1997, pp. 275-288.
- ^ (EN) C.B. Djurhuus, Effects of cortisol on lipolysis and regional interstitial glycerol levels in humans, in Am. J. Physiol. Endocrinol. Metab., vol. 283, 2002, pp. E172-177.
- ^ (EN) N. Bergmann, The appraisal of chronic stress and the development of the metabolic syndrome: a systematic review of prospective cohort studies, in Endocr. Connect., vol. 3, 2014, pp. R55-80.
- ^ (EN) A. Hazra, Modeling of Corticosteroid Effects on Hepatic Low-Density Lipoprotein Receptors and Plasma Lipid Dynamics in Rats, in Pharm. Res., vol. 25, 2008, pp. 769-780.
- ^ (EN) O. Al Rayyes, Additive inhibitory effect of hydrocortisone and cyclosporine on low-density lipoprotein receptor activity in cultured HepG2 cells (abstract), in Hepatology, vol. 26, 1997, pp. 967-971, DOI:10.1002/hep.510260425, PMID 9328321.
- ^ a b c Prospective Studies Collaboration, Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths (PDF), in Lancet, vol. 370, 2007, pp. 1829-1839.
- ^ S. Yaghi, Lipids and Cerebrovascular Disease: Research and Practice, in Stroke, vol. 46, 2015, pp. 3322-3328.
- ^ a b D. Jacobs, Report of the Conference on Low Blood Cholesterol: Mortality Associations, in Circulation, vol. 86, 1992, pp. 1046-1060.
- ^ a b J. Stamler, Is relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? Findings in 356,222 primary screenees of the Multiple Risk Factor Intervention Trial (MRFIT), in J.A.M.A., vol. 256, 1986, pp. 2823-2828.
- ^ Y. Xilin, Independent associations between low-density lipoprotein cholesterol and cancer among patients with type 2 diabetes mellitus, in CMAJ., vol. 179, 2008, pp. 427-437.
- ^ a b (EN) S. Brescianini, Low Total Cholesterol and Increased Risk of Dying: Are Low Levels Clinical Warning Signs in the Elderly? Results from the Italian Longitudinal Study on Aging (abstract), in J. Am. Geriatr. Soc., vol. 51, 2003, pp. 991-996.
- ^ (EN) J.D. Curb, Prospective association between low and high total and low-density lipoprotein cholesterol and coronary heart disease in elderly men (abstract), in J. Am. Geriatr. Soc., vol. 52, 2004, pp. 1975-1980.
- ^ a b (EN) Y. Liang, Serum total cholesterol and risk of cardiovascular and non-cardiovascular mortality in old age: a population-based study, in BMC Geriatr., vol. 17, 2017, p. 294.
- ^ Cholesterol Treatment Trialists’ Collaboration, Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials, in Lancet, vol. 376, 2010, pp. 1670-1681.
- ^ (EN) K.R. Solomon, The complex interplay between cholesterol and prostate malignancy, in Urol. Clin. North Am., vol. 38, 2011, pp. 243-259.
- ^ (EN) O.A. Andreassen, Shared common variants in prostate cancer and blood lipids, in Int. J. Epidemiol., vol. 43, 2014, pp. 1205-1214.
- ^ (EN) P.M. Cruz, The role of cholesterol metabolism and cholesterol transport in carcinogenesis: a review of scientific findings, relevant to future cancer therapeutics, in Front. Pharmacol., vol. 4, 2013, p. 119.
- ^ M. Kivipelto, Midlife vascular risk factors and Alzheimer's disease in later life: longitudinal, population based study, in BMJ, vol. 322, 2001, pp. 1447-1451.
- ^ B.M. Bettcher, Association between cholesterol exposure and neuropathological findings: The ACT Study, in J. Alzheimers Dis, vol. 59, 2017, pp. 1307-1315.
- ^ (EN) D.J. Gordon, High-density lipoprotein cholesterol and cardiovascular disease: four prospective American studies, in Circulation, vol. 79, 1989, pp. 8-15.
- ^ T. Lucchi, Dislipidemia e statine: dalle linee guida alla pratica clinica, in G. ital. cardiol., vol. 15, 2014, pp. 149-160.
- ^ (EN) K. Tan, Re‐examining the high‐density lipoprotein hypothesis, in J. Diabetes Investig., vol. 7, 2016, pp. 445-447, PMID 27181708.
- ^ W.P. Castelli, Epidemiology of coronary heart disease: the Framingham study (abstract), in Am. J. Med., vol. 76, 1984, pp. 4-12.
- ^ K.M. Bass, Plasma lipoprotein levels as predictors of cardiovascular death in women, in Arch. Intern. Med, vol. 153, 1993, pp. 2209-2216.
- ^ R.M. Conroy, Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project, in European Heart Journa, vol. 24, 2003, pp. 987-1003.
- ^ N.J. Stone, 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults, in Circulation, vol. 129, 2014, pp. S1-S45.
- ^ D. Preis, The New Pooled Cohort Equations Risk Calculator, in Can. J. Cardiol, vol. 31, 2015, pp. 613-619.
- ^ S. Rabar, Lipid modification and cardiovascular risk assessment for the primary and secondary prevention of cardiovascular disease: summary of updated NICE guidance (abstract), in BMJ, vol. 349, 2014, p. g4356.
- ^ (EN) The International Network of Cholesterol Skeptics" - News, su thincs.org. URL consultato il 25 novembre 2008.
- ^ U. Ravnskov, Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly: a systematic review, in BMJ, e010401, 2016.
- ^ J.M. Bae, Low cholesterol is associated with mortality from cardiovascular diseases: a dynamic cohort study in Korean adults, in J. Korean Med. Sci., vol. 27, 2012, pp. 58-63.
- ^ a b H. Petursson, Is the use of cholesterol in mortality risk algorithms in clinical guidelines valid? Ten years prospective data from the Norwegian HUNT 2 study, in J. Eval. Clin. Pract., vol. 18, 2012, pp. 159-168.
- ^ (DE) H. Immich, Cholesterin und Koronarsklerose, in Versicherungsmedizin, vol. 49, 1997, p. 86 ss.
- ^ (EN) H. Ulmer, Why Eve is not Adam: prospective follow-up in 149,650 women and men of cholesterol and other risk factors related to cardiovascular and all-cause mortality (abstract), in J. Womens Health (Larchmt), vol. 13, 2004, pp. 41-53.
- ^ J. Ahn, Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer, in Cancer Epidemiol. Biomarkers Prev, vol. 18, 2009, pp. 2814-2821.
- ^ M. Eichholzer, Association of low plasma cholesterol with mortality for cancer at various sites in men: 17-y follow-up of the prospective Basel study, in Am. J. Clin. Nutr, vol. 71, 2000, pp. 569-574.
- ^ J. Ahn, Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer, in Cancer Epidemiol. Biomarkers Prev., vol. 18, 2009, pp. 2814-2821.
- ^ A.M. Tonkin, The evidence on trial: cholesterol lowering and cancer, in Heart Asia, vol. 1, 2009, pp. :6-10.
- ^ Y. Takata, Serum total cholesterol concentration and 10-year mortality in an 85-year-old population, in Clin Interv Aging, vol. 9, 2014, pp. 293-300.
- ^ H. Soran, Evidence-based goals in LDL-C reduction, in Clin. Res. Cardiol.., vol. 106, 2017, pp. 237-248.
- ^ Heart Protection Study Collaborative Group, Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial, in Lancet, vol. 378, 2011, pp. 2013-2020.
- ^ K.R. Solomon, The complex interplay between cholesterol and prostate malignancy, in Urol. Clin. North. Am., vol. 38, 2011, pp. 243-259.
- ^ (EN) Ancel B. Keys, Seven countries: a multivariate analysis of death and coronary heart disease., Cambridge, Harvard University Press, 1980.
- ^ Seven Countries Study, su sevencountriesstudy.com.
- ^ A. Menotti, Il ruolo del Seven Countries Study of cardiovascular diseases nell’identificazione della dieta mediterranea (PDF), in Giorn. it. ateroscl., vol. 5, 2014, pp. 3-19.
- ^ (EN) J. McCormick, P. Skrabanek, Coronary heart disease is not preventable by population interventions, in The Lancet, II, 1988, pp. 839 ss..
Bibliografia[modifica | modifica wikitesto]
- (EN) B. Caballero. Encyclopedia of human nutrition. Elsevier-Academic Press, 2005. 2ed. ISBN 0-12-150110-8.
- (EN) Pollmer U., Warmuth S., Lexikon der populären Ernährungsirrtümer, Weltbil, 2003, ISBN 3-8289-1930-8.
- (EN) E. Vartiainen et al., Twenty-year trends in coronary risk factors in North Karelia and in other areas of Finland, in International Journal of Epidemiology, n. 23, 1994, p. 495.
- (DE) M. Kohlmeier et al., Verbreitung von klinisch-chemischen Risikofaktoren, Niederkleen, VERA-Schriftenreihe Band VII, 1993.
- (EN) Jacobs et al., Report of of the conference of low blood cholesterol. Mortality associations., in Circulation, n. 86, 1992, p. 1046.
- (DE) Willibald Pschyrembel, Pschyrembel: Klinisches Wörterbuch, Berlino, Walter de Gruyter GmbH & Co., 2004, ISBN 3-11-017621-1.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Colesterolemia
Wikimedia Commons contiene immagini o altri file su Colesterolemia
| Controllo di autorità | Thesaurus BNCF 24762 |
|---|





