Carcinoma della bocca

| Carcinoma della bocca | |
|---|---|
 Immagine istologica di un carcinoma squamoso di tipo ben differenziato in sede orale, colorazione ematossilina-eosina | |
| Tipo | Maligno |
| Cellula di origine | Epitelio orale |
| Fattori di rischio | · Fumo · Alcool · Alimentazione · Immunodeficienza |
| Incidenza | 4,0/100 000 (globale) 3,1/100 000 (Italia) |
| Età media alla diagnosi | oltre 50 anni |
| Rapporto M:F | 2:1 |
| Classificazione e risorse esterne | |
| ICD-9-CM | (EN) 140-146 |
| ICD-10 | (EN) C00-C06 |
Con il termine di carcinoma della bocca o carcinoma orale si intende l'insieme delle neoplasie maligne che si originano dai tessuti epiteliali che rivestono la cavità orale. Non rientrano quindi nella categoria le neoplasie benigne (papillomi, lipomi, angiomi) e le neoplasie maligne di origine non epiteliale (melanomi, tumori delle ghiandole salivari, sarcomi) che possono talvolta manifestarsi nel cavo orale. Allo stesso modo, non vi rientrano le forme secondarie.
Il carcinoma orale rappresenta più del 90% di tutte le neoplasie maligne della bocca[1]. Colpisce più frequentemente oltre i cinquanta anni di età, e i maschi in misura maggiore delle donne, in un rapporto di circa 2:1. I principali fattori di rischio sono il fumo e l'abuso di alcolici[2]. La tipologia istologica di gran lunga più frequente è il carcinoma a cellule squamose o spinocellulare.
Nelle fasi iniziali l'aspetto è di piccola lesione superficiale rossa o bianca (eritroplachia o leucoplachia), o di una ulcerazione non tendente a guarigione spontanea. Talvolta può assumere l'aspetto di lesione infiltrativa nodulare, in forma di ispessimento più o meno regolare rilevato sui bordi, che tende ad ulcerarsi superficialmente, ma non è infrequente anche una forma a crescita esofitica o papillare. In alcuni casi può presentare più di uno di questi aspetti contemporaneamente. La tendenza prevalente è per la crescita invasiva locale, con rapido interessamento linfonodale, ma bassa frequenza di metastasi a distanza.
I sintomi più frequenti sono la sensazione di aumento di consistenza della mucosa interessata, successivamente il dolore, inizialmente in forma di bruciore lieve ma ingravescente, a cui col tempo si possono accompagnare il rigonfiamento dei linfonodi, difficoltà a deglutire e difficoltà alla fonazione. L'esame diagnostico principale è la biopsia.
La terapia per questo tipo di tumore prevede l'utilizzo di chirurgia o radioterapia, a seconda della sede, mentre nelle lesioni più avanzate le due tecniche vengono utilizzate in associazione, talvolta con chemioterapia di supporto. La prognosi è mediamente buona, ma dipende notevolmente dall'estensione della patologia al momento della diagnosi, fondamentale quindi risulta la diagnosi precoce.
Epidemiologia[modifica | modifica wikitesto]
Il cancro orale e delle labbra si colloca al quindicesimo posto a livello globale come incidenza relativa di tutti i tumori (2,1% di tutte le neoplasie), con un dato (standardizzato per età) di 4,0 nuovi casi per anno ogni 100 000 abitanti, valori che differiscono significativamente tra uomini e donne, per un rapporto indicativo di circa 2:1. Raggiunge infatti l'undicesimo posto tra gli uomini con un valore di 5,5 casi ogni 100 000 abitanti (2,7% di tutte le neoplasie) e il diciassettesimo tra le donne (2,5 casi ogni 100 000, 1,5%). Il tasso di mortalità è di 1,9 decessi ogni 100 000 abitanti e, anche in questo caso, gli uomini sopravanzano le donne per un fattore di circa 2:1 (2,7 contro 1,2 decessi ogni 100 000)[3]. Nel confronto con i dati di indagini precedenti (2002) è possibile notare una lieve diminuzione sia nell'incidenza che per il dato sulla mortalità, in entrambi i sessi[4].
La distribuzione globale di questa patologia varia considerevolmente sia per quanto riguarda i valori assoluti che relativi, con un picco in alcuni paesi dell'Asia meridionale e nell'Europa centro-orientale[5], legato alla ampia diffusione di comportamenti a rischio come fumo, abuso di alcolici e masticazione del paan (betel), raggiungendo in India il terzo posto come incidenza relativa tra tutte le neoplasie[6]. I paesi di minore diffusione sono quelli africani e del sud America[7].
In Italia il cancro orale e delle labbra presenta un'incidenza media di 3,1 nuovi casi all'anno ogni 100 000 abitanti (standardizzato per età), il che lo pone al ventesimo posto tra tutte le neoplasie in Italia[8]. Dividendo i dati per sesso, si hanno 4,1 nuovi casi ogni 100 000 abitanti maschi all'anno[9] e di 2,1 per le donne[10], con un rapporto tra i due sessi di poco inferiore a 2:1. Il tasso di mortalità annuo è di 1,1 persone ogni 100 000 abitanti[11], di quasi tre volte più alto tra gli uomini (1,5)[12] rispetto alle donne (0,6)[13]. Analizzando i dati degli anni passati (periodo 1986-1997), è possibile notare una tendenza al riavvicinamento graduale nei dati di incidenza e mortalità tra uomini e donne[14].
I dati epidemiologici mostrano chiaramente il legame di questa neoplasia con l'aumento dell'età, che risulta in un'incidenza che partendo dal dato (globale) di 0,1 casi ogni 100 000 abitanti nella fascia d'età 0-14 anni, sale gradualmente fino a raggiungere il livello massimo di 23,4 nella fascia oltre i 75 anni[15].
Eziologia[modifica | modifica wikitesto]
Alcuni fattori di rischio si sono rivelati particolarmente significativi per questa forma di neoplasia[16][17]. Tra questi assumono particolare importanza il consumo del tabacco, sia nelle forme che ne prevedono la combustione che per masticazione, e l'abuso di alcolici, in grado di dare conto di circa i tre quarti di tutti i tumori orali nei paesi dove queste abitudini rappresentano la principale fonte di rischio[1][18]. Nei paesi medio orientali e nel sud dell'Asia, la diffusa abitudine alla masticazione voluttuaria di particolari miscele vegetali (paan e qāt) sembra parimenti comportare livelli di rischio molto elevati. Altri fattori che si sono potuti correlare all'aumento di incidenza di tumori orali sono le infezioni virali da HPV, alcuni fattori legati alla dieta e alle abitudini igieniche, situazioni di immunodeficienza sia acquisita che congenita, e la presenza di alcune patologie che sembrano poter essere promotori della neoplasia, per questo classificate dall'OMS come condizioni precancerose. Anche la familiarità è stata chiamata in causa da alcuni studi come possibile fattore di rischio[19].
Tabacco[modifica | modifica wikitesto]

Il collegamento tra tabagismo, nelle sue varie forme, e il carcinoma orale è ben conosciuta da tempo, e dimostrata da numerosi studi epidemiologici[20]. Il fumo di sigaretta in particolare è considerato la prima causa di tumore orale in assoluto, e il riavvicinamento graduale dei tassi di incidenza e mortalità tra i due sessi sembra legato proprio al diffondersi di questa abitudine anche nel sesso femminile, dove sembra in grado di rivelarsi persino più dannosa che tra i maschi[21]. L'abitudine al fumo di sigaro, meno correlata ai tumori delle vie aeree inferiori e del polmone rispetto alle sigarette, in quanto si accompagna ad una minore inspirazione del fumo, pare invece comportare un rischio maggiore per le vie aeree superiori, cavità orale in primis, proprio per l'abitudine di trattenere maggiormente il fumo in bocca. I livelli di rischio rilevati risultano da sette a dieci volte superiori ai non fumatori, e sono correlati al numero di sigari fumati e al livello di inspirazione del fumo[22][23]. Problemi simili sono legati all'uso della pipa[24]. L'uso in alcune popolazioni (prevalentemente nel sesso femminile) di fumare tenendo la parte accesa all'interno della bocca è stato a sua volta correlato con una maggiore incidenza della patologia orale, fatto che sembra coinvolgere anche il calore come fattore di rischio[25][26]. Anche l'uso del tabacco per la masticazione è stato da tempo segnalato in relazione ad un aumento nel rischio di carcinoma orale[27], secondo alcuni studi in maniera altrettanto significativa rispetto alle modalità che ne prevedono la combustione, o persino superiore[28][29].
Alcolismo[modifica | modifica wikitesto]
La correlazione tra il consumo di alcoolici e il carcinoma orale è documentata da numerosi studi, sia da sola che in concomitanza con il fumo, due abitudini che tipicamente tendono ad accompagnarsi, fatto che si rivela in grado di potenziare molto l'azione di promozione carcinogena[28][30]. Il legame tra abuso di alcolici e diversi tipi di tumore è conosciuto da tempo, tanto che le bevande alcoliche sono inserite dall'IARC nella prima classe di rischio, anche se non sono state ancora completamente chiarite le modalità con cui l'effetto oncogeno si sviluppa, visto che l'etanolo non ha dimostrato possedere azione mutagena diretta. Sono stati proposti vari effetti diretti o indiretti in grado di spiegare i meccanismi con cui questa azione si verifica[31]. Studi recenti sembrano comunque restringere l'importanza dell'azione diretta nel caso del tumore orale, sostenendo invece una quasi esclusiva azione di potenziamento in associazione con il fumo[32][33]. Il collegamento tra neoplasie orali e collutori contenenti alcol non ha trovato conferme[34][35].
Paan (Betel) e qāt[modifica | modifica wikitesto]

L'abitudine molto comune nei paesi asiatici di masticare il paan (da noi meglio conosciuto con il nome di uno dei componenti, il betel), miscela vegetale contenente alcune molecole appartenenti alla classe degli alcaloidi dall'effetto paragonabile a quello della nicotina, è risultata essere fortemente correlata all'alta incidenza di questo tumore nelle regioni sud orientali[36]. Il paan viene tradizionalmente preparato mescolando la noce di Areca e le foglie del betel (Piper betel), base che nelle diverse regioni presenta molte varianti[37][38], tra cui l'aggiunta di tabacco, usanza che sembra in grado di amplificarne notevolmente l'azione carcinogena, così come l'associazione con altre fonti di rischio[39].
Anche l'abitudine molto diffusa in alcuni paesi arabi di masticare le foglie di qāt, contenenti una sostanza alcaloide dotata di effetto euforizzante simile a quello delle anfetamine, è stata correlata alla presenza di neoplasie orali[40].
HPV[modifica | modifica wikitesto]
L'associazione tra papillomavirus (HPV) e carcinoma è ben conosciuta per le zone genitali (carcinoma della cervice uterina), in particolare riguardo ad alcuni ceppi specifici (16, 18), in grado di produrre proteine con effetto di promozione tumorale, effetti in grado di produrre modificazioni anche a lungo termine. Un ruolo simile dell'HPV in relazione ai tumori dell'orofaringe sembra oramai sufficientemente dimostrato[41][42], mentre studi recenti sembrano ridimensionare notevolmente il coinvolgimento nell'insorgenza in sede orale[43][44].
Alimentazione[modifica | modifica wikitesto]
Il legame tra neoplasia orale e abitudini alimentari si è dimostrato particolarmente significativo riguardo ad alcune tipologie di cibi, in analogia con quanto è stato riscontrato per altri tumori del sistema digerente. In particolare diversi studi hanno messo in luce il ruolo di frutta e verdure fresche come alimenti in grado di contrastare l'insorgenza della patologia[45][46], così come si è registrato un ruolo protettivo legato al consumo regolare di caffè[47][48]. Il consumo di carni lavorate si è rivelato un fattore di rischio significativo[49], mentre quello di alimenti ricchi di fibre non è risultato influire particolarmente[50].
Immunodeficienza[modifica | modifica wikitesto]
Il ruolo della diminuzione dell'attività del sistema immunitario nella promozione dei tumori è conosciuto. Anche in sede orale, alcune condizioni in grado di indebolire le normali capacità del sistema immunitario dell'organismo sembrano essere significativamente correlate ad un aumento nel rischio di neoplasie. Questo è stato osservato in relazione alle terapie antirigetto[51], nella malattia del trapianto contro l'ospite, e in patologie con effetto immunosoppressivo come l'AIDS, e si ritiene che anche nel caso dell'HPV, del linfoepitelioma legato al virus Epstein-Barr e di alcune patologie congenite che interferiscono con il corretto funzionamento del sistema immunitario (vedi sotto condizioni precancerose), il meccanismo immunosoppressivo sia uno dei fattori principali della promozione oncogenica. Questo potrebbe essere confermato dalla correlazione riscontrata tra livello di sostanze immunosoppressive e progressione neoplastica nei soggetti malati[52].
Igiene orale e patologie dentarie[modifica | modifica wikitesto]
L'associazione tra scadente igiene orale o presenza di stimoli irritativi (protesi incongrue o lesioni cariose e patologia parodontale) e il cancro orale viene frequentemente osservata clinicamente[53]. La frequente presenza contemporanea di scarsa salute orale e abitudini come fumo e alcolismo, a loro volta implicati nel processo di promozione tumorale, hanno però reso molto difficile ad oggi stabilire una correlazione sicura su basi statistiche. Studi recenti sembrano però sostenere l'ipotesi di un'associazione tra carcinoma e malattia parodontale[54][55].
Condizioni precancerose[modifica | modifica wikitesto]
Alcune condizioni patologiche sono state correlate in maniera significativa con lo sviluppo del carcinoma in sede orale. In accordo con l'Oms le patologie a maggior rischio sono: il lichen planus orale, in particolare nella sua forma erosiva, la fibrosi orale sottomucosa, il lupus eritematoso sistemico, lo xeroderma pigmentoso, la disfagia sideropenica o sindrome di Plummer-Vinson, l'epidermolisi bollosa e la discheratosi congenita[56]. In presenza di queste patologie, è fortemente consigliata una valutazione periodica dello stato di salute delle mucose orali.
Patogenesi[modifica | modifica wikitesto]
Come per gran parte dei tumori, il processo patogenetico che porta allo sviluppo della neoplasia (carcinogenesi) non è ancora completamente conosciuto. La teoria che al momento trova maggior credito è quella multistadio, che prevede un accumulo graduale di alterazioni in grado di agire sui meccanismi che mantengono l'equilibrio delle cellule (omeostasi), causandone come effetto finale una proliferazione incontrollabile e, nel caso delle forme maligne, l'azione aggressiva nei confronti dei tessuti circostanti, le cui cellule possono a loro volta essere coinvolte nel processo patologico[57]. A dare il via alla trasformazione sarebbe l'esposizione ad un fattore promotore in grado di modificare il corredo cromosomico di una singola cellula, sia agendo a livello strutturale, che modificandone l'espressione[58]. In generale, sono molti i geni che quando attivati (oncogeni), o bloccati nella loro usuale funzione protettiva (geni oncosoppressori), possono spingere una cellula verso la trasformazione neoplastica. Nel caso delle neoplasie orali, sono state identificate numerose anomalie genetiche ricorrenti[59][60], in particolare la delezione di alcune specifiche regioni di determinati cromosomi, alterazioni nelle sequenze che riguardano l'espressione della proteina p53, alcune cicline e relativi enzimi CKD, K-Ras, Notch[61] e numerosi altri oncogeni e oncosoppressori[62][63][64]. Un ruolo importante sembrano inoltre svolgerlo alcuni mediatori coinvolti nei processi di angiogenesi, meccanismo essenziale nella crescita del tumore[65].
Lesioni precancerose[modifica | modifica wikitesto]
In accordo al modello che prevede una progressione graduale verso la patologia neoplastica, esistono alcune condizioni delle mucose orali che sono risultate significativamente correlate ad una evoluzione di questo tipo, e per questo ne viene consigliato il monitoraggio ai fini del suo intercettamento precoce. Secondo alcuni studi, circa il 70% delle neoplasie orali si sviluppa a partire da queste condizioni predisponenti[66]. Secondo l'Oms possono essere considerate lesioni precancerose la cheilite attinica, la leucoplachia e l'eritroplachia, distinguendole dalle condizioni precancerose, in quanto, a differenza di queste ultime, sono lesioni localizzate alle zone orali, e specificatamente portate allo sviluppo della patologia neoplastica in questa sede[56]. Il monitoraggio della progressione verso il quadro neoplastico richiede l'esame bioptico, alla ricerca delle alterazioni istologiche e citologiche in grado di predire o meno questa evenienza. A tal riguardo è stata proposta e viene talora utilizzata una scala di valutazione (grading) che misura il grado di displasia osservabile (OED), e quindi il livello di pericolosità potenziale. Il carcinoma in situ, in cui il grado di displasia raggiunge il grado più elevato ma senza che le atipie abbiano superato la membrana basale, viene considerato come stadio di confine tra lesione precancerosa e neoplasia vera. La limitata predittività mostrata da questa metodica[67] e la difficoltà nell'ottenere uniformità di risultati[68] hanno però spinto alla ricerca di indicatori più specifici, basati sull'indagine cromosomica o di marcatori genetici specifici[69], con risultati promettenti ma non ancora sufficientemente affidabili[70].
La cheilite attinica è una forma di ipercheratosi dell'epitelio delle porzione esterna delle labbra, e si presenta come macchia rilevata di colore variabile, più frequentemente sul labbro inferiore, ed è strettamente legata all'esposizione solare.
Con il termine di leucoplachia o leucoplasia si intende una lesione di colore chiaro presente sulla superficie delle mucose non correlabile ad altre patologie[71]. Si tratta quindi di un'entità clinica, non facile da identificare con precisione, che può includere entità patologiche diverse a seconda degli autori, e che ha visto cambiare nel tempo i criteri di definizione[72]. Anche dal punto di vista istopatologico gli aspetti possono variare molto, con prevalenza però del quadro dell'ipercheratosi, associato a vari livelli di displasia[73]. La lesione può essere uniforme o alternata ad aree erosive che indicano un maggior pericolo di evoluzione maligna (eritroleucoplachia), con una variante chiamata leucoplachia verrucosa, considerata a sua volta ad alto rischio di trasformazione neoplastica[74]. Le cause della comparsa possono essere molteplici, tra cui le più comuni sono il fumo e alcune abitudini viziate. Tipicamente asintomatica, prevede terapia chirurgica solo nelle forme a maggior rischio, particolarmente nel caso di aspetto non omogeneo, mentre nelle forme più comuni è previsto il monitoraggio, ed eventualmente la biopsia periodica, per valutare il grado di displasia raggiunto. L'efficacia di questi approcci ai fini della prevenzione dello sviluppo di una forma maligna pare comunque essere dubbia[75].
L'eritroplachia o eritroplasia viene definita una lesione di aspetto rosso eritematoso non correlabile ad altre patologie[73]. Di solito di piccole dimensioni, si presenta abitualmente nelle zone a minor livello di cheratinizzazione; può mostrare aspetti di maggiore o minore omogeneità, ed è spesso correlata ad abitudini viziate come fumo e alcolismo. Presenta il maggior rischio di trasformazione neoplastica, tanto da essere considerata la lesione predisponente per eccellenza[76].
Anatomia patologica[modifica | modifica wikitesto]
Classificazione istologica[modifica | modifica wikitesto]
I vari tipi di carcinomi vengono distinti usando una classificazione basata sul riconoscimento istologico. In accordo con l'Oms[77], vengono classificate come neoplasie maligne orali di origine epiteliale i seguenti istotipi:
- Carcinoma a cellule squamose o spinocellulare
- Carcinoma verrucoso o squamoso verrucoso
- Carcinoma squamoso basaloide
- Carcinoma squamoso papillare
- Carcinoma squamoso a cellule fusate
- Carcinoma a cellule squamose acantolitiche
- Carcinoma adenosquamoso
- Carcinoma cuniculatum
- Linfoepitelioma
Se tra i tumori orali vengono compresi anche quelli della porzione esterna delle labbra, è necessario includere anche il carcinoma basocellulare, neoplasia particolarmente legata all'esposizione solare, per questo praticamente inesistente in localizzazione intraorale.
Carcinoma a cellule squamose[modifica | modifica wikitesto]
Si tratta della tipologia di gran lunga più comune, contribuendo nelle sue forme più o meno differenziate al 90% di tutta la casistica del carcinoma in sede orale[78]. Istologicamente nelle prime fasi è caratterizzato da cellule epiteliali proliferanti, di forma poligonale, disposte a nidi o prolungamenti che si proiettano oltre la membrana basale. Sono osservabili differenti gradi di trasformazione, con presenza di cheratinizzazione più o meno marcata, nuclei di forma irregolare, allungati e ipercromatici. Le cellule possono talvolta riunirsi a formare perle cornee o cellule giganti plurinucleate, e si possono riconoscere ponti intercellulari (desmosomi), simili all'aspetto di spine, da cui il nome un tempo molto usato di carcinoma spinocellulare. Nelle forme meno differenziate il polimorfismo cellulare aumenta, fino al punto di non permettere più il riconoscimento dei caratteri definibili della cellula epiteliale di partenza, così come aumenta il numero di mitosi osservabili, crescono gli aspetti di cheratinizzazione anomala, e spariscono i ponti intercellulari. Frequentemente i diversi aspetti possono coesistere, rendendo difficile classificare il diverso grado di differenziazione. L'invasione del connettivo comporta la sua graduale riorganizzazione in forma di stroma in grado di supportare la crescita neoplastica[79]. La presenza di infiltrato linfocitario è frequente anche in forma organizzata, e sembra associarsi ad una prognosi più favorevole[80]. La lesione neoplastica tende tipicamente all'aggressività locale, con rapida invasione delle strutture circostanti, sia tessuti molli che ossei, e metastasi ai linfonodi di riferimento. La metastatizzazione a distanza per via ematica è invece rara.
Carcinoma squamoso verrucoso[modifica | modifica wikitesto]
Variante del carcinoma a cellule squamose, è la seconda tipologia per frequenza, ed è caratterizzato da cellule ben differenziate, poche perle cornee e scarse mitosi, e bassa tendenza ad oltrepassare la membrana basale, comportamento in grado talvolta di rendere complicata la diagnosi tramite biopsia, lasciando il dubbio di semplice lesione precancerosa o benigna. Il superamento della membrana basale è comunque accompagnato da intensa reazione infiammatoria degli strati inferiori sottomucosi. Il nome della neoplasia è dovuto all'aspetto macroscopico di lesione esofitica papillare-verrucosa, dalla superficie molto irregolare e consistente, raramente ulcerata, ed è caratterizzato da bassa tendenza alla metastatizzazione, e quindi prognosi favorevole. La localizzazione tipica è sulla mucosa orale e sulle gengive. Dato l'aspetto delle lesioni, era stato suggerito un collegamento con l'HPV, che però non ha trovato finora conferma[81].
Carcinoma basaloide[modifica | modifica wikitesto]
Forma rara e aggressiva, tipica del pavimento orale, ma che può colpire anche la zona orofaringea. Istologicamente si distingue per la presenza contemporanea delle cellule tipiche del carcinoma squamoso, a volte con aspetti di cheratinizzazione, mescolate alle strutture a nidi caratteristiche del carcinoma basocellulare, con cellule di piccola dimensione ma con nuclei voluminosi, e talvolta presenza della tipica disposizione periferica delle cellule a palizzata[82]. La prognosi non sembra differire da quella del carcinoma squamoso[83].
Carcinoma squamoso papillare[modifica | modifica wikitesto]
Variante del carcinoma squamoso che macroscopicamente presenta un aspetto tipicamente esofitico-papillare, moderata tendenza delle cellule neoplastiche al superamento dello strato basale e prognosi favorevole, anche se con spiccata tendenza alla recidiva.
Carcinoma a cellule fusate[modifica | modifica wikitesto]
Anche denominato carcinoma sarcomatoide o pseudosarcoma, in quanto l'aspetto istologico simula quello del sarcoma vero, per la presenza di cellule di forma allungata che compongono il corpo principale del tumore, in un quadro che però presenta aspetti di mescolanza con le cellule tipiche del carcinoma squamoso, frammiste ad atipie cellulari, il che lo rende non facile da identificare[84]. L'aspetto macroscopico è spesso di lesione polipoide esofitica che tende ad ulcerarsi. Il comportamento non è particolarmente aggressivo, ma con variazioni notevoli. Non frequenti comunque le metastasi a distanza.
Carcinoma adenosquamoso[modifica | modifica wikitesto]
Variante molto rara che unisce gli aspetti del carcinoma squamoso a quelli tipici dell'adenocarcinoma, con alta aggressività e prognosi severa[85].
Linfoepitelioma[modifica | modifica wikitesto]
Anche denominato carcinoma linfoepiteliale Epstein-Barr like, per la frequente associazione con il virus Epstein-Barr, è una rara forma di carcinoma (quindi ad origine epiteliale, malgrado il nome) in cui gli aspetti istologici di raggruppamenti di cellule poligonali o indifferenziate con nuclei molto cromatici si associano ad una massiccia presenza di infiltrazione linfocitaria. Macroscopicamente si presenta come una massa infiltrante che tende all'invasione in profondità piuttosto che verso la superficie, e tipicamente si localizza nelle zone dove è maggiormente presente tessuto linfatico, ovvero nelle strutture che compongono l'anello di Waldeyer, quindi al confine tra cavità orale ed orofaringe.
Profilo clinico[modifica | modifica wikitesto]
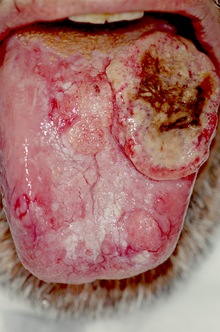
I segni e sintomi del carcinoma della bocca nei primi stadi possono essere molto lievi, quando non del tutto assenti. La lesione negli stadi iniziali si può presentare come piccola ulcerazione non tendente a guarigione spontanea, o evolvere da una lesione di tipo eritroplasico o leucoplasico, e l'unico sintomo potrà essere un lieve bruciore o dolore allo stimolo meccanico. Talvolta si potrà avere un aspetto già in partenza esofitico-papillare o polipoide, o infiltrativo-nodulare, di consistenza dura e con bordi leggermente rilevati. In questo caso il sintomo sarà quello della sensazione di variazione di consistenza o presenza di massa solida. In alcuni casi i diversi aspetti potranno coesistere, o presentarsi in zone differenti (lesioni sincrone). Il sintomo doloroso può comparire piuttosto tardivamente e in forma lieve e intermittente, o nella forma di bruciore, per poi aggravarsi, raggiungendo livelli estremamente elevati. In relazione a questo, e per l'interessamento dei muscoli linguali si può avere disfagia, difficoltà e/o dolore alla fonazione, e talvolta sanguinamento spontaneo o provocato dal traumatismo. Nel caso di estensione al distretto orofaringeo e rinofaringeo ci potrebbe essere otalgia e nei casi più gravi si può arrivare alla difficoltà alla respirazione. Altri sintomi legati all'estensione locale, qualora ci sia invasione delle strutture ossee, saranno la mobilità e successiva perdita dei denti per distruzione dei tessuti di supporto, e la parestesia o l'anestesia di nervi per compressione, in particolare il nervo alveolare inferiore, in caso di invasione del canale in cui decorre.
Il coinvolgimento linfonodale, avvertibile come rigonfiamento dei linfonodi, interessa circa il 40% dei pazienti con carcinoma orale al momento della diagnosi[86], e può essere in alcuni casi precoce, e non raramente può risultare il primo sintomo avvertito della patologia neoplastica. Non necessariamente però questo sintomo sarà da correlare sempre a metastatizzazione, in quanto a volte si tratta della reazione specifica alla presenza della neoplasia in sede originaria. I linfonodi interessati dipendono dalla sede di insorgenza della lesione, venendo solitamente colpiti per primi i tributari, che raccolgono il drenaggio linfatico dalla sede di partenza. Nel caso di localizzazione anteriore (labbra, pavimento anteriore della bocca e porzione anteriore della lingua) i linfonodi coinvolti in via primaria sono i sottomentali e sottomandibolari, mentre nelle zone orali posteriori (palato, trigoni retromolari) possono essere coinvolti i linfonodi periauricolari e parotidei. Successivamente vengono interessati i distretti cervicali inferiori, in successione, ma sono comunque possibili salti di stazioni linfonodali, o localizzazioni controlaterali, soprattutto nel caso di neoplasie poste vicino alla linea mediana.
La disseminazione a distanza per via ematica è invece meno frequente e di solito tardiva, quindi solitamente correlata ad una stadiazione del tumore originario già molto avanzata. L'organo più comunemente coinvolto è il polmone[1].
Profilo diagnostico[modifica | modifica wikitesto]
Esami di laboratorio e strumentali[modifica | modifica wikitesto]
L'esame obiettivo può solo individuare la presenza di uno stato di alterazione della normale struttura delle mucose, prestandosi ad un variabilità interpretativa eccessiva[87], e i sistemi diagnostici a bassa invasività finora proposti non sembrano a loro volta aver ancora raggiunto un livello di efficacia soddisfacente[88][89][90].

Ad oggi quindi il prelievo tramite biopsia viene ancora considerato il gold standard[91][92], permettendo tramite l'esame istologico del campione raccolto la determinazione delle modificazioni cellulari (citologia) e dell'alterazione della morfologia tissutale (istologia) tipiche della patologia neoplastica. In particolare trova maggiore indicazione la tecnica incisionale, a meno di trovarsi di fronte a lesioni di piccole dimensioni, ben delimitate. La biopsia escissionale, infatti, nel caso frequente di lesioni infiltranti comporta il facile rischio di non comprendere totalmente la lesione neoplastica, aumentando nel caso di conferma della presenza di malignità il pericolo di disseminazione e una maggiore difficoltà nell'identificare i margini della lesione nel successivo intervento chirurgico. Il prelievo bioptico deve comprendere anche una parte di tessuto sano, e nel caso di lesioni di aspetto ampio e non uniforme, è consigliabile un prelievo multiplo, per non incorrere in falsi negativi. L'uso di una tecnica di colorazione vitale, ad esempio con il blu di toluidina, proposto a suo tempo come metodica diagnostica ma rivelatosi poco adatto allo scopo, può in alcuni casi aiutare a definire meglio i limiti del prelievo, particolarmente nel caso di lesioni in cui predomina l'aspetto atrofico su quello ipercheratosico.

L'uso della diagnostica per immagini nel caso dei carcinomi orali non risulta utile per la diagnosi primaria, ma è fondamentale per determinarne la stadiazione, monitorando il livello di progressione locale e a distanza, per stabilire l'efficacia delle terapie, e per escludere la comparsa di nuove manifestazioni della patologia nel tempo. La semplice indagine radiografica bidimensionale ha valore molto limitato. L'uso della tomografia computerizzata (CT) ottiene migliori risultati, anche grazie alle nuove tecnologie di ricostruzione tridimensionale, ma non permette una buona visualizzazione dei tessuti molli, a meno di usare mezzi di contrasto specifici. La Risonanza Magnetica (RMN) permette una miglior visuale dei tessuti molli, avendo raggiunto nella sua ultima versione (DWI) un buon livello di risoluzione[93]. La tomografia a emissione di positroni o PET è l'esame principale per la determinazione di eventuale disseminazione metastatica, usando allo scopo dei radiotraccianti, principalmente il fluorodesossiglucosio, che viene assorbito in quantità molto maggiore dai tessuti tumorali rispetto alle cellule sane, venendo poi rilevato dal sensore della macchina, anche se con una definizione non molto elevata. Nuove apparecchiature, combinando le tecnologie PET e CT, permettono di unire i pregi di entrambe le metodiche, ottenendo così i migliori risultati possibili a livello di definizione e risposta diagnostica. Malgrado questo, il livello di precisione raggiunto non sembra ancora sufficiente per orientare in modo sicuro la scelta terapeutica[94][95].
Diagnosi differenziale[modifica | modifica wikitesto]
Vista la grande variabilità di aspetti con cui il carcinoma orale può manifestarsi, sono numerose le patologie orali che pongono necessità di diagnosi differenziale con la patologia neoplastica, il che spiega la difficoltà nel riuscire ad effettuare una diagnosi precoce.
La lesione iniziale limitata di aspetto ulcerante andrà prima di tutto differenziata dalle comuni lesioni da decubito, da ustione o da traumatismo, frequenti soprattutto nei portatori di protesi mobili, e dalle comuni ulcere di origine erpetica o aftosa. In questi casi è considerata valida la regola delle due settimane, per cui qualunque lesione ulcerata che non guarisce spontaneamente in massimo 15 giorni, dopo aver eliminato le possibili cause quando presenti, richiederà una diagnosi più approfondita, tramite biopsia.
La candidosi orale o mughetto, soprattutto nella sua forma erosiva o eritomatosa, ma anche nelle sue forme di lesione chiara (pseudomembranosa), può simulare gli aspetti di una lesione neoplastica iniziale, o di lesione precancerosa. Un trattamento antifungino topico, accompagnato da sciacqui con bicarbonato permetterà l'eliminazione della patologia, qualora di origine micotica.
Alcune lesioni di origine infettiva acute o croniche legate a patologie dentarie (parodontiti, osteiti), soprattutto se associate a stati di immunodepressione, possono in casi rari assumere caratteri di aggressività locale tali da porre il sospetto di lesioni neoplastiche. Un problema simile si può presentare per le osteonecrosi da bifosfonati. La storia clinica dei pazienti raccolta con una corretta anamnesi dovrebbe essere sufficiente per eliminare il dubbio.
Altre lesioni ulcerative di aspetto simile a quella neoplastica, di tipo persistente, sono quelle da sifilide, ma solo la lesione iniziale (sifiloma primario), che può durare parecchie settimane, può creare problemi di diagnosi differenziale, in quanto le lesioni secondarie e terziarie (gomme) si presentano in un quadro molto più ampio.
Il papilloma a cellule squamose, la più comune neoplasia benigna orale, così come l'affine condiloma da HPV, può creare allarme per l'aspetto di escrescenza sessile o peduncolata in grado talvolta di ulcerarsi in seguito a traumatismo, ma queste neoformazioni rimangono tipicamente di piccole dimensioni, presentando rivestimento epiteliale solitamente integro e crescita molto lenta. La trasformazione maligna è molto rara ma possibile, per cui se ne consiglia il monitoraggio periodico o, in caso di traumatismo frequente, l'escissione. Altre neoplasie benigne dei tessuti molli come il fibroma o il raro tumore a cellule granulose, di origine neurogena, possono richiedere l'esame istologico per eliminare il dubbio diagnostico.
La sialometaplasia necrotizzante è una lesione degenerativa acuta a carico delle ghiandole salivari minori di incerta origine (probabilmente ischemica), che compare come un nodulo che evolve in ulcerazione superficiale. Il dolore può essere variabile, e la risoluzione avviene spontaneamente nell'arco di alcune settimane[96].
Per quanto riguarda la cresta gengivale, zona comunque di non frequente localizzazione del carcinoma orale, la lesione benigna più comune in grado di indurre allarme è l'epulide, piccola neoformazione fibrosa polipoide di varia origine e aspetto istologico, tipicamente associata ad un dente, quasi sempre asintomatica.
La glossite rombica mediana, entità patologica oggi considerata una particolare forma di candidosi cronica, si manifesta come arrossamento o lesione rilevata al centro della lingua, poco o per niente sintomatica, non sanguinante. Istologicamente si osserva ipercheratosi associata ad un modesto grado di alterazione della normale struttura tissutale, ma senza aspetti di malignità. Può essere associata all'uso di spray contenenti corticosteroidi per il trattamento di patologie respiratorie su base allergica.
Diagnosi precoce[modifica | modifica wikitesto]
La presenza di un gran numero di patologie a carattere benigno in grado di confondersi con la neoplasia nei suoi primi stadi, quando è scarsamente sintomatica, è una delle cause principali della diagnosi tardiva tipica di questa forma di tumore. Per superare questo problema, sono state proposte diverse tecniche diagnostiche di rapida esecuzione e a minor tasso di impegno per paziente e medico allo scopo di poter essere utilizzate come screening[97][98]. Tra le più promettenti, la citologia esfoliativa (cytobrush) nelle sue varie versioni[99][100], i coloranti vitali[101], l'uso di particolari fonti di emissioni luminose in grado di visualizzare zone di mucosa con caratteristiche anomale tramite reazioni di chemioluminescenza o autofluorescenza[102] e, come sviluppo recente, test salivari e marker molecolari[103][104][105][106]. Nonostante i continui miglioramenti apportati nel tempo allo scopo di eliminare i problemi di sensibilità e specificità delle varie metodiche, allo stato attuale non sembrano esistere le condizioni per certificarne un uso routinario o per programmi di screening su larga scala[107][108][109][110][111].
Stadiazione[modifica | modifica wikitesto]
La classificazione di questi tumori utilizza una specifica codifica TNM per quantificare l'estensione locale e l'eventuale diffusione linfonodale e a distanza della neoplasia, e per creare una scala di gradazione (stadiazione) utile per indirizzare l'approccio terapeutico[112][113]. Per quanto riguarda la tipologia istologica più frequente, quella a cellule squamose, viene anche utilizzata una classificazione di gravità legata al livello di differenziazione cellulare (grading), che però si è rivelata poco significativa a livello prognostico, in quanto una notevole percentuale di queste neoplasie non presenta omogeneità istologica. Per superare questo problema, sono state proposte delle sistematiche di classificazione meno legate al giudizio soggettivo, come quella di Anneroth, che assegna un punteggio da 1 a 4 a sei differenti parametri istologici, per poi ottenere il valore del grading attraverso un punteggio finale complessivo, con risultati effettivamente più validi[114].
| Stadio | Descrizione |
|---|---|
| TX | Tumore primitivo non definibile |
| T0 | Non segni di tumore primitivo |
| Tis | Tumore in situ (non invasivo) |
| T1 | Dimensione massima < 2 cm di diametro |
| T2 | Dimensione massima compresa tra i 2 e 4 cm di diametro |
| T3 | Dimensione massima > 4 cm senza invasione delle strutture adiacenti |
| T4a (labbra) | Invasione delle strutture adiacenti (osso corticale, nervo alveolare inferiore, pavimento della bocca, pelle) |
| T4a (cavità orale) | Invasione delle strutture adiacenti (osso corticale, muscoli della lingua, seno mascellare, pelle) |
| T4b (labbra e cavità orale) | Invasione delle strutture adiacenti (spazi masticatori, spazi pterigoidei, base del cranio; inglobamento carotide interna) |
| NX | Metastasi linfonodali non definibili |
| N0 | Metastasi linfonodali non rilevabili |
| N1 | Metastasi in singolo linfonodo omolaterale, < 3 cm |
| N2 | Metastasi come specificato da N2a,b,c |
| N2a | Metastasi in singolo linfonodo omolaterale con dimensione maggiore tra 3 e 6 cm |
| N2b | Metastasi in più linfonodi omolaterali, nessuno dei quali di dimensione > 6 cm |
| N2c | Metastasi in più linfonodi bilaterali o controlaterali, nessuno dei quali di dimensione > 6 cm |
| N3 | Metastasi linfonodali di dimensione > 6 cm |
| MX | Metastasi a distanza non rilevabili |
| M0 | Assenza di metastasi a distanza |
| M1 | Presenza di metastasi a distanza |
| Stadio 0 | Tis N0 M0 |
|---|---|
| Stadio I | T1 N0 M0 |
| Stadio II | T2 N0 M0 |
| Stadio III | T1,T2 N1 M0 |
| T3 N0,N1 M0 | |
| Stadio IVa | T1-3 N2 M0 |
| T4a N0-2 M0 | |
| Stadio IVb | T1-4 N3 M0 |
| T4b N1-3 M0 | |
| Stadio IVc | T1-4 N1-3 M1 |
| Grado | Descrizione |
|---|---|
| G X: | Livello di differenziazione non definibile |
| Grado 1: | Ben differenziato < 25% cellule non differenziate |
| Grado 2: | Moderatamente differenziato < 50% cellule non differenziate |
| Grado 3: | Scarsamente differenziato < 75% cellule non differenziate |
| Grado 4: | Indifferenziato (anaplastico) > 75% cellule non differenziate |
Terapia[modifica | modifica wikitesto]
La scelta terapeutica per il carcinoma orale dipende principalmente dalla stadiazione del tumore al momento della diagnosi[115]. Negli stadi precoci, con lesione limitata, la terapia di scelta è quella chirurgica, a bassa invasività. Con la progressione e l'espansione locale (S I-II), la scelta può variare tra chirurgia e radioterapia, entrambi considerate ugualmente valide, a seconda delle sedi coinvolte. Con la progressione in S III-IV diventa indicato l'uso combinato delle due tecniche, associando anche la chemioterapia di supporto[116]. Questa può essere utilizzata sia successivamente all'intervento primario (terapia adiuvante) che in via preventiva (terapia neoadiuvante), approccio sulla cui utilità non esiste accordo[117][118]. Il tentativo di sostituire nei casi avanzati l'approccio chirurgico con tecniche meno demolitive, allo scopo di preservare organi delicati e di difficile ricostruzione, non sembra al momento fornire risultati promettenti[119].
Nella tecnica chirurgica, l'intervento di asportazione richiede necessariamente un'escissione con margini sufficientemente ampi della lesione[120], a cui molto spesso si associa lo svuotamento linfonodale, fasi sempre accompagnate dal necessario esame istologico dei reperti[121]. La tecnica del linfonodo sentinella proposta per limitare la necessità dello svuotamento linfonodale della zona cervicale, è allo studio, e sembra poter offrire una valida guida nella scelta dell'estensione della procedura[122][123]. In passato gli interventi più estesi erano pesantemente lesivi per la qualità della vita dei pazienti, comportando notevoli deficit funzionali e spesso anche estetici. Le moderne tecniche di microchirurgia ricostruttiva, implantologia e chirurgia estetica, applicate in molti casi contestualmente all'intervento di asportazione della massa tumorale[124][125], o pianificate in seconda fase[126], permettono oggi di diminuire sensibilmente queste problematiche, consentendo un recupero mediamente soddisfacente dal punto di vista funzionale ed estetico[127][128][129]. Quando necessario, possono essere utilizzate protesi mobili individuali[130][131]. Per il recupero di una corretta funzione fonatoria, della deglutizione e respirazione, viene inoltre utilizzato il supporto dello specialista in logopedia[132].
La radioterapia può essere del tipo a sorgente esterna, il cui utilizzo è stato implementato grazie alle nuove tecnologie, in grado di raggiungere un livello di precisione sempre più elevato (IMRT o radioterapia a intensità modulata)[133], oppure del tipo interno (brachiterapia)[134][135], o una combinazione delle due[136][137]. Come per la chirurgia, anche la radioterapia può prevedere l'associazione con un trattamento farmacologico[136][138].
Di recente hanno fatto la loro comparsa una nuova categoria di farmaci basati su meccanismi di tipo selettivo (targeted therapy), nati dalle scoperte nel campo della biologia molecolare delle cellule tumorali. Nel caso della neoplasia orale, prevede l'uso di un anticorpo monoclonale (cetuximab) che ha come bersaglio il recettore del fattore di crescita dell'epidermide (EGFR), da solo o in associazione alla radioterapia e a chemioterapici classici come il cisplatino e il fluorouracile[139]. Alcuni studi sembrano però mettere in dubbio il rapporto costo/beneficio di questo approccio[140].
Una nuova strategia terapeutica in fase avanzata di sperimentazione è la terapia genica. I primi studi giunti alla fase clinica sull'uomo sono orientati verso una delle alterazioni più comuni, quella della proteina p53[141].
Prognosi[modifica | modifica wikitesto]
La prognosi per questa tipologia di tumori si assesta in media su un valore di poco superiore al 50% di sopravvivenza a 5 anni[72][142][143], dato che però varia in maniera sensibile rispetto ad alcuni parametri. Tra tutti il più importante è la precocità della diagnosi, a cui è strettamente correlato il profilo TNM della neoplasia al momento della diagnosi stessa[144][145][146]. In particolare il livello di coinvolgimento linfonodale sembra essere un indicatore particolarmente significativo[147].
| Stadio | Labbra | Lingua | Pavimento della bocca | Gengive e altre sedi |
|---|---|---|---|---|
| I | 96% | 71% | 73% | 81% |
| II | 83% | 59% | 60% | 62% |
| III | 57% | 47% | 36% | 45% |
| IV | 48% | 37% | 30% | 40% |
Altri elementi in grado di influire sulla prognosi sono la posizione della lesione nel cavo orale, con una prognosi peggiore per i tumori della lingua rispetto alla localizzazione orale e delle labbra[149], il grado di differenziazione cellulare (grading), e l'istotipo[150]. In conseguenza alle scoperte nel campo della patogenesi tumorale sono in corso numerosi studi su marker o altri fattori che potrebbero rivelarsi utili ai fini prognostici[151][152][153].
Nel caso di pazienti in età pediatrica, i tassi di sopravvivenza non sembrano discostarsi da quelli dell'età adulta[154].
Prevenzione[modifica | modifica wikitesto]
Visto lo stretto legame tra precocità della diagnosi e prospettive di guarigione, e la scarsa conoscenza di questa forma di neoplasia tra la popolazione[155] e gli stessi medici ed odontoiatri, da alcuni anni sono state attivate delle campagne mirate allo scopo di aumentare la consapevolezza sui pericoli e le cause che possono condurre alla comparsa della patologia (prevenzione primaria), e sulla necessità di non sottovalutare alcuni tipi di lesioni orali quando non tendono alla guarigione spontanea in tempi brevi, recandosi presso il proprio dentista di fiducia per un controllo (prevenzione secondaria). L'OMS ha creato a tal fine delle linee guida all'interno del proprio programma globale per la promozione della salute orale, in modo da indirizzare le iniziative dei paesi più a rischio[18].
In Italia un progetto in tale senso è stato avviato nel 2009 dalla Federazione Nazionale Ordini Medici Chirurghi e Odontoiatri (FNOMCeO)[156], individuando una specifica strategia d'azione (approccio tetra), basata sull'informazione degli operatori sanitari più presenti sul territorio, odontoiatri, medici di base e igienisti dentari, e creando una più stretta collaborazione tra questi e le strutture pubbliche del servizio sanitario nazionale meglio attrezzate per la diagnostica e il trattamento avanzato di questa patologia[157].
Un'altra iniziativa è stata avviata su base volontaria da parte della maggior organizzazione di dentisti italiani, l'Andi, sempre allo scopo di intercettare in fase precoce la malattia e informare sui rischi e necessità di controlli in caso di presenza di segni premonitori[158]. In particolare, nel mese designato, solitamente a maggio, viene organizzata una giornata dedicata all'informazione e alla sensibilizzazione denominata "Oral Cancer Day", offrendo per un periodo prestabilito visite gratuite mirate specificatamente alla ricerca dei segni di patologia o di condizioni precancerose presso i dentisti partecipanti[159].
Note[modifica | modifica wikitesto]
- ^ a b c (EN) aa. vv., Tumours of the Oral Cavity and Oropharynx, in Pathology and Genetics of Head and Neck Tumours (PDF), IARC Scientific Publication, 2005, pp. 163-181, ISBN 92-832-2417-5. URL consultato il 4 ottobre 2013 (archiviato dall'url originale il 24 settembre 2015).
- ^ (EN) Shukla S, Shukla S, Oral cancer-curse, cure and challenge, in Indian J Surg, vol. 74, n. 6, Springer, dicembre 2012, pp. 437-439, DOI:10.1007/s12262-012-0769-0, PMID 24293895, PMC 3537986.
- ^ (EN) Fact stats-world, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Parkin DM, Bray F, Ferlay J, Pisani P, Global cancer statistics, 2002, in CA Cancer J Clin., vol. 55, n. 2, John Wiley & Sons, Mar-Apr 2005, pp. 74-108, DOI:10.3322/canjclin.55.2.74, PMID 15761078.
- ^ (EN) Incidence/Mortality > Dual multi-bar chart: populations/sexes by cancer 20 highest in the world, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) India estimated cancer incidence, all ages: both sexes, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Jemal A, et al, Global cancer statistics, in CA Cancer J Clin, vol. 61, n. 2, John Wiley & Sons, Mar-Apr 2011, pp. 69-90, DOI:10.3322/caac.20107, PMID 21296855.
- ^ (EN) Italy (2012) estimated cancer incidence, all ages: both sexes, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Italy (2012) estimated cancer incidence, all ages: male, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Italy (2012) estimated cancer incidence, all ages: female, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Italy (2012) estimated cancer mortality, all ages: both sexes, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Italy (2012) estimated cancer mortality, all ages: male, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Italy (2012) estimated cancer mortality, all ages: female, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Analisi e interpretazioni per sede tumorale i dati dei registri tumori 1986-1997 (PDF), in Gli andamenti temporali della patologia oncologica in Italia: i dati dei Registri tumori (1986-1997), Associazione italiana dei registri tumori (AIRTUM). URL consultato il 12 febbraio 2013.
- ^ (EN) World- Both Sexes estimated incidence by age, in Globocan 2012, International Agency for research on Cancer-WHO. URL consultato l'11 maggio 2014.
- ^ (EN) Zygogianni AG, et al, Oral squamous cell cancer: early detection and the role of alcohol and smoking, in Head Neck Oncology, vol. 3, n. 2, 6 gennaio 2011, DOI:10.1186/1758-3284-3-2, PMC 3022893.
- ^ (EN) Rosenquist K, Risk factors in oral and oropharyngeal squamous cell carcinoma: a population-based case-control study in southern Sweden, in Swed Dent J Suppl, n. 179, 2005, pp. 1-66, PMID 16335030.
- ^ a b (EN) Petersen P E, Oral cancer prevention and control-the approach of the World Health Organization (PDF), in Oral Oncology, vol. 45, n. 4-5, Apr-Marzo 2009, pp. 454-460, DOI:10.1016/j.oraloncology.2008.05.023, PMID 18804412. URL consultato il 2 febbraio 2013.
- ^ (EN) Foulkes WD, et al, Familial risks of squamous cell carcinoma of the head and neck: retrospective case-control study, in BMJ, vol. 313, n. 7059, British Medical Association, 21 settembre 1996, pp. 716-721, PMID 8819440, PMC 2352110.
- ^ (EN) Johnson N, Tobacco use and oral cancer: a global perspective, in J Dent Educ, vol. 65, n. 4, American Dental Education Association, aprile 2001, pp. 328-339, PMID 11336118. URL consultato il 14 febbraio 2013 (archiviato dall'url originale il 25 febbraio 2015).
- ^ (EN) Freedman ND, et al, Prospective investigation of the cigarette smoking-head and neck cancer association by sex, in Cancer, vol. 110, n. 7, American Cancer Society, 1º ottobre 2007, pp. 1593-1601, DOI:10.1002/cncr.22957, PMID 17724671.
- ^ (EN) Cancer Control and Population Sciences, Cigars: Health Effects and Trends (PDF), in Smoking and Tobacco Control Monographs, vol. 9, National Cancer Institute, 1998, pp. 120-127. URL consultato il 2 febbraio 2013 (archiviato dall'url originale il 7 febbraio 2017).
- ^ (EN) Chang CM, et al, Systematic review of cigar smoking and all cause and smoking related mortality, in BMC Public Health, vol. 15, n. 1, BioMed Central, 24 aprile 2015, p. 390, DOI:10.1186/s12889-015-1617-5, PMID 25907101, PMC 4408600.
- ^ (EN) Henley SJ, et al, Association between exclusive pipe smoking and mortality from cancer and other diseases, in J Natl Cancer Inst, vol. 96, n. 11, Oxford University Press, 2 giugno 2004, pp. 853-861, DOI:10.1093/jnci/djh144, PMID 15173269.
- ^ (EN) Gupta P C, Meht F S, Pindborg J, Mortality among reverse chutta smokers in south India (PDF), in British Medical Journal (Clin Res Ed), vol. 289, n. 6449, 6 ottobre 1984, pp. 865-866, PMID 6434115, PMC 1443430. URL consultato il 2 febbraio 2013.
- ^ (EN) Alvarez Gómez G J, et al., Reverse smokers's and changes in oral mucosa. Department of Sucre, Colombia (PDF), in Med Oral Patol Oral Cir Bucal, vol. 13, n. 2, 1º gennaio 2008, pp. E 1-8, PMID 18167472. URL consultato il 2 febbraio 2013.
- ^ (EN) The World Health Organization IARC Expert Group, Tobacco Habits other than Smoking;Betel-Quid and Areca-Nut Chewing; and some Related Nitrosamines (PDF), in IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 37, IARC Press, 1985, pp. 89-140. URL consultato il 26 aprile 2015.
- ^ a b (EN) Znaor A, et al, Independent and combined effects of tobacco smoking, chewing and alcohol drinking on the risk of oral, pharyngeal and esophageal cancers in Indian men, in int J Cancer, vol. 105, n. 5, John Wiley & Sons, 10 luglio 2003, pp. 681-686, DOI:10.1002/ijc.11114, PMID 12740918.
- ^ (EN) Khan Z, Tönnies J, Müller S, Smokeless tobacco and oral cancer in South Asia: a systematic review with meta-analysis, in J Cancer Epidemiol, vol. 2014, Hindawi, 2014, p. 394696, DOI:10.1155/2014/394696, PMID 25097551, PMC 4109110.
- ^ (EN) Takezaki T, et al, Tobacco, alcohol and dietary factors associated with the risk of oral cancer among Japanese, in Jpn J Cancer Res, vol. 87, n. 6, John Wiley & Sons, giugno 1996, pp. 555-562, DOI:10.1111/j.1349-7006.1996.tb00259.x, PMID 8766517.
- ^ (EN) Boffetta P, Hashibe M, Alcohol and cancer (PDF), in Lancet Oncol, vol. 7, n. 2, Elsevier, febbraio 2006, pp. 149-156, PMID 16455479. URL consultato il 20 gennaio 2013 (archiviato dall'url originale il 19 aprile 2013).
- ^ (EN) Hashibe M, et al, Interaction between tobacco and alcohol use and the risk of head and neck cancer: pooled analysis in the International Head and Neck Cancer Epidemiology Consortium, in Cancer Epidemiol Biomarkers Prev, vol. 18, n. 2, American Association for Cancer Research, febbraio 2009, pp. 541-550, DOI:10.1158/1055-9965.EPI-08-0347, PMID 19190158, PMC 3051410.
- ^ (EN) Ferreira Antunes JL, et al, Joint and independent effects of alcohol drinking and tobacco smoking on oral cancer: a large case-control study, in PLOS One, vol. 8, n. 7, PLOS, 10 luglio 2013, p. e68132, DOI:10.1371/journal.pone.0068132, PMID 23874521, PMC 3707956.
- ^ (EN) Lachenmeier DW, Alcohol-containing mouthwash and oral cancer--can epidemiology prove the absence of risk?, in Ann Agric Environ Med, vol. 19, n. 3, 2012, pp. 609-610, PMID 23020065. URL consultato il 15 febbraio 2013.
- ^ (EN) Gandini S, et al, Mouthwash and oral cancer risk quantitative meta-analysis of epidemiologic studies, in Ann Agric Environ Med, vol. 19, n. 2, 2012, pp. 173-180, PMID 22742785. URL consultato il 15 febbraio 2013.
- ^ (EN) The World Health Organization IARC Expert Group, Betel-quid and Areca-nut Chewing and Some Areca-nut-derived Nitrosamines (PDF), in IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 87, IARCPress, 2004. URL consultato il 26 aprile 2015.
- ^ (EN) Sharan R N, et al, Association of betel nut with carcinogenesis: revisit with a clinical perspective, in PLOS One, vol. 7, n. 8, PLOS, 2012, p. e42759, DOI:10.1371/journal.pone.0042759, PMID 22912735, PMC 3418282.
- ^ (EN) Little MA, et al, The reasons for betel-quid chewing scale: assessment of factor structure, reliability, and validity, in BMC Oral Health, vol. 14, Springer Science+Business Media, 3 giugno 2014, p. 62, DOI:10.1186/1472-6831-14-62, PMID 24889863, PMC 4059468.
- ^ (EN) Petti S, Masood M, Scully C, The magnitude of tobacco smoking-betel quid chewing-alcohol drinking interaction effect on oral cancer in South-East Asia. A meta-analysis of observational studies, in PLOS One, vol. 8, n. 11, PLOS, 18 novembre 2013, p. e78999, DOI:10.1371/journal.pone.0078999, PMID 24260143, PMC 3832519.
- ^ (EN) The impact of qat-chewing on health: a re-evaluation, su al-bab.com, The British-Yemeni Society, agosto 2005. URL consultato il 26 aprile 2015 (archiviato dall'url originale il 7 giugno 2010).
- ^ (EN) Gan LL, et al, Prevalence of human papillomavirus infection in oral squamous cell carcinoma: a case-control study in Wuhan, China, in Asian Pac J Cancer Prev, vol. 15, n. 14, National Cancer Center of Korea, Editorial Office, 2014, pp. 5861-5865, DOI:10.7314/APJCP.2014.15.14.5861, PMID 25081714.
- ^ (EN) Khode SR, et al., Exploring the link between human papilloma virus and oral and oropharyngeal cancers, in J Cancer Res Ther, vol. 10, n. 3, Wolters Kluwer, luglio-settembre 2014, pp. 492-498, DOI:10.4103/0973-1482.138213, PMID 25313727.
- ^ (EN) Poling JS, et al., Human papillomavirus (HPV) status of non-tobacco related squamous cell carcinomas of the lateral tongue, in Oral Oncol, vol. 50, n. 4, Elsevier, aprile 2014, pp. 306-310, DOI:10.1016/j.oraloncology.2014.01.006, PMID 24485566, PMC 3972491.
- ^ (EN) Rushatamukayanunt P, et al, Lack of association between high-risk human papillomaviruses and oral squamous cell carcinoma in young Japanese patients, in Asian Pac J Cancer Prev, vol. 15, n. 10, National Cancer Center of Korea, 2014, pp. 4135-4141, DOI:10.7314/APJCP.2014.15.10.4135, PMID 24935359.
- ^ (EN) Pavia M., et al, Association between fruit and vegetable consumption and oral cancer: a meta-analysis of observational studies, in Am J Clin Nutr., vol. 83, n. 5, The American Society for Nutrition, maggio 2006, pp. 1126-1134, PMID 16685056. URL consultato il 26 gennaio 2013.
- ^ (EN) Bravi F, et al, Foods, nutrients and the risk of oral and pharyngeal cancer, in Br J Cancer, vol. 109, n. 11, Nature Publishing Group, 26 novembre 2013, pp. 2904-2910, DOI:10.1038/bjc.2013.667, PMID 24149181, PMC 3844916.
- ^ (EN) Galeone C, et al, Coffee and tea intake and risk of head and neck cancer: pooled analysis in the international head and neck cancer epidemiology consortium, in Cancer Epidemiol Biomarkers Prev, vol. 19, n. 7, American Association for Cancer Research, 6 luglio 2010, pp. 1723-1736, DOI:10.1158/1055-9965.EPI-10-0191, PMID 20570908, PMC 3047460.
- ^ (EN) Hildebrand JS, et al, Coffee, tea, and fatal oral/pharyngeal cancer in a large prospective US cohort, in Am J Epidemiol, vol. 177, n. 1, Oxford University Press, 1º gennaio 2013, pp. 50-58, DOI:10.1093/aje/kws222, PMID 23230042.
- ^ (EN) Xu J, et al, Meat consumption and risk of oral cavity and oropharynx cancer: a meta-analysis of observational studies, in PLOS One, vol. 9, n. 4, PLOS, 15 aprile 2014, p. e95048, DOI:10.1371/journal.pone.0095048, PMID 24736706, PMC 3988178.
- ^ (EN) Lam TK, et al, Dietary fiber and grain consumption in relation to head and neck cancer in the NIH-AARP Diet and Health Study, in cancer causes Control, vol. 22, n. 10, Springer Science+Business Media, ottobre 2011, pp. 1405-1414, DOI:10.1007/s10552-011-9813-9, PMID 21785948, PMC 3215506.
- ^ (EN) Öhman J, et al, Oral and lip cancer in solid organ transplant patients--a cohort study from a Swedish Transplant Centre, in Oral Oncol, vol. 51, n. 2, Elsevier, febbraio 2015, pp. 146-150, DOI:10.1016/j.oraloncology.2014.11.007, PMID 25497104.
- ^ (EN) Kubota E, Kurokawa H, Katsuki T, Evaluation of the serum level of immunosuppressive substance in oral cancer patients (abstract), in J Oral Maxillofac Surg, vol. 49, n. 2, Elsevier, febbraio 1991, pp. 121-126, DOI:10.1016/0278-2391(91)90097-6, PMID 1990088.
- ^ (EN) Rotundo LD, et al, Are recurrent denture-related sores associated with the risk of oral cancer? A case control study, in Rev Bras Epidemiol, vol. 16, n. 3, ABRASCO, settembre 2013, pp. 705-715, DOI:10.1590/S1415-790X2013000300014, PMID 24896283.
- ^ (EN) Moergel M, et al, Chronic periodontitis and its possible association with oral squamous cell carcinoma - a retrospective case control study, in Head Face Med, vol. 9, BioMed Central, 9 dicembre 2013, p. 39, DOI:10.1186/1746-160X-9-39, PMID 24321243, PMC 4029401.
- ^ (EN) Wen BW, et al, Cancer risk among gingivitis and periodontitis patients: a nationwide cohort study, in QJM, vol. 107, n. 4, Oxford University Press, aprile 2014, pp. 283-290, DOI:10.1093/qjmed/hct248, PMID 24336850.
- ^ a b (EN) A digital manual for the early diagnosis of oral neoplasia, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 27 gennaio 2013.
- ^ (EN) Rivera C, Venegas B, Histological and molecular aspects of oral squamous cell carcinoma (Review), in Oncol Lett, vol. 8, n. 1, Spandidos Publications, luglio 2014, pp. 7-11, DOI:10.3892/ol.2014.2103, PMID 24959211, PMC 4063640.
- ^ (EN) Gupta B, Johnson NW, Emerging and established global life-style risk factors for cancer of the upper aero-digestive tract, in Asian Pac J Cancer Prev, vol. 15, n. 15, 2014, pp. 5983-5991, DOI:10.7314/APJCP.2014.15.15.5983, PMID 25124561.
- ^ (EN) Martin CL, et al, Chromosomal imbalances in oral squamous cell carcinoma. Examination of 31 cell lines and review of the literature, in Oral Oncol, vol. 44, n. 4, Elsevier, agosto 2007, pp. 369-382, PMID 17681875, PMC 2362065.
- ^ (EN) Jurel SK, et al, Genes and oral cancer, in Indian J Hum Genet, vol. 20, n. 1, Wolters Kluwer, gennaio 2014, pp. 4-9, DOI:10.4103/0971-6866.132745, PMID 24959008, PMC 4065477.
- ^ (EN) Yoshida R, et al, The pathological significance of Notch1 in oral squamous cell carcinoma, in Lab Invest, vol. 93, n. 10, Nature Publishing Group, ottobre 2013, pp. 1068-81, DOI:10.1038/labinvest.2013.95, PMID 23938602.
- ^ (EN) Perez-Ordoñez B, Beauchemin M, Jordan RCK, Molecular biology of squamous cell carcinoma of the head and neck, in J Clin Pathol, vol. 59, n. 5, Association of Clinical Pathologists-BMJ Group, maggio 2006, pp. 445-453, PMID 16644882, PMC 1860277.
- ^ (EN) India Project Team of the International Cancer Genome Consortium, Mutational landscape of gingivo-buccal oral squamous cell carcinoma reveals new recurrently-mutated genes and molecular subgroups, in Nat Commun, vol. 4, Nature Publishing Group, 2013, p. 2873, DOI:10.1038/ncomms3873, PMID 24292195, PMC 3863896.
- ^ (EN) Bundela S, Sharma A, Bisen PS, Potential therapeutic targets for oral cancer: ADM, TP53, EGFR, LYN, CTLA4, SKIL, CTGF, CD70, in PLOS One, vol. 9, n. 7, PLOS, 16 luglio 2014, p. e102610, DOI:10.1371/journal.pone.0102610, PMID 25029526, PMC 4110113.
- ^ (EN) Jung S, et al, Analysis of angiogenic markers in oral squamous cell carcinoma-gene and protein expression, in Head Face Med, vol. 11, Springer, 5 giugno 2015, p. 19, DOI:10.1186/s13005-015-0076-7, PMID 26044849, PMC 4461981.
- ^ (EN) Tanaka T, Ishigamori R, Understanding Carcinogenesis for Fighting Oral Cancer, in J Oncol, vol. 2011, Hindawi, 2011, p. 603740, DOI:10.1155/2011/603740, PMID 21772845, PMC 3136173.
- ^ (EN) Dost F, et al, Malignant transformation of oral epithelial dysplasia: a real-world evaluation of histopathologic grading, in Oral Surg Oral Med Oral Pathol Oral Radiol, vol. 117, n. 3, Elsevier, marzo 2014, pp. 279-290, DOI:10.1016/j.oooo.2013.09.017, PMID 22549675.
- ^ (EN) Manchanda A, Shetty DC, Reproducibility of grading systems in oral epithelial dysplasia, in Med Oral Patol Oral Cir Bucal, vol. 17, n. 6, 1º novembre 2012, pp. e935-942, DOI:10.4317/medoral.17749, PMID 22549675, PMC 3505713.
- ^ (EN) Yang Y, et al, Progress risk assessment of oral premalignant lesions with saliva miRNA analysis, in BMC Cancer, 13numero=, Springer, 19 marzo 2013, p. 129, DOI:10.1186/1471-2407-13-129, PMID 23510112, PMC 3637283.
- ^ (EN) Abdulmajeed A A, Farah C S, Gene Expression Profiling for the Purposes of Biomarker Discovery in Oral Potentially Malignant Lesions: A Systematic Review, in Clin Med Insights Oncol, vol. 7, Libertas Academica, 31 ottobre 2013, pp. 279-290, DOI:10.4137/CMO.S12950, PMID 24250244, PMC 3825664.
- ^ (EN) Leukoplakia, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 17 febbraio 2013.
- ^ a b (EN) Neville BW, Day TA, Oral cancer and precancerous lesions, in CA Cancer J Clin, vol. 52, n. 4, John Wiley & Sons, luglio-Ago 2002, pp. 195-215, DOI:10.3322/canjclin.52.4.195, PMID 12139232. URL consultato il 17 febbraio 2013.
- ^ a b (EN) Messadi DV, Diagnostic aids for detection of oral precancerous conditions, in Int J Oral Sci, vol. 5, n. 2, Nature Publishing Group, giugno 2013, pp. 59-65, DOI:10.1038/ijos.2013.24, PMID 23743617, PMC 3707069.
- ^ (EN) Farah C S, et al, Oral cancer and oral potentially malignant disorders, in Int J Dent, vol. 2014, Hindawi Publishing Corporation, 2014, p. 853479, DOI:10.1155/2014/853479, PMID 24891850, PMC 4033498.
- ^ (EN) van der Waal I, Oral potentially malignant disorders: is malignant transformation predictable and preventable?, in Med Oral Patol Oral Cir Bucal, vol. 19, n. 4, 1º luglio 2014, pp. e386-390, DOI:10.4317/medoral.20205, PMID 24905952, PMC 4119315.
- ^ (EN) Reichart PA, Philipsen HP, Oral erythroplakia--a review (PDF) (abstract), in Oral Oncol, vol. 3841, n. 6, Elsevier, luglio 2005, pp. 551-561, PMID 15975518. URL consultato il 17 febbraio 2013 (archiviato dall'url originale il 22 giugno 2015).
- ^ (EN) WHO histological classification of tumours of the oral cavity and oropharynx, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 27 gennaio 2013.
- ^ (EN) Sixto-Requeijo R, et al, An analysis of oral biopsies extracted from 1995 to 2009, in an oral medicine and surgery unit in Galicia (Spain), in Med Oral Patol Oral Cir Bucal, vol. 17, n. 1, 1º gennaio 2012, pp. e16-22, DOI:10.4317/medoral.17143, PMID 21743423, PMC 3448179.
- ^ (EN) George J, Narang RS, Rao NN, Indian J Dent Res, vol. 23, n. 6, Wolters Kluwer, novembre dicembre 2012, p. 842, DOI:10.4103/0970-9290.111291, PMID 23649085, https://oadoi.org/10.4103/0970-9290.111291.
- ^ (EN) Wirsing AM, et al, Characterisation and prognostic value of tertiary lymphoid structures in oral squamous cell carcinoma, in BMC Cancer, vol. 14, BioMed Central, 23 agosto 2014, p. 38, DOI:10.1186/1472-6890-14-38, PMID 25177210, PMC 4148494.
- ^ (EN) Samman M, et al, Next-generation sequencing analysis for detecting human papillomavirus in oral verrucous carcinoma, in Oral Surg Oral Med Oral Pathol Oral Radiol, vol. 118, n. 1, Elsevier, luglio 2014, pp. 117-125.e1, DOI:10.1016/j.oooo.2014.03.018, PMID 24908602.
- ^ (EN) Xie S, et al, Basaloid squamous cell carcinoma of the maxillary gingiva: A case report and review of the literature, in Oncol Lett, vol. 8, n. 3, Spandidos Publications, settembre 2014, pp. 1287-1290, DOI:10.3892/ol.2014.2318, PMID 25120708, PMC 4114586.
- ^ (EN) Hanemann JA, et al, Expression of E-cadherin and β-catenin in basaloid and conventional squamous cell carcinoma of the oral cavity: are potential prognostic markers?, in BMC Cancer, vol. 14, BioMed Central, 3 giugno 2014, p. 395, DOI:10.1186/1471-2407-14-395, PMID 24893577, PMC 4049437.
- ^ (EN) Reyes M, et al, Sarcomatoid (spindle cell) carcinoma of tongue: a report of two cases, in Case Rep Dent, vol. 2015, Hindawi Publishing Corporation, 2015, p. 780856, DOI:10.1155/2015/780856, PMID 25785207, PMC 4346690.
- ^ (EN) Ishida M, et al, Adenosquamous carcinoma of the tongue: a case report with review of the literature, in Int J Clin Exp Pathol, vol. 7, n. 4, e-Century Publishing Corporation, 15 marzo 2014, pp. 1809-13, PMID 24817985, PMC 4014269.
- ^ (EN) Noguti J, et al, Metastasis from oral cancer: an overview, in Cancer Genomics Proteomics, vol. 9, n. 5, International Institute of Anticancer Research, sett-ott 2012, pp. 329-335, PMID 22990112. URL consultato il 16 febbraio 2013.
- ^ (DE) Awan Kh, Oral Cancer: Early Detection is Crucial, in J Int Oral Health, vol. 6, n. 5, International Society of Preventive and Community Dentistry, settembre 2014, pp. i-ii, PMID 25395811, PMC 4229841.
- ^ (EN) Patton LL, Epstein JB, Kerr AR, Adjunctive techniques for oral cancer examination and lesion diagnosis: a systematic review of the literature, in J Am Dent Assoc, vol. 139, n. 7, American Dental Association, luglio 2008, pp. 896-905, PMID 18594075. URL consultato il 16 febbraio 2013.
- ^ (EN) Kazanowska K, Hałoń A, Radwan-Oczko M, The role and application of exfoliative cytology in the diagnosis of oral mucosa pathology - contemporary knowledge with review of the literature (PDF), in Adv Clin Exp Med, vol. 23, n. 1, marzo-aprile 2014, pp. 299-305, PMID 24913123. URL consultato il 14 giugno 2015.
- ^ (EN) Ujaoney S, et al, Evaluation of chemiluminescence, toluidine blue and histopathology for detection of high risk oral precancerous lesions: A cross-sectional study, in BMC Clin Pathol, vol. 12, BioMed Central, 12 marzo 2012, p. 6, DOI:10.1186/1472-6890-12-6, PMID 22410295, PMC 3315728.
- ^ (DE) Hullmann M, et al, Oral cytology: historical development, current status, and perspectives, in Mund Kiefer Gesichtschir, vol. 11, n. 1, Springer Science+Business Media, gennaio 2007, pp. 1-9, PMID 17177045.
- ^ (EN) Carreras-Torras C, Gay-Escoda C, Techniques for early diagnosis of oral squamous cell carcinoma: Systematic review, in Med Oral Patol Oral Cir Bucal, vol. 20, n. 3, 1º maggio 2015, pp. e305-315, DOI:10.4317/medoral.20347, PMID 25662554.
- ^ (EN) Gődény M, Prognostic factors in advanced pharyngeal and oral cavity cancer; significance of multimodality imaging in terms of 7th edition of TNM, in Cancer Imaging, vol. 14, Springer, 28 aprile 2014, p. 15, DOI:10.1186/1470-7330-14-15, PMID 25608735, PMC 4331821.
- ^ (EN) Schöder H, et al, 18F-FDG PET/CT for detecting nodal metastases in patients with oral cancer staged N0 by clinical examination and CT/MRI, in J Nucl Med, vol. 47, n. 5, Society of Nuclear Medicine and Molecular Imaging, maggio 2006, pp. 755-762, PMID 16644744. URL consultato il 16 febbraio 2013.
- ^ (EN) Ng SH, et al, 18F-FDG PET and CT/MRI in oral cavity squamous cell carcinoma: a prospective study of 124 patients with histologic correlation, in J Nucl Med, vol. 46, n. 7, Society of Nuclear Medicine and Molecular Imaging, luglio 2005, pp. 1136-1143, PMID 16000282. URL consultato il 16 febbraio 2013.
- ^ (EN) Uppal N, Baliga M, Necrotizing sialometaplasia: A rare lesion that mimics oral cancer clinically and histopathologically, in Otolaryngol Pol, vol. 68, n. 3, Elsevier, maggio-giugno 2014, pp. 154-156, DOI:10.1016/j.otpol.2013.07.004, PMID 24837912.
- ^ (EN) Masthan KM, et al, Advanced diagnostic aids in oral cancer, in Asian Pac J Cancer Prev, vol. 13, n. 8, National Cancer Center, 2012, pp. 3573-3576, DOI:10.7314/APJCP.2012.13.8.3573, PMID 23098535.
- ^ (EN) Omar E, Current concepts and future of noninvasive procedures for diagnosing oral squamous cell carcinoma--a systematic review, in Head Face Med, vol. 11, n. 1, Springer, 25 marzo 2015, p. 6, DOI:10.1186/s13005-015-0063-z, PMID 25889859, PMC 4396078.
- ^ (EN) Gupta S, et al, Clinical correlative study on early detection of oral cancer and precancerous lesions by modified oral brush biopsy and cytology followed by histopathology, in J Cancer Res Ther, vol. 10, n. 2, Wolters Kluwer, aprile-giugno 2014, pp. 232-238, DOI:10.4103/0973-1482.136539, PMID 25022371.
- ^ (EN) Reddy SP, Ramani P, Nainani P, Confocal microscopy and exfoliative cytology, in J Oral Maxillofac Pathol, vol. 17, n. 2, Wolters Kluwer, maggio 2013, pp. 217-221, DOI:10.4103/0973-029X.119746, PMID 24250082, PMC 3830230.
- ^ (EN) Riaz A, et al, Methylene blue as an early diagnostic marker for oral precancer and cancer, in Springerplus, vol. 2, n. 1, Springer, dicembre 2013, p. 95, DOI:10.1186/2193-1801-2-95, PMID 23524482, PMC 3602613.
- ^ (EN) Mendes SF, et al, Techniques for precancerous lesion diagnosis, in J Oncol, vol. 59, n. 5, Hindawi Publishing Corporation, 13 gennaio 2011, pp. 445-453, DOI:10.1155/2011/326094, PMID 21318165, PMC 3026985.
- ^ (EN) Prasad G, McCullough M, Chemokines and cytokines as salivary biomarkers for the early diagnosis of oral cancer, in Int J Dent, vol. 2013, Hindawi, 2013, p. 813756, DOI:10.1155/2013/813756, PMID 24376459, PMC 3860143.
- ^ (EN) Shah S, Kaur M, Biomarkers and chemopreventives in oral carcinogenesis and its prevention, in J Oral Maxillofac Pathol, vol. 18, n. 1, Wolters Kluwer, gennaio 2014, pp. 69-76, DOI:10.4103/0973-029X.131914, PMID 24959040, PMC 4065451.
- ^ (EN) Cheng YS, Rees T, Wright J, A review of research on salivary biomarkers for oral cancer detection, in Clin Transl Med, vol. 3, n. 1, Springer, 24 febbraio 2014, p. 3, DOI:10.1186/2001-1326-3-3, PMID 24564868, PMC 3945802.
- ^ (EN) Yang Y, et al, Quantitative Proteomic Analysis of Oral Brush Biopsies Identifies Secretory Leukocyte Protease Inhibitor as a Promising, Mechanism-Based Oral Cancer Biomarker, in PLOS One, vol. 9, n. 4, PLOS, 18 aprile 2014, p. e95389, DOI:10.1371/journal.pone.0095389, PMID 24748380, PMC 3991667.
- ^ (EN) Hanken H, et al, The detection of oral pre- malignant lesions with an autofluorescence based imaging system (VELscope™) - a single blinded clinical evaluation, in Head Face Med, vol. 9, Springer, 23 agosto 2013, p. 23, DOI:10.1186/1746-160X-9-23, PMID 23967796, PMC 3851797.
- ^ (EN) Shashidara R, Sreeshyla HS, Sudheendra US, Chemiluminescence: a diagnostic adjunct in oral precancer and cancer: a review, in J Cancer Res Ther, vol. 10, n. 3, Wolters Kluwer, luglio-settembre 2014, pp. 487-491, DOI:10.4103/0973-1482.138215, PMID 25313726.
- ^ (EN) Brocklehurst P, et al, Screening programmes for the early detection and prevention of oral cancer (abstract), in Cochrane Database Syst Rev, vol. 11, 19 novembre 2013, p. CD004150, DOI:10.1002/14651858.CD004150.pub4, PMID 24254989.
- ^ (EN) Kujan O, Sloan P, Dilemmas of oral cancer screening: an update, in Asian Pac J Cancer Prev, vol. 14, n. 5, National Cancer Center, 2013, pp. 3369-3373, DOI:10.7314/APJCP.2013.14.5.3369, PMID 23803131.
- ^ (EN) Olson CM, et al, Screening for Oral Cancer: A Targeted Evidence Update for the U.S. Preventive Services Task Force [Internet], in Evidence Syntheses, vol. 102, Agency for Healthcare Research and Quality, aprile 2013, PMID 23617014.
- ^ (EN) TNM classification of carcinomas of the oral cavity, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 17 gennaio 2013.
- ^ (EN) Snehal G. Patel, Jatin P Shah, TNM Staging of Cancers of the Head and Neck: Striving for Uniformity Among Diversity (PDF), in CA: A Cancer Journal for Clinicians, vol. 55, John Wiley & Sons, luglio 2005, pp. 242-258, PMID 16020425. URL consultato il 15 gennaio 2013 (archiviato dall'url originale il 3 febbraio 2013).
- ^ (EN) Akhter M, et al, A study on histological grading of oral squamous cell carcinoma and its co-relationship with regional metastasis, in J Oral Maxillofac Pathol, vol. 15, n. 2, Wolters Kluwer, maggio 2011, pp. 168-176, DOI:10.4103/0973-029X.84485, PMID 22529575, PMC 3329698.
- ^ (EN) Treatment options for oral cavity and oropharyngeal cancer by stage, su cancer.org, American Cancer Society. URL consultato il 7 febbraio 2013.
- ^ (EN) Huang SH, O'Sullivan B, Oral cancer: Current role of radiotherapy and chemotherapy, in Med Oral Patol Oral Cir Bucal, vol. 18, n. 2, 5 febbraio 2013, pp. e233-240, DOI:10.4317/medoral.18772, PMID 23385513, PMC 3613874.
- ^ (EN) Kessler P, et al, Neoadjuvant and adjuvant therapy in patients with oral squamous cell carcinoma Long-term survival in a prospective, non-randomized study (abstract), in Br J Oral Maxillofac Surg, vol. 46, n. 1, Elsevier, gennaio 2008, pp. 1-5, DOI:10.1016/j.bjoms.2007.08.006, PMID 17931758.
- ^ (EN) Bossi P, et al, Preoperative chemotherapy in advanced resectable OCSCC: long-term results of a randomized phase III trial, in Ann Oncol, vol. 25, n. 2, Oxford University Press, febbraio 2014, pp. 462-466, DOI:10.1093/annonc/mdt555, PMID 24401930.
- ^ (EN) Chinn SB, et al, Efficacy of induction selection chemotherapy vs primary surgery for patients with advanced oral cavity carcinoma, in JAMA Otolaryngol Head Neck Surg, vol. 140, n. 2, American Medical Association, febbraio 2014, pp. 134-142, DOI:10.1001/jamaoto.2013.5892, PMID 24370563, PMC 4103099.
- ^ (EN) Cankovic M, et al, The histological characteristics of clinically normal mucosa adjacent to oral cancer, in J Cancer Res Ther, vol. 9, n. 2, Wolters Kluwer, aprile-giugno 2013, pp. 240-244, DOI:10.4103/0973-1482.113365, PMID 23771366.
- ^ (EN) Ravi SB, Annavajjula S, Surgical margins and its evaluation in oral cancer: a review, in J Clin Diagn Res, vol. 8, n. 9, JCDR Research and Publications, settembre 2014, pp. ZE01-5, DOI:10.7860/JCDR/2014/9755.4836, PMID 25386547, PMC 4225999.
- ^ (EN) Ravi SB, et al, Long term results of sentinel lymph node biopsy in early oral squamous cell carcinoma, in Onco Targets Ther, vol. 6, Dove Press, 25 giugno 2013, pp. 799-802, DOI:10.2147/OTT.S43446, PMID 23836993, PMC 3699346.
- ^ (EN) Bassi KK, et al, The first and second echelon sentinel lymph node evaluation in oral cancer, in Indian J Surg, vol. 75, n. 5, Springer, ottobre 2013, pp. 377-382, DOI:10.1007/s12262-012-0497-5, PMID 24426480, PMC 3824774.
- ^ (EN) George RK, Krishnamurthy A, Microsurgical free flaps: Controversies in maxillofacial reconstruction, in Ann Maxillofac Surg, vol. 3, n. 1, Wolters Kluwer, gennaio 2013, pp. 72-79, DOI:10.4103/2231-0746.110059, PMID 23662264, PMC 3645616.
- ^ (EN) Singh S, Singh RK, Pandey M, Nasolabial flap reconstruction in oral cancer, in World J Surg Oncol, vol. 10, Springer, 30 ottobre 2012, p. 227, DOI:10.1186/1477-7819-10-227, PMID 23110587, PMC 3544680.
- ^ (EN) Romeo U, et al, Soft tissue management and prosthetic rehabilitation in a tongue cancer patient, in Case Rep Dent, vol. 2013, Hindawi, 2013, p. 475186, DOI:10.1155/2013/475186, PMID 24319601, PMC 3844260.
- ^ (EN) Azuma M, et al, Mandibular reconstruction using plates prebent to fit rapid prototyping 3-dimensional printing models ameliorates contour deformity, in Head Face Med, vol. 10, Springer, 23 ottobre 2014, p. 45, DOI:10.1186/1746-160X-10-45, PMID 25338640, PMC 4213462.
- ^ (EN) Deshmukh A, et al, Tongue flap revisited, in J Cancer Res Ther, vol. 9, n. 2, Wolters Kluwer, aprile-giugno 2013, pp. 215-218, DOI:10.4103/0973-1482.113354, PMID 23771361.
- ^ (EN) Wang X, et al, Functional tongue reconstruction with the anterolateral thigh flap, in World J Surg Oncol, vol. 11, Springer, 25 novembre 2013, p. 303, DOI:10.1186/1477-7819-11-303, PMID 24274671, PMC 3879093.
- ^ (EN) Mantri SS, et al, Scope of prosthodontic services for patients with head and neck cancer, in Indian J Cancer, vol. 49, n. 1, Wolters Kluwer, gennaio-marzo 2012, pp. 39-45, DOI:10.4103/0019-509X.98917, PMID 22842167.
- ^ (EN) Fierz J, Hallermann W, Mericske-Stern R, Patients with oral tumors. Part 1: Prosthetic rehabilitation following tumor resection [collegamento interrotto], in Schweiz Monatsschr Zahnmed, vol. 123, n. 2, 2013, pp. 91-105, PMID 23512240. URL consultato il 2 giugno 2015.
- ^ (EN) Tarsitano A, et al, Functional results of microvascular reconstruction after hemiglossectomy: free anterolateral thigh flap versus free forearm flap, in Acta Otorhinolaryngol Ital, vol. 33, n. 6, Pacini Editore, dicembre 2013, pp. 374-379, PMID 24376292, PMC 3870442.
- ^ (EN) Studer G, et al, Follow up after IMRT in oral cavity cancer: update, in Radiat Oncol, n. 7, Bio Med Central, 11 giugno 2012, p. 84, DOI:10.1186/1748-717X-7-84, PMID 22686297, PMC 3488022.
- ^ (EN) Yamazaki H, et al, High dose rate brachytherapy for oral cancer, in J Radiat Res, vol. 54, n. 1, Oxford University Press, gennaio 2013, pp. 1-17, DOI:10.1093/jrr/rrs103, PMID 23179377, PMC 3534285.
- ^ (EN) Liu Z, Huang S, Zhang D, High dose rate versus low dose rate brachytherapy for oral cancer--a meta-analysis of clinical trials, in PLOS One, vol. 8, n. 6, PLOS, 10 giugno 2013, p. e65423, DOI:10.1371/journal.pone.0065423, PMID 23762369, PMC 3677879.
- ^ a b (EN) Matsumoto K, et al, Treatment outcome of high-dose-rate interstitial radiation therapy for patients with stage I and II mobile tongue cancer, in Jpn J Clin Oncol, vol. 43, n. 10, Oxford University Press, ottobre 2013, pp. 1012-1017, DOI:10.1093/jjco/hyt108, PMID 23906605.
- ^ (EN) Unetsubo T, et al, High-dose-rate brachytherapy using molds for lip and oral cavity tumors, in Radiat Oncol, vol. 10, n. 1, Oxford University Press, 8 aprile 2015, p. 81, DOI:10.1186/s13014-015-0390-z, PMID 25888772.
- ^ (EN) Tano T, et al, Immunochemoradiotherapy for patients with oral squamous cell carcinoma: augmentation of OK-432-induced helper T cell 1 response by 5-FU and X-ray irradiation, in Neoplasia, vol. 15, n. 7, Neoplasia Press, luglio 2013, pp. 805-814, PMID 23814492, PMC 3689243.
- ^ (EN) Vermorken JB, et al, Platinum-based chemotherapy plus cetuximab in head and neck cancer, in N Engl J Med, vol. 359, n. 11, Massachusetts Medical Society, 11 settembre 2008, pp. 1116-1127, DOI:10.1056/NEJMoa0802656, PMID 18784101.
- ^ (EN) Hannouf MB, et al, Cost-effectiveness of adding cetuximab to platinum-based chemotherapy for first-line treatment of recurrent or metastatic head and neck cancer, in PLOS ONE, vol. 7, n. 6, Public Library of Science, 20 giugno 2012, pp. e38557, DOI:10.1371/journal.pone.0038557, PMID 22745668, PMC 3379991.
- ^ (EN) Li Y, et al, Selective intra-arterial infusion of rAd-p53 with chemotherapy for advanced oral cancer: a randomized clinical trial, in BMC Med, vol. 12, BioMed Central, 30 gennaio 2014, p. 16, DOI:10.1186/1741-7015-12-16, PMID 24479409, PMC 3922639.
- ^ (EN) Wolff KD, Follmann M, Nast A, The diagnosis and treatment of oral cavity cancer, in Dtsch Arztebl Int, vol. 109, n. 48, Deutscher Arzte-Verlag GmbH, novembre 2012, pp. 829-835, DOI:10.3238/arztebl.2012.0829, PMID 23248713, PMC 3523261.
- ^ (EN) Wang B, et al, The recurrence and survival of oral squamous cell carcinoma: a report of 275 cases, in Chin J Cancer, vol. 32, n. 11, Springer, novembre 2013, pp. 614-618, DOI:10.5732/cjc.012.10219, PMID 23601241, PMC 3845544.
- ^ (EN) Kreppel M, et al, Prognostic value of the sixth edition of the UICC's TNM classification and stage grouping for oral cancer (abstract), in J Surg Oncol, vol. 102, n. 5, John Wiley & Sons, 1º ottobre 2010, pp. 443-449, DOI:10.1002/jso.21547, PMID 20872947.
- ^ (EN) de Araújo RF Jr, et al, Prognostic significance of the anatomical location and TNM clinical classification in oral squamous cell carcinoma (PDF), in Med Oral Patol Oral Cir Bucal, vol. 13, n. 6, 1º giugno 2008, pp. E344-347, PMID 17931758. URL consultato l'11 febbraio 2013.
- ^ (EN) Fan Y, et al, Survival analysis of oral squamous cell carcinoma in a subgroup of young patients, in Asian Pac J Cancer Prev, vol. 15, n. 20, 2014, pp. 8887-8891, DOI:10.7314/APJCP.2014.15.20.8887, PMID 25374224.
- ^ (EN) Patel SG, et al, Lymph node density in oral cavity cancer: results of the International Consortium for Outcomes Research, in Br J Cancer, vol. 109, n. 8, Nature Publishing Group, 15 ottobre 2013, pp. 2087-2095, DOI:10.1038/bjc.2013.570, PMID 24064974, PMC 3798966.
- ^ (EN) aa.vv., SEER Survival Monograph: Cancer Survival Among Adults: U.S. SEER Program, 1988-2001, Patient and Tumor Characteristics (PDF), NHI, 2007, p. 15.
- ^ (EN) Sopravvivenza: i dati dei Registri tumori (PDF), in I tumori in Italia - Rapporto 2007, Associazione italiana dei registri tumori (AIRTUM). URL consultato il 12 febbraio 2013 (archiviato dall'url originale il 16 aprile 2015).
- ^ (EN) Pereira MC, Oliveira DT, Landman G, Kowalski LP, Histologic subtypes of oral squamous cell carcinoma: prognostic relevance (PDF), in J Can Dent Assoc, vol. 73, n. 4, Canadian Dental Association, maggio 2007, pp. 339-344, PMID 17484800. URL consultato l'11 febbraio 2013.
- ^ (EN) Sharma M, et al, Molecular changes in invasive front of oral cancer, in J Oral Maxillofac Pathol, vol. 17, n. 2, Wolters Kluwer, maggio 2013, pp. 240-247, DOI:10.4103/0973-029X.119740, PMID 24250086, PMC 3830234.
- ^ (EN) Jadhav KB, Gupta N, Clinicopathological prognostic implicators of oral squamous cell carcinoma: need to understand and revise, in N Am J Med Sci, vol. 5, n. 12, Wolters Kluwer, dicembre 2013, pp. 671-679, DOI:10.4103/1947-2714.123239, PMID 24404549, PMC 3877528.
- ^ (EN) Hsin CH, et al, High level of plasma matrix metalloproteinase-11 is associated with clinicopathological characteristics in patients with oral squamous cell carcinoma, in PLOS ONE, vol. 9, n. 11, Public Library of Science, 25 novembre 2014, pp. e113129, DOI:10.1371/journal.pone.0113129, PMID 25423087, PMC 4244114.
- ^ (EN) Morris LG, Ganly I, Outcomes of oral cavity squamous cell carcinoma in pediatric patients, in Oral Oncol, vol. 46, n. 4, Elsevier, aprile 2010, pp. 292-296, DOI:10.1016/j.oraloncology.2010.01.015, PMID 20188621, PMC 2889246.
- ^ (EN) Panzarella V, et al, Diagnostic delay in oral squamous cell carcinoma: the role of cognitive and psychological variables, in Int J Oral Sci, vol. 6, n. 1, Nature Publishing Group, marzo 2014, pp. 39-45, DOI:10.1038/ijos.2013.88, PMID 24287962, PMC 3967306.
- ^ I dentisti sentinella dichiarano guerra al cancro della bocca, su portale.fnomceo.it, FNOMCeO. URL consultato il 1º febbraio 2013 (archiviato dall'url originale il 7 marzo 2016).
- ^ Lo Muzio L, Il carcinoma orale progetto di prevenzione primaria e secondaria per operatori sanitari odontoiatrici “t.a.c.c.o.” (tetra azione contro cancro orale) (PDF) [collegamento interrotto], su omco.pd.it, FNOMCeO. URL consultato il 1º febbraio 2013.
- ^ Le iniziative di ANDI e Fondazione ANDI a tutela della salute orale, su fondazioneandi.org, Fondazione ANDI Onlus. URL consultato il 18 gennaio 2013.
- ^ Oral Cancer Day, su oralcancerday.it, Associazione Nazionale Dentisti Italiani. URL consultato il 16 luglio 2013 (archiviato dall'url originale il 23 luglio 2013).
Bibliografia[modifica | modifica wikitesto]
- Stanley L. Robbins, Ramzi S. Cotran; Vinay Kumar, La basi patologiche delle malattie, II, 4ª ed., Padova, Piccin, 1992 [1989], pp. 937-938, ISBN 88-299-1083-X.
- Bruno De Michelis, Remo Modica; Giorgio Re, Clinica Odontostomatologica, Edizioni Minerva Medica, 1992, pp. 339-348, ISBN 88-7711-146-1.
- Fabrizio Montagna, Giuseppe Ferronato; Franco Martinelli, Patologia orale orientata per problemi: diagnosi differenziale e terapia, Edizioni Promoass, 2000, pp. 63-68, 324, ISBN 88-87109-02-8.
- Vito Terribile Wiel Marin, Lezioni di Anatomia Patologica Odontostomatologica, Cleup editrice, 1992, pp. 81-93, ISBN 88-7178-163-5.
- Stella Blandamura Piazza, Elementi di citologia del cavo orale, Cleup editrice, 1993, pp. 58-63, ISBN 88-7178-212-7.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su carcinoma della bocca
Wikimedia Commons contiene immagini o altri file su carcinoma della bocca
Collegamenti esterni[modifica | modifica wikitesto]
- Faq sul cancro orale a cura della Società Italiana di Patologia e Medicina Orale (SIPMO), su sipmo.it.
- AIRC – Associazione Italiana Ricerca sul cancro: Tumore alla bocca, su airc.it.
- (EN) - Tumore orale nel sito del National Cancer Institute, su cancer.gov.
- (EN) - Tumore orale nel sito dei Centers for Disease Control and Prevention
- (EN) - sito della Oral Cancer Foundation, associazione non profit americana, su oralcancerfoundation.org.
| Controllo di autorità | LCCN (EN) sh92005236 · GND (DE) 4040733-0 · J9U (EN, HE) 987007534490905171 · NDL (EN, JA) 00575602 |
|---|