Phtalocyanine

| Phtalocyanine | |
 | |
| Structure de la phtalocyanine | |
| Identification | |
|---|---|
| Nom systématique | tétrabenzotétraazaporphyrine |
| Synonymes | C.I. Pigment Blue 16, |
| No CAS | |
| No ECHA | 100.008.527 |
| No CE | 209-378-3 |
| DrugBank | DB12983 |
| PubChem | 86280045 |
| ChEBI | 34921 |
| SMILES | |
| InChI | |
| Apparence | poudre bleue inodore[1] |
| Propriétés chimiques | |
| Formule | C32H18N8 [Isomères] |
| Masse molaire[2] | 514,538 9 ± 0,028 5 g/mol C 74,7 %, H 3,53 %, N 21,78 %, |
| Propriétés physiques | |
| T° fusion | > 250 °C[1] (décomposition) |
| Solubilité | pratiquement insoluble dans l'eau[1] |
| Masse volumique | 1,44 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | > 400 °C[1] |
| Précautions | |
| NFPA 704[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
La phtalocyanine, ou H2Pc, est un composé aromatique macrocyclique de formule chimique (C8H4N2)4H2. Il s'agit d'un solide bleu ayant de nombreuses applications dans les encres et les peintures ainsi qu'en photoélectricité. Structurellement apparentée aux colorants organiques tels que porphyrines et cyanines, la molécule est constituée de quatre unités isoindole liées par des atomes d'azote. H2Pc est à géométrie bidimensionnelle formant un système conjugué à 18 électrons π. Cette délocalisation électronique confère à la molécule des propriétés intéressantes à l'origine de ses applications dans les pigments et les teintures. Les complexes métalliques du dianion Pc2−, base conjuguée de H2Pc, ont des applications en catalyse, en cellules photovoltaïques organiques et en thérapie photodynamique.
Le pigment de phtalocyanine a été développé dans les années 1930 et est très utilisé aujourd'hui dans la fabrication des peintures. La phtalocyanine se retrouve également dans la composition des disques enregistrables (CD-R / colorant phtalocyanine, couche d’or métallique)[4].
Propriétés[modifier | modifier le code]
La phtalocyanine et les complexes métalliques dérivés (MPc) tendent à s'agréger et, par conséquent, ont une faible solubilité dans les solvants habituels[5]. Le benzène à 40 °C dissout moins d'un milligramme de H2Pc ou de CuPc par litre. H2Pc et CuPc se dissolvent facilement dans l'acide sulfurique en raison de la protonation des atomes d'azote pontant les cycles pyrrole. De nombreux composés de phtalocyanine sont très stables thermiquement et ne fondent pas mais peuvent être sublimés. Le CuPc se sublime à plus de 500 °C sous gaz inertes (azote, CO2)[6]. Les complexes de phtalocyanine substitués ont souvent une solubilité bien plus élevée[7]. Ils sont moins stables thermiquement et souvent ne peuvent pas être sublimés. Les phtalocyanines non substituées absorbent fortement la lumière entre 600 et 700 nm, ces matériaux sont donc bleus ou verts[5]. La substitution peut déplacer l'absorption vers des longueurs d'onde plus élevées, en changeant la couleur du bleu pur au vert en incolore (lorsque l'absorption est dans le proche infrarouge).
Il existe de nombreux dérivés de la phtalocyanine substitués ou analogues, dans lesquels par exemple des atomes de carbone du macrocycle sont remplacés par des atomes d'azote, ou des atomes d'hydrogène périphériques sont remplacés par des groupes fonctionnels tels que halogènes, hydroxyle, amine, alkyle, aryle, thiol, alcoxyle ou nitrosyle. Ces modifications permettent d'ajuster les propriétés électrochimiques de la molécule telles que la longueur d'onde d'absorption et d'émission et la conductance[8].
- Microscopie à effet tunnel d'une molécule de phtalocyanine aux potentiels −2 et +1 V[9]. Noter que cette image restitue la densité électronique dans les orbitales HOMO et LUMO et non la forme des atomes.
Synthèse et composés apparentés[modifier | modifier le code]
La phtalocyanine se forme par chauffage des dérivés de l'acide phtalique qui contiennent des groupes fonctionnels azotés. Les précurseurs classiques pour la préparation des phtalocyanines sont le phtalonitrile, le diiminoisoindole (en), l'anhydride phtalique et le phtalimide[10]. Chauffer de l'anhydride phtalique en présence d'urée est également une voie efficace pour la synthèse de H2Pc[11]. Ces réactions sont plus efficaces en présence de sels métalliques. L’o-cyanobenzamide et le phtalimide sont d'autres précurseurs. De nombreux réactifs de départ sont connus comme indiqué dans la figure ci-contre. En utilisant de telles méthodes, de l'ordre de 57 000 tonnes de dérivés de phtalocyanines avaient été produits en 1985[11].
Les dérivés halogés et sulfonatés de phtalocyanines de cuivre sont commercialement importants. Ces composés sont préparés par traitement de CuPc avec du chlore ou de l’oléum.
- Synthèse à partir d'un dérivé d'acide phtalique en présence d'urée.
- Voies de synthèse possibles.
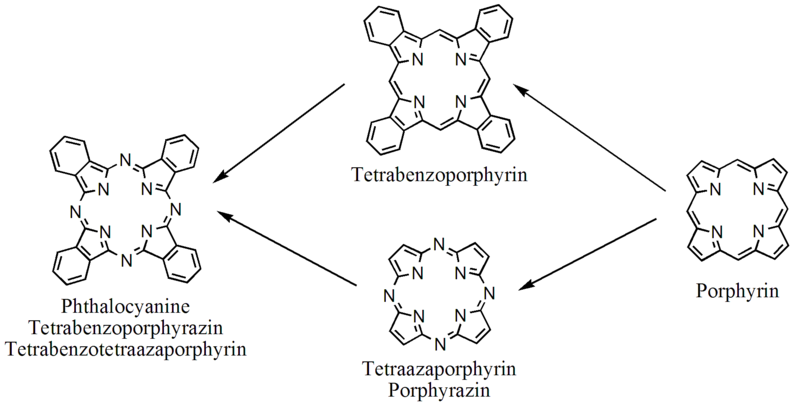
Les phtalocyanines sont structurellement apparentées à d'autres macrocycles tétrapyrroles tels que les porphyrines et les porphyrazines (en). Elles présentent quatre sous-unités de type pyrrole formant un cycle intérieur à 16 atomes constitué alternativement de carbone et d'azote. Les naphtalocyanines (en) sont des analogues plus encombrants. Les cycles de type pyrrole des phtalocyanines sont étroitement apparentés à l'isoindole. Les porphyrines et les phtalocyanines se comportent comme des ligands dianioniques tétradentés qui se lient à un atomes métallique centre par leurs quatre atomes d'azote les plus internes. De tels complexes dérivent formellement de l'anion Pc2−, base conjuguée de H2Pc.
- Relations entre la phtalocyanine et le macrocycle porphyrinique.
Applications[modifier | modifier le code]
Les phtalocyanines sont utilisées comme colorants sur des supports de données optiques (CD-R) et comme pigments pour les plastiques, les peintures et dans l'industrie papetière. Elles peuvent également être utilisées comme photoconducteurs dans les imprimantes laser ou de matériau d'électrode dans les piles à combustible. Dans la recherche en chimie, la phtalocyanine est utilisée comme modèle facile à obtenir pour les porphyrines biologiquement importantes. Des dérivés de phtalocyanine sont par ailleurs utilisés en thérapie photodynamique[12]. Cela consiste à enrichir le tissu tumoral en phtalocyanines qui sont excitées par la lumière visible, dans une gamme de longueurs d'onde de 600 à 800 nm, ce qui libère de l'oxygène singulet. Celui-ci induit la mort cellulaire en quelques heures par nécrose et apoptose, ce qui conduit idéalement à la résorption de la tumeur en quelques semaines.
Pigment[modifier | modifier le code]
La phtalocyanine est à l'origine de plusieurs pigments bleus et verts :
- la phtalocyanine de cuivre (PB15) donne le bleu phtalo, un bleu moyen et neutre, souvent à l'origine du « bleu primaire » ou « bleu cyan ». Il possède les variantes stabilisées suivantes: forme alpha (PB15:1, PB15:2) à tendance rougeâtre, forme bêta (PB15:3, PB15:4) à tendance verdâtre et epsilon (PB15:6) à tendance très rougeâtre;
- la phtalocyanine sans métal (PB16) donne un bleu turquoise, foncé et plutôt terne, proche du turquoise de cobalt (PG50) ;
- la phtalocyanine de cuivre chloré (PG7) donne le vert phtalo (tendance bleue), un vert froid proche de l'émeraude ;
- la phtalocyanine de cuivre bromé (PG36) donne le vert phtalo (tendance jaune), un vert chaud. Ce pigment est à la base de nombreux verts (vert Véronèse, vert de Hooker, vert de vessie).
Tous sont des pigments transparents au bon pouvoir colorant donc à utiliser avec parcimonie, insoluble dans l'huile.
Ils sont très appréciés en mélanges.
- Pigment bleu phtalo PB15
- Pigment vert phtalo PG7
- Pigment vert phtalo PG36
Bleus contenant du PB15[modifier | modifier le code]
Économique et fiable, le pigment PB15 sert à la mise au point de nombreux bleus. Selon les marques, ces bleus obtenus portent des noms divers, plus ou moins fantaisistes : Bleu d'Orient, Bleu de France, Bleu nuit, Bleu persan, Bleu Manganèse Phtalo vert, Bleu Phtalo tendance Rouge, Bleu Lumière, Bleu Azural (Imitation), Bleu Touareg, Bleu Primaire, Bleu Indien, Bleu Acier, Bleu Espace, Bleu Océan, Bleu Hortensia, Bleu Hoggar, Bleu Céruléum (Imitation).
Les couleurs contenant du PB15:3 ont tendance à devenir vertes en mélange avec du blanc.
Couleurs[modifier | modifier le code]
Bleu Phtalo
Vert Phtalo
Colorant[modifier | modifier le code]
On l'utilise aussi sous forme de colorant de cuve ou de colorant réactif pour teindre des fibres textiles. Mais le prix est élevé.
Littérature[modifier | modifier le code]
« Le ciel était d'un bleu hivernal splendide, qui en paraissait presque artificiel ; un bleu de phtalocyanine. »
- - Michel Houellebecq ; La Carte et le Territoire ; Flammarion 2010
Arts[modifier | modifier le code]
De la phtalocyanine a été trouvée par la société Orion Analytical sur plus de vingt endroits du Saint Jérôme attribué à l'entourage du Parmigianino (1503-1540) lors de son expertise dans l'affaire de présumés faux tableaux d'art ancien en 2016[13].
Références[modifier | modifier le code]
- Entrée « Phthalocyanine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 août 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Phthalocyanine », sur Alfa Aesar (consulté le ).
- (en) « Electronic Media Collections Care for Small Museums and Archives » (consulté le )
- (en) Fatemeh Ghani, Juliane Kristen et Hans Riegler, « Solubility Properties of Unsubstituted Metal Phthalocyanines in Different Types of Solvents », Journal of Chemical & Engineering Data, vol. 57, no 2, , p. 439-449 (DOI 10.1021/je2010215, lire en ligne)
- (en) Hans J. Wagner, Rafik O. Loutfy et Cheng-Kuo Hsiao, « Purification and characterization of phthalocyanines », Journal of Materials Science, vol. 17, no 10, , p. 2781-2791 (DOI 10.1007/BF00644652, Bibcode 1982JMatS..17.2781W, S2CID 96336392, lire en ligne)
- (en) Victor N. Nemykin et Evgeny A. Lukyanets, « Synthesis of substituted phthalocyanines », Arkivok, no 1, , p. 136-208 (DOI 10.3998/ark.5550190.0011.104, lire en ligne)
- (en) P. F. Siles, T. Hahn, G. Salvan, M. Knupfer, F. Zhu, D. R. T. Zahn et O. G. Schmid, « Tunable charge transfer properties in metal-phthalocyanine heterojunctions », Nanoscale, vol. 8, no 16, , p. 8607-8617 (PMID 27049842, DOI 10.1039/C5NR08671J, Bibcode 2016Nanos...8.8607S, lire en ligne)
- (en) Marcella Iannuzzi, Fabien Tran, Roland Widmer, Thomas Dienel, Kevin Radican, Yun Ding, Jürg Hutter et Oliver Gröning, « Site-selective adsorption of phthalocyanine on h-BN/Rh(111) nanomesh », Physical Chemistry Chemical Physics, vol. 16, no 24, , p. 12374-12384 (PMID 24828002, DOI 10.1039/c4cp01466a, Bibcode 2014PCCP...1612374I, lire en ligne
 )
) - (en) Keiichi Sakamoto et Eiko Ohno-Okumura, « Syntheses and Functional Properties of Phthalocyanines », Materials, vol. 2, no 3, , p. 1127-1180 (PMCID 5445737, DOI 10.3390/ma2031127, Bibcode 2009Mate....2.1127S, lire en ligne)
- (en) Gerd Löbbert, « Phthalocyanines », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a20_213, lire en ligne)
- (de) Andreas Hirth, Ulrike Michelsen et Dieter Wöhrle, « Photodynamische Tumortherapie », Chemie in unserer Zeit, vol. 33, no 2, , p. 84-94 (DOI 10.1002/ciuz.19990330204, lire en ligne)
- (en) Vincent Noce, « Old Master saga: expert hired by vendor to prove Saint Jerome's authenticity says it is a fake », The Art Newspaper (en), (lire en ligne)