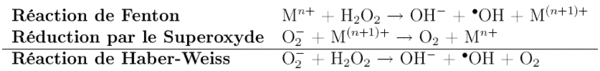Radical hydroxyle

| Radical hydroxyle | |
| Identification | |
|---|---|
| No CAS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | HO∙ |
| Masse molaire[2] | 17,007 3 ± 0,000 4 g/mol H 5,93 %, O 94,07 %, |
| Moment dipolaire | 1,655 ± 0,001 D[1] |
| Thermochimie | |
| ΔfH0gaz | 38,99 kJ mol−1 (radical)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le radical hydroxyle est le radical libre de formule chimique HO•.
Utilisation[modifier | modifier le code]
Il apparaît le plus souvent de façon transitoire dans les réactions radicalaires, souvent amorcées par des amorceurs radicalaires, par exemple en polymérisation. Il peut être stabilisé dans certains solvants aprotiques. Il est également utilisé en sonocatalyse, car les ultrasons sont capables de générer des radicaux hydroxyles à partir de molécules d'eau[4].
Production[modifier | modifier le code]
Il est produit par exemple lors de réactions de dissociation de peroxydes, en présence d'ions de métaux de transition (Fe(II), Cu(I), réaction de Fenton), de chauffage ou de rayonnement.
Dans l'atmosphère[modifier | modifier le code]
Ce radical hydroxyle (HO•) apparaît spontanément dans la vapeur d'eau atmosphérique sous l'effet du rayonnement solaire en présence de certains polluants tels que l'ozone et le protoxyde d'azote. Mais le radical HO• est si réactif qu'il disparait presque instantanément[5].
Ce caractère éphémère rend très difficile la mesure de l'HO•. On le cherche donc via des proxies, des produits chimiques interagissant avec l'hydroxyle ; c'est le cas par exemple du méthylchloroforme qui est interdit depuis plusieurs années (afin de protéger la couche d'ozone). Une diminution régulière de ce composé à la suite de cette réglementation indiquerait que l'hydroxyl est relativement constant dans l'atmosphère, une hypothèse mal prise en compte par la plupart des modèles qui concernent l'augmentation du méthane dans l'air, car HO• interagit notamment avec le méthane atmosphérique, qu'il détruit : c'est grâce à lui que le méthane naturel — puissant gaz à effet de serre — devrait disparaitre de l'atmosphère en une décennie environ[5].
Il se trouve que des années 1980 à 2015, le méthylchloroforme ne disparait pas de l'air avec la régularité attendue et que le méthane y augmente. Ceci pourrait évoquer des périodes de diminution de production de l'HO• dans l'atmosphère (si l'atmosphère perd de sa capacité oxydante, le méthane y perdurera plus longtemps). Le taux d'oxyde nitreux de l'air devrait diminuer grâce aux lois contre la pollution, mais peut-être en diminuant la teneur en HO•[5].
Il a aussi été noté que depuis quelques années le carbone du méthane atmosphérique tend à contenir des isotopes plus légers. Ces derniers sont plus souvent présents dans le carbone du métabolisme des êtres vivants, ce qui peut faire penser que ce méthane est émis par des microbes actuels, et non par des fuites liées à la fracturation hydraulique (ce méthane-là ayant une signature isotopique plus « lourde »), mais une autre explication plausible est que la fréquence accrue d'isotopes légers du carbone pourrait être due à une diminution de l'ion hydroxyle dans l'air, car l'HO• réagit préférentiellement avec du carbone plus lourd, laissant alors le méthane microbien persister plus longtemps dans l'atmosphère. La hausse du taux atmosphérique de méthane pourrait donc tout aussi bien être d'origine humaine plutôt qu'attribuée à une baisse des hydroxyles, ou plusieurs phénomènes coexistent en des proportions qui restent à éclaircir[5].
Notes et références[modifier | modifier le code]
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Amsterdam/Boston, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6.
- (en) Peyman Gholami, Alireza Khataee, Reza Darvishi Cheshmeh Soltani et Amit Bhatnagar, « A review on carbon-based materials for heterogeneous sonocatalysis: Fundamentals, properties and applications », Ultrasonics Sonochemistry, vol. 58, , p. 104681 (DOI 10.1016/j.ultsonch.2019.104681, lire en ligne, consulté le )
- Paul Voosen (2016), Why is atmospheric methane surging? (Hint: It's not fracking), Science, News du 21 décembre 2016.