Pertechnétate de sodium

| Pertechnétate de sodium | ||
 | ||
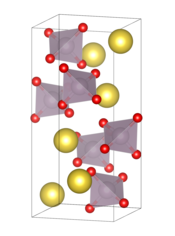 | ||
| __ Na+ __ Tc7+ __ O2− Structure cristalline (en bas) et en solution ionique (en haut) du pertechnétate de sodium | ||
| Identification | ||
|---|---|---|
| No CAS | (Na[TcO4]) (Na[99mTcO4]) | |
| No ECHA | 100.033.870 | |
| No CE | 237-273-2 | |
| PubChem | 9543089 (Na[TcO4]) 23689036 (Na[99mTcO4]) | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc à cristaux incolores | |
| Propriétés chimiques | ||
| Formule | Na[99mTcO4] | |
| Masse molaire[1] | 185 g/mol Na 12,43 %, O 34,59 %, Tc 53,46 %, | |
| Précautions | ||
 Composé radioactif | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
Le pertechnétate de sodium est un composé chimique de formule Na[TcO4]. Il s'agit d'un sel de l'acide pertechnétique HTcO4 :
L'anion pertechnétate [99mTcO4]−, obtenu sous forme de Na[99mTcO4] en sortie d'un générateur de technétium 99m, est utilisé en radiopharmacie, soit directement — en imagerie thyroïdienne ou en imagerie cérébrale lorsque la barrière hémato-encéphalique est déficiente — soit comme précurseur[2]. Le technétium 99m présente l'intérêt d'avoir une demi-vie courte de 6 heures et d'exposer les patients à des doses de ratiations faibles, ce qui permet d'injecter des activités de plus de 30 mCi. Na[99mTcO4] est précurseur de divers composés permettant d'imager différentes parties du corps[2].
À l'état solide, il cristallise dans le système tétragonal avec le groupe d'espace I41/a (no 88) et les paramètres a = 534,2 pm et c = 1 187,4 pm à 25 °C, et a = 529,45 pm et c = 1 174,70 pm à 100 K[3]. La distance Tc–O est de 173,1 pm et la distance Na–O est comprise entre 253,3 et 276,25 pm ; l'angle formé par les liaisons O–Tc–O est compris entre 108,03° et 112,4°[4].
Applications radiopharmaceutiques[modifier | modifier le code]
aLa demi-vie du technétium 99m est suffisamment longue pour permettre de réaliser des mesures scintigraphiques et radiopharmaceutiques sans perte significative de radioactivité[2]. L'énergie émise par 99mTc est de 140 keV, ce qui permet d'étudier des organes situés en profondeur dans l'organisme. Les composés radiopharmaceutiques au technétium n'ont pas d'effet pharmacologique et sont utilisés à très faibles concentrations. Ceux contenant du 99mTc sont utilisés pour déterminer la morphologie des organes, tester l'état de leurs fonctions et les imager par scintigraphie et tomographie d'émission monophotonique. Le rayonnement γ émis par ce radioisotope permet d'imager les organies par tomographie in vivo. Plus de 80 % des composés radiopharmaceutiques ayant une utilisation clinique sont marqués au 99mTc. La majorité d'entre eux sont produits par réduction de pertechnétate en présence de ligands choisis pour cibler spécifiquement l'organe à étudier. Le composé marqué au 99mTc qui en résulte est injecté dans l'organisme et suivi par imagerie γ donnant la distribution spatiale du 99mTc par sections ou plans successifs.
Le 99mTc est utilisé avant tout pour étudier la morphologie, la vascularisation et le fonctionnement de la thyroïde. Les anions pertechnétate TcO4− et iodure I− ont un rapport charge/rayon comparable qui leur permet d'être assimilés de la même manière dans la thyroïde. Cependant, l'ion pertechnétate n'est pas incorporé dans la thyroglobuline. Il est également utilisé pour le suivi des perfusions sanguines dans les lésions cérébrales dans la mesure où il s'accumule dans les plexus choroïdes.
Le pertechnétate de sodium ne franchit pas la barrière hémato-encéphalique. Outre la thyroïde et les glandes salivaires, 99mTcO4− s'accumule dans l'estomac. Il est éliminé par les reins dans les trois jours suivant son injection. On recommande aux patients de boire de grandes quantités d'eau après l'examen au 99mTc afin d'accélérer l'élimination du radionucléide[5]. Parmi les autres méthodes d'administration de 99mTcO4−, on note l'injection intrapéritonéale, intramusculaire, sous-cutanée ainsi que l'absorption orale. Le comportement du pertechnétate est essentiellement le même indépendamment des méthodes d'administration, avec des différences minimes résultant de différences dans les vitesses d'absorption[6].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Klaus Schwochau, « Technetium Radiopharmaceuticals—Fundamentals, Synthesis, Structure, and Development », Angewandte Chemie International Edition, vol. 33, no 22, , p. 2258-2267 (DOI 10.1002/anie.199422581, lire en ligne)
- (en) K. E. German, M. S. Grigoriev, B. L. Garashchenko, A. V. Kopytin et E. A. Tyupina, « Redetermination of the crystal structure of NaTcO4 at 100 and 296 K based on single-crystal X-ray data », Acta Crystallographica Section E, vol. 73, no 7, , p. 1037-1040 (PMID 28775877, PMCID 5499285, DOI 10.1107/S2056989017008362, lire en ligne)
- (en) Jamie Weaver, Chuck Z. Soderquist, Nancy M. Washton, Andrew S. Lipton, Paul L. Gassman, Wayne W. Lukens, Albert A. Kruger, Nathalie A. Wall et John S. McCloy, « Chemical Trends in Solid Alkali Pertechnetates », Inorganic Chemistry, vol. 56, no 5, , p. 2533-2544 (PMID 28221786, DOI 10.1021/acs.inorgchem.6b02694, lire en ligne)
- (en) S. K. Shukla, G. B. Manni et C. Cipriani, « Behaviour of the pertechnetate ion in humans », Journal of Chromatography B: Biomedical Sciences and Applications, vol. 143, no 5, , p. 522-526 (PMID 893641, DOI 10.1016/S0378-4347(00)81799-5, lire en ligne)
- (en) Muhammad Abdel Razzak, Mahmoud Naguib et Mohamed el-Garhy, « Fate of sodium pertechnetate-technetium-99m », Journal of Nuclear Medicine, vol. 8, no 1, , p. 50-59 (PMID 6019138, lire en ligne)