Iodoforme

| Iodoforme | ||
 | ||
 | ||
| Représentation de la molécule et poudre de iodoforme. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Triiodométhane | |
| No CAS | ||
| No ECHA | 100.000.795 | |
| No CE | 200-874-5 | |
| Apparence | cristaux jaunâtres | |
| Propriétés chimiques | ||
| Formule | CHI3 [Isomères] | |
| Masse molaire[1] | 393,732 1 ± 0,001 g/mol C 3,05 %, H 0,26 %, I 96,69 %, | |
| Propriétés physiques | ||
| T° fusion | 123 °C | |
| T° ébullition | 217 °C (explose) | |
| Solubilité | 0,1 g·l-1 (eau,20 °C) | |
| Masse volumique | 4,008 g·cm-3 | |
| Point d’éclair | 204 °C | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 9,25 ± 0,02 eV (gaz)[2] | |
| Précautions | ||
| SIMDUT[3] | ||
 D1A, | ||
| Directive 67/548/EEC | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 1,9×10-5 ppm haut : 1,1 ppm[4] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
L’iodoforme ou triiodométhane était autrefois l’antiseptique par excellence et c’est cette odeur qui caractérisait les cabinets médicaux.
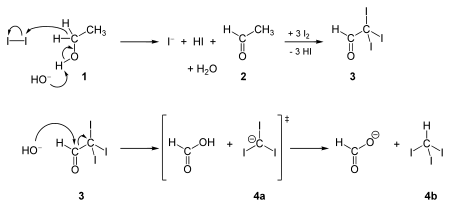
Les molécules qui renferment le groupe CH3-CO- ou CH3-CHOH- donnent, lorsqu’elles sont traitées par une solution alcaline de potassium iodé, un précipité jaune d’iodoforme (CHI3), dont l’odeur spéciale (un peu safranée) est caractéristique et tenace.
Synthèse[modifier | modifier le code]
Le premier rapport de préparation de l'iodoforme date de 1822 par Georges Serullas, et sa formule moléculaire a été identifiée par Jean-Baptiste Dumas en 1834. Elle a été synthétisée par réaction haloforme, réaction du diiode en milieu basique sur un des quatre types de composés suivants :
- une méthylcétone : CH3COR, où R est une chaîne organique ;
- l'acétaldéhyde (CH3CHO) ;
- l'éthanol (CH3CH2OH) ;
- et certains alcools secondaires, oxydables en méthylcétone (CH3CHROH, où R est un groupement alkyl ou aryl).
Cette réaction, appelée « test iodoforme », est utilisée pour la détection de méthylcétone par apparition d'un précipité jaune.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Iodoforme » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Iodoform », sur hazmap.nlm.nih.gov (consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Iodoform » (voir la liste des auteurs).