Hydrure de rubidium

| Hydrure de rubidium | |
 | |
| __ Rb+ __ H− | |
| Identification | |
|---|---|
| Nom UICPA | hydrure de rubidium |
| No CAS | |
| PubChem | 171411 |
| SMILES | |
| InChI | |
| Apparence | aiguilles prismatiques incolores[1] |
| Propriétés chimiques | |
| Formule | RbH |
| Masse molaire[2] | 86,475 7 ± 0,000 4 g/mol H 1,17 %, Rb 98,83 %, |
| Propriétés physiques | |
| T° fusion | décomp. 300 °C[1] |
| Solubilité | réagit avec l'eau[3] |
| Masse volumique | 2,65 g·cm-3[1] |
| Cristallographie | |
| Système cristallin | cubique |
| Classe cristalline ou groupe d’espace | (no 225) [1] |
| Paramètres de maille | a = 604,9 pm |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L'hydrure de rubidium est un composé chimique qui combine stœchiométriquement du rubidium et de l'hydrogène. Il est plus réactif que les hydrures des métaux alcalins plus légers et réagit avec l'eau, l'oxygène et le dioxyde de carbone.
Synthèse[modifier | modifier le code]
L'hydrure de rubidium peut être préparé par la réaction du rubidium et de l'hydrogène[4] :
- 2 Rb + H2 ⟶ 2 RbH
Il est produit également lorsque son carbonate est chauffé avec du magnésium dans un flux d'hydrogène[5] :
- Rb2CO3 + Mg + H2 ⟶ 2 RbH + MgO + CO2↑
Propriétés[modifier | modifier le code]
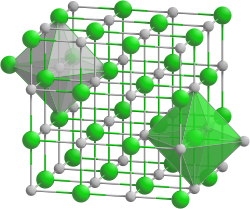
L'hydrure de rubidium cristallise dans le système cristallin cubique dans le groupe d'espace Fm3m (no225) avec le paramètre de réseau a = 604,9 pm et 4 unités RbH dans la maille[1].
Lorsqu'il est chauffé sous vide, l'hydrure de rubidium se décompose en ses éléments[4]. L'hydrure de rubidium réagit avec l'eau pour former de l'hydrogène gazeux[1] :
- RbH + H2O ⟶ RbOH + H2↑
L'hydrogène est également libéré lors de la réaction avec le chlorure d'hydrogène[1] :
- RbH + HCl ⟶ RbCl + H2↑
Le formiate de rubidium est formé avec le dioxyde de carbone[4] :
- RbH + CO2 ⟶ HCOORb
Le dithionite de rubidium se forme lorsqu'il réagit avec du dioxyde de soufre sous pression réduite[4],[6] :
- 2 RbH + 2 SO2 ⟶ Rb2S2O4 + H2↑
Avec le fluor élémentaire, l'hydrure de rubidium brûle en fluorure d'hydrogène et en fluorure de rubidium. Le mélange réactionnel s'enflamme même avec du chlore élémentaire, mais la réaction ne se déroule pas complètement et il reste un sel mélangé vert. Le brome et l'iode réagissent moins violemment[6] :
- RbH + F2 ⟶ RbF + HF↑
Avec l'ammoniac liquide, l'amidure de rubidium se forme avec le dégagement d'hydrogène; à température ambiante, la réaction avec l'ammoniac gazeux est très lente[6] :
- RbH + NH3 ⟶ RbNH2 + H2↑
L'hydrure de rubidium réduit l'oxyde de plomb(II) en plomb élémentaire lorsqu'il est chauffé, l'oxyde de cuivre(II) est réduit en cuivre élémentaire[6] :
- 2 RbH + PbO ⟶ RbOH + Pb + H2O
Notes et références[modifier | modifier le code]
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Rubidiumhydrid » (voir la liste des auteurs).
- Jean D'Ans, Ellen Lax, Taschenbuch für Chemiker und Physiker - 3. Elemente, anorganische Verbindungen und Materialien, Minerale, 4e éd., Springer, 1997, chapitre 3, p.688. (ISBN 978-3-540-60035-0), page sur google book.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 90e éd, CRC Press, 2009. (ISBN 978-1-4200-9084-0).
- (de) R. Abegg, F. Auerbach, Handbuch der anorganischen Chemie, Verlag S. Hirzel, 1908, chapitre 2, p. 425. page online.
- (en) J. W. Mellor, A comprehensive treatise on inorganic and theoretical chemistry, Verlag Wiley, 1962, chapitre 2, p. 2186. page sur google book.
- H. Moissan, Préparation et propriétés des hydrures de rubidium et de césium, Compt. Rend. Hebd., 1903, vol. 136, p. 587. page online.


