Acide phosphoreux

| Acide phosphoreux | |
  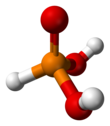 Structure de l'acide phosphoreux. | |
| Identification | |
|---|---|
| Nom UICPA | acide phosphoreux phosphite d'hydrogène |
| No CAS | |
| No ECHA | 100.033.682 |
| No CE | 233-663-1 |
| PubChem | 107909 |
| SMILES | |
| InChI | |
| Apparence | solide incolore |
| Propriétés chimiques | |
| Formule | H3PO3 |
| Masse molaire[1] | 81,995 8 ± 0,001 1 g/mol H 3,69 %, O 58,54 %, P 37,77 %, |
| pKa | pka1=1,26 pka2=6,7 |
| Propriétés physiques | |
| T° fusion | 73 °C [2] |
| T° ébullition | 259 °C [2] |
| Solubilité | miscible avec l'eau |
| Masse volumique | 1,651 g·cm-3 à 25 °C [2] |
| Précautions | |
| SGH[3] | |
| H302 et H314 | |
| NFPA 704 | |
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L’acide phosphoreux, est un composé chimique de formule H3PO3. Il s'agit d'un diacide, et non d'un triacide comme sa formule pourrait le laisser entendre, mieux décrit par la formule (HO)2HP=O.
Description[modifier | modifier le code]
L'acide phosphoreux est un diacide diprotique, l'hydrogène directement lié à l'atome de phosphore central n'étant pas ionisable. Une formule chimique plus logique pour l'acide phosphoreux est HPO(OH)2 (structure tétraédrique), puisqu'il n'y a pas réellement trois groupes hydroxyle -OH dans cet acide, dont le tautomère P(OH)3 semble très minoritaire.
Chimie[modifier | modifier le code]
PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
PCl3 + 3 H2O → HP(O)(OH)2 + 3 HCl
Synthèse[modifier | modifier le code]
L'acide phosphoreux peut être synthétisé par traitement de l'acide carboxylique, l'alcool, ou plus pratiquement l'eau, par le tribromure de phosphore ou plus communément trichlorure de phosphore. La combustion lente du phosphore à l'air humide produit de l'acide phosphoreux contenant un peu d'acide phosphorique : ce mélange a été appelé acide phosphatique avant que l'on ne comprenne sa nature exacte
Utilisation[modifier | modifier le code]
La principale utilisation de cet acide se fait dans l'agriculture sous la forme de fertilisant ou pour la formation de sels 'phosphites' tels que le phosphite d'aluminium ou le phosphite de potassium.
Liens externes[modifier | modifier le code]
Acide phosphoreux - DétailCSST - Service du répertoire toxicologique
Références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Phosphonic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10.01.2023 (JavaScript nécessaire)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)



