Crésol

Le crésol, crésylol, hydroxytoluène ou méthylphénol est un composé aromatique, toxique, de formule C7H8O. Il est constitué d'un cycle benzénique substitué par un groupe hydroxyle (phénol) et un groupe méthyle (toluène). Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle. Le nom « crésol » vient du fait que ces composés sont des alcools, et du fait qu'on les trouve traditionnellement dans le créosote.
Propriétés[modifier | modifier le code]
| Crésol | |||
| Nom | 2-méthylphénol | 3-méthylphénol | 4-méthylphénol |
| Autres noms | o-crésol orthocrésol 2-hydroxytoluène | m-crésol métacrésol 3-hydroxytoluène | p-crésol paracrésol 4-hydroxytoluène |
| Représentation | 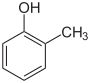 |  | |
| Numéro CAS | |||
| (mélange) | |||
| Numéro CE | 202-423-8 | 203-577-9 | 203-398-6 |
| 215-293-2 (mélange) | |||
| PubChem | 335 | 342 | 2879 |
| Formule brute | C7H8O | ||
| Masse molaire | 108,14 g mol−1 | ||
| État (CNTP) | solide | liquide | solide |
| Apparence | solide cristallin incolore à jaunâtre, odeur piquante rappelant le goudron[1] | fluide huileux incolore à jaunâtre, odeur de phénol[2] | solide cristallin incolore à jaunâtre, odeur piquante rappelant le goudron[3] |
| Point de fusion | 31 °C[1] | 11 °C[2] | 35 °C[3] |
| Point d'ébullition | 191 °C[1] | 203 °C[2] | 202 °C[3] |
| Masse volumique (20 °C) | 1,05 g·cm-3[1] | 1,03 g·cm-3[2] | 1,03 g·cm-3[3] |
| Pression de vapeur saturante | 62 Pa (30 °C) 1,33 hPa (40 °C) 2,66 hPa (50 °C)[1] | 0,119 hPa (20 °C) 0,279 hPa (30 °C) 0,615 hPa (40 °C) 1,28 hPa (50 °C)[2] | 15 Pa (25 °C) 55,9 Pa (40 °C) 1,26 hPa (50 °C)[3] |
| Point d'éclair | 81 °C (coupelle fermée)[1] | 86 °C (coupelle fermée)[2] | 86 °C (coupelle fermée)[3] |
| Point d'auto-inflammation | 555 °C[1] | 626 °C[2] | 555 °C[3] |
| Limites d'explosivité | inférieure : 1,3 vol.% / 58 g/m³, 74 °C[1] | inférieure : 1 vol.% / 45 g/m³, 84 °C[2] | inférieure : 1 vol.% / 45 g/m³, 85 °C[3] |
| Solubilité dans l'eau (20 °C) | 25 g l−1[1] | 23,5 g l−1[2] | 20 g l−1[3] |
| pKA[4] | 10,28 | 10,09 | 10,26 |
| Coefficient de partage octanol/eau (LogP) | 1,98[1] | 1,98[2] | 1,97[3] |
| Conductivité électrique (25 °C) | 1,27 × 10−7 S m−1[1] | 1,397 × 10−6 S m−1[2] | 1,378 × 10−9 S m−1[3] |
| Viscosité dynamique | 7,9 mPa·s[3] | ||
| SGH | [1],[2],[3] | ||
| Phrases H et P | H301, H311, H314 et H412 [1] | H301, H311 et H314 [2] | H301, H311, H314 et H412 [3] |
| P280 et P302+P352 P301+P330+P331, P305+P351+P338 et P308+P310 | P280, P310 et P305+P351+P338 P361, P301+P330+P331 et P303+P361+P353 | ||
Les crésols sont très sensibles à l'exposition à la lumière et à l'air. Au-dessus de 80 °C, ils forment des mélanges explosifs avec l'air. Ils sont peu solubles dans l'eau, et produisent beaucoup de suies par combustion.
pKA[modifier | modifier le code]
Le groupe méthyle possède un (faible) effet inductif donneur (+I), ce qui réduit la polarité de la liaison O-H du groupe phénol, et diminue son caractère acide ; cela explique pourquoi les pKA des crésols sont légèrement au-dessus de 10, contre 9,99 pour le phénol[4], cet effet étant comme à l'accoutumée plus fort pour les composés ortho et para.
Réactivité[modifier | modifier le code]
Au-delà de l'effet inductif donneur (+I) faible du groupe méthyle, le groupe hydroxyle produit un effet mésomère donneur (+M) qui a une bien plus grande influence sur la réactivité des crésols (ainsi qu'un effet inductif attracteur (-I) qui n'en a lui presque aucune). Ces deux effets (+I et +M) accroissent la densité électronique dans le cycle, et font des crésols des composés facilement réactifs par substitution électrophile aromatique.
Les crésols peuvent donner des éthers et des esters (propriétés communes aux autres phénols) ainsi que des produits de substitution halogénés.
Occurrence naturelle[modifier | modifier le code]
Les crésols et leurs dérivés (par exemple les xylénols) sont très présents dans la nature.
Ce sont des métabolites de nombreuses espèces de micro-organismes, et on les retrouve également dans l'urine de certains mammifères, dans les goudrons de houille et le goudron de hêtre, et donc dans le créosote.
Production[modifier | modifier le code]
À l'origine, les crésols non-substitués étaient extraits du charbon et du goudron de hêtre. Aujourd'hui, la moitié de la production mondiale vient de l'extraction du goudron de houille[5], où l'on obtient un liquide jaune-marron, mélange d'isomères, appelé tricrésol. Le reste est produit par synthèse, par méthylation du phénol ou hydrolyse des chlorotoluènes[6], en présence d'hydroxyde de sodium, à hautes température (~250 °C) et pression (~300 bar) dans un réacteur tubulaire.
Ils peuvent également être obtenus par surébullition (de) des sels de diazonium des toluidines correspondantes.
Utilisation[modifier | modifier le code]
Les crésols agissent comme bactéricide, insecticide et fongicide, et sont donc utilisés comme composés actifs de certains désinfectants. L'isomère ortho- est une matière première importante pour la fabrication des herbicides et des désinfectants (Cresyl). Le métacrésol et lui directement utilisé comme fongicide en agriculture. Il est également utilisé comme excipient dans la préparation de certaines insulines lentes, typiquement entre 1,5 et 3 mg par ml d'injection[7],[8].
Les isomères méta- et para- sont utilisés pour la fabrication des résines synthétiques (bakélites), produits de condensation du méthanal avec les phénols, possédant des propriétés remarquables et insolubles dans la plupart des solvants organiques.
Le métacrésol peut réagir avec le propène pour former le thymol.

Dérivés[modifier | modifier le code]
Parmi les multiples dérivés des crésols utilisés en notamment médecine ou en agriculture, on peut citer :
- Dérivés de l'o-crésol :
- Le MCPA, acide 2-méthyl-4-chlorophénoxyacétique (herbicide)
- Le MCPB, acide 4-(4-chloro-2-méthylphenoxy)butanoïque (herbicide)
- Le mécoprop, acide (RS)-méthylchlorophénoxypropionique (herbicide)
- L'atomoxétine, (3R)-N-méthyl-3-(2-méthylphénoxy)-3-phénylpropan-1-amine (médicament utilisé pour traiter le TDAH)
- La méphénésine, 3-(2-méthylphenoxy)propane-1,2-diol (myorelaxant/sédatif/anesthésique/anticonvulsif)
- Dérivés du m-crésol :
- L'amylmétacrésol (antiseptique)
- Le bévantolol, (RS)-[2-(3,4-diméthoxyphényl)éthyl][2-hydroxy-3-(3-méthylphenoxy)propyl]amine (molécule testée comme bêta-bloquant et inhibiteur calcique)
- Le 2-chlorométacrésol (désinfectant ménager)
- La tolimidone, 5-(3-méthylphénoxy)pyrimidin-2(1H)-one (molécule testée dans le traitement de l'ulcère gastro-duodénal)
- Le vert de bromocrésol, 3,3',5,5'-tétrabromo-m-crésolsulfonephtaléine (indicateur de pH)
- Dérivés du p-crésol :
- Le bupranolol, (RS)-1-(tert-butylamino)-3-(2-chloro-5-méthylphénoxy)propan-2-ol (bêta-bloquant non-sélectif)
- L'hydroxytoluène butylé (antioxydant utilisé comme conservateur)
- L'indo-1, acide 2-[4-(bis(carboxyméthyl)amino)-3-[2-[2-(bis(carboxyméthyl)amino)-5-méthylphénoxy]éthoxy]phényl]-1H-indole-6-carboxylique (indicateur de calcium)
Toxicologie[modifier | modifier le code]
Le p-crésol est l'un des produits émis par la bactérie pathogène Clostridium difficile et, selon certains auteurs, il explique l'un de ses effets adverses, dont un lien possible avec l'autisme, dans un contexte de présence conjointe d'aluminium et de glyphosate (notamment selon S. Seneff, N. Swanson et C. Li[9]).
La concentration autorisée par le règlement européen est limitée à 0,2 % dans les produits cosmétiques finis.[réf. nécessaire]
Notes et références[modifier | modifier le code]
- Entrée « o-Cresol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 août 2019 (JavaScript nécessaire).
- Entrée « m-Cresol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 août 2019 (JavaScript nécessaire).
- Entrée « p-Cresol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 août 2019 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- Voir sur medical-dictionary.thefreedictionary.com, 18 juillet 2013.
- Helmut Fiegein, "Cresols and Xylenols" in Ullmann's Encyclopedia of Industrial Chemistry 2007; Wiley-VCH, Weinheim. DOI 10.1002/14356007.a08_025.
- Werner Waldhäusl: Diabetes in der Praxis. Springer-Verlag, 2013, (ISBN 978-3-642-97435-9), p. 406 .
- Peter Hürter: Diabetes bei Kindern und Jugendlichen. Springer-Verlag, 2013, (ISBN 978-3-662-06575-4), p. 134.
- Stephanie Seneff, Nancy Swanson, Chen Li : Aluminum and Glyphosate Can Synergistically Induce Pineal Gland Pathology: Connection to Gut Dysbiosis and Neurological Disease ; vol. 6 n° 1, janvier 2015 ; Open Access, PDF ; p. 42-70.
Voir aussi[modifier | modifier le code]

