Bisulfate d'ammonium

| Bisulfate d'ammonium | |
 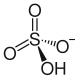 | |
| Structure des ions constitutifs du bisulfate d'ammonium | |
| Identification | |
|---|---|
| Synonymes | hydrogénosulfate d'ammonium |
| No CAS | |
| No ECHA | 100.029.332 |
| No CE | 232-265-5 |
| PubChem | 24655 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche inodore non combustible et très soluble dans l'eau[1] |
| Propriétés chimiques | |
| Formule | NH4HSO4 |
| Masse molaire[2] | 115,109 ± 0,007 g/mol H 4,38 %, N 12,17 %, O 55,6 %, S 27,86 %, |
| Propriétés physiques | |
| T° fusion | 120 °C[1] (décomposition) |
| Solubilité | 1 000 g/L[1] à 20 °C |
| Masse volumique | 1,787 g/cm3[1] |
| Précautions | |
| SGH[1] | |
| H314, P260, P280, P301+P330+P331, P303+P361+P353 et P305+P351+P338 | |
| NFPA 704[3] | |
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Le bisulfate d'ammonium, ou hydrogénosulfate d'ammonium, est un composé chimique de formule NH4HSO4. Il se présente sous la forme d'une poudre blanche hygroscopique cristallisée dans le système monoclinique[4]. Il se décompose au-dessus de 120 °C en libérant des oxydes de soufre, des oxydes d'azote et de l'ammoniac NH3. Une solution de 100 g de bisulfate d'ammonium dans un litre d'eau à 20 °C a un pH égal à 1[5], ce qui en fait un milieu très acide.
On peut obtenir du bisulfate d'ammonium par décomposition de sulfate d'ammonium (NH4)2SO4 au-dessus de 100 °C avec libération d'ammoniac, ou par hydrolyse de l'acide sulfamique HSO3NH2 en solution aqueuse :
Le bisulfate d'ammonium se forme en grande quantité comme sous-produit de la synthèse du méthacrylate de méthyle par la voie de la cyanhydrine d'acétone[6] ainsi que dans les systèmes de filtration à charbon actif (en) pour les gaz d'échappement industriels contenant du dioxyde de soufre SO2 : les filtres sont chargés d'oxygène, d'ammoniac et de vapeur d'eau, ce qui entraîne la formation de sulfate d'ammonium via l'acide sulfurique H2SO4[7] :
On utilise le bisulfate d'ammonium pour produire du persulfate d'ammonium (NH4)2S2O8[8], comme additif dans les engrais azotés[9], contre les incendies de forêt en solution/suspension dans l'eau, et pour produire de l'alun d'ammonium et des retardateurs de flamme pour produits cellulosiques.
Notes et références[modifier | modifier le code]
- Entrée « Ammonium hydrogen sulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Ammonium hydrogen sulfate, 99.9% (metals basis) », sur Alfa Aesar (consulté le ).
- (de) Jean D'Ans et Ellen Lax, Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, 4e éd., Springer, 1997, p. 596. (ISBN 978-3540600350)
- (de) « Ammoniumhydrogensulfat ≥98,5 %, p.a. Sicherheitsdatenblatt », sur carlroth.com, Carl Roth (de), (consulté le ).
- (en) William Bauer Jr., « Methacrylic Acid and Derivatives », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a16_441.pub2, lire en ligne)
- (de) Heinz Brauer, Handbuch des Umweltschutzes und der Umweltschutztechnik. Band 3: additiver Umweltschutz; Behandlung von Abluft und Abgasen, Springer, 1996, p. 577. (ISBN 978-3540580607)
- (de) Arnold Willmes, Taschenbuch chemische Substanzen: Elemente - Anorganika - Organika - Naturstoffe - Polymere, 3e éd., Harri Deutsch, 2007, p. 115. (ISBN 978-3817117871)
- (en) Wolfgang Ermischer, Heinz Spindler, Wilfried Fuchs, Manfred Gebauer et Steffen Kitzing, brevet DE4126801A1 : « Storable, granulated ammonium sulphate fertiliser prepn. - by adding of a urea deriv. to crystalline ammonium sulphate », déposé le 9 août 1991, publié le 11 février 1993.


