Électrocatalyseur


Un électro-catalyseur est un catalyseur de réactions électrochimiques. Un électro-catalyseur facilite le transfert d'électrons entre la surface de l'électrode et les réactifs. Dans certains cas, il facilite une transformation chimique intermédiaire qui est décrite par une demi-réaction globale.
Cette substance peut-être hétérogène (une surface de platine ou des nanoparticules, par exemple)[1],[2], ou homogène (exemple : un complexe de coordination ou une enzyme).
Principe[modifier | modifier le code]
De manière générale, un catalyseur est un agent permettant d'accélérer une réaction chimique sans en changer l'équation bilan[3], le catalyseur étant régénéré au cours de la réaction.
Comme le catalyseur, un électro-catalyseur abaisse l'énergie d'activation d'une réaction sans altérer l'équilibre de la réaction. Les électro-catalyseurs vont plus loin que les autres catalyseurs en abaissant l'énergie excédentaire consommée par les barrières d'activation d'une réaction d'oxydoréduction, car, en électrochimie, l'énergie d'activation d'une réaction est proportionnelle au potentiel nécessaire pour effectuer la réaction.
De plus, certaines espèces chimiques interagissent difficilement avec les électrodes ; l'électro-catalyseur peut donc parfois servir de vecteur pour permettre l'échange d'électrons à la surface de l'électrode[4].
Exemple de la pile à combustible[modifier | modifier le code]
La transformation et la combinaison de l'hydrogène et de l'oxygène pour former de l'eau grâce à un mécanisme de radicaux libres, s'appelle la combustion. L'énergie utile peut être obtenue à partir de la chaleur thermique de cette réaction, grâce à un moteur à combustion interne, avec un rendement supérieur de 60% (pour un taux de compression de 10 et un rapport de chaleur spécifique de 1,4) basé sur le cycle thermodynamique d'Otto. Il est également possible de combiner l'hydrogène et l'oxygène grâce au mécanisme redox comme dans le cas d'une pile à combustible. Dans ce processus, la réaction est divisée en deux demi-réactions qui se produisent à des électrodes distinctes. Dans cette situation, l'énergie du réactif est directement convertie en électricité[5],[6].
| Demi-réaction | E° (V) |
|---|---|
| H2(g) 2H+ + 2e− | ≡ 0 |
| O2(g) + 4H+ + 4e− 2H2O | +1,23 |
Ce processus n'est pas régi par les mêmes cycles thermodynamiques que les moteurs à combustion ; il est régi par l'énergie totale disponible pour faire le travail tel qu'il a été décrit par l'énergie libre de Gibbs. Dans le cas de cette réaction, cette limite est efficace à 83 % à 298 K. Cette paire de demi-réactions et beaucoup d'autres n'atteignent pas leur limite théorique en application pratique, en raison du manque d'un électro-catalyseur efficace.
L'un des plus grands inconvénients des cellules galvaniques, comme les piles à combustible et diverses formes de cellules électrolytiques, est qu'elles peuvent souffrir de barrières d'activation élevées. L'énergie détournée pour surmonter ces barrières d'activation est transformée en chaleur. Dans la plupart des réactions de combustion exothermique, cette chaleur ne ferait que propager la réaction de manière catalytique. Dans une réaction redox, cette chaleur est un sous-produit inutile perdu dans le système. L'énergie supplémentaire requise pour surmonter les barrières cinétiques est généralement décrite en termes de faible efficacité faradique et de surtensions élevées. Dans l'exemple ci-dessus, chacune des deux électrodes et sa demi-cellule associée nécessiterait son propre électro-catalyseur spécialisé.
Les demi-réactions impliquant plusieurs étapes, plusieurs transferts d'électrons et l'évolution ou la consommation de gaz dans leurs transformations chimiques globales, auront souvent des barrières cinétiques considérables. De plus, il y a fréquemment plus d'une réaction possible à la surface d'une électrode. Par exemple, pendant l'électrolyse de l'eau, l'anode peut oxyder l'eau par un processus à deux électrons en peroxyde d'hydrogène ou un processus à quatre électrons en oxygène. La présence d'un électro-catalyseur pourrait faciliter l'une ou l'autre des voies de réaction[7].
Électro-catalyse hétérogène[modifier | modifier le code]
Comme les réactions électrochimiques nécessitent un transfert d'électrons entre le catalyseur solide (généralement un métal) et l'électrolyte, qui peut être une solution liquide, mais également un polymère ou une céramique capable de conduction ionique, la cinétique de réaction dépend à la fois du catalyseur et de l'électrolyte comme ainsi que sur l'interface entre eux. La nature de la surface de l'électro-catalyseur détermine certaines propriétés de la réaction telles que sa vitesse et la sélectivité des produits.
L'activité d'un électro-catalyseur peut être réglée avec une modification chimique, habituellement obtenue en alliant deux métaux ou plus. Cela est dû à un changement dans la structure électronique, en particulier dans la bande d[Quoi ?] considérée comme responsable des propriétés catalytiques des métaux nobles[8].

De plus, des taux de réaction plus élevés peuvent être atteints en contrôlant avec précision la disposition des atomes de surface : en effet, dans les systèmes nanométriques, le nombre de sites de réaction disponibles est un meilleur paramètre que la surface exposée afin d'estimer l'activité électro-catalytique. Les sites sont les positions où la réaction pourrait avoir lieu ; la probabilité qu'une réaction se produise dans un certain site dépend de la structure électronique du catalyseur, qui détermine l'énergie d'adsorption des réactifs, ainsi que de nombreuses autres variables pas encore complètement clarifiées.
Selon le modèle TSK[pourquoi ?], les atomes de surface du catalyseur peuvent être classés en tant qu'atomes de terrasse, d'étape ou de pli selon leur position, chacun caractérisé par un numéro de coordination différent. En principe, les atomes avec un nombre de coordinations inférieur (plis et défauts) ont tendance à être plus réactifs, et donc à adsorber plus facilement les réactifs : cela peut favoriser la cinétique, mais pourrait également la déprimer si l'espèce absorbante n'est pas le réactif, inactivant ainsi le catalyseur.
Les progrès de la nanotechnologie permettent de concevoir en surface le catalyseur afin que seuls certains plans cristallins souhaités soient exposés aux réactifs, maximisant le nombre de sites de réaction efficaces pour la réaction souhaitée.
À ce jour, un mécanisme de dépendance de surface généralisé ne peut pas être formulé, car chaque effet de surface est fortement spécifique à la réaction. Quelques classifications des réactions basées sur leur dépendance de surface ont été proposées[9] mais il y a encore trop d'exceptions qui ne tombent pas dedans.
Effet de la taille des particules[modifier | modifier le code]
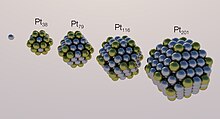
Les coûts importants des catalyseurs incitent à l'utilisation de poudres fines. En effet, la surface spécifique d'une poudre est inversement proportionnelle à la taille des particules qui la composent. La catalyse la plus utilisée pour les piles à combustible et les électrolyseurs PEM[10] est, par exemple, des nanoparticules de platine (noir de platine) associées à une membrane polymère.
Bien que le rapport surface/volume soit généralement considéré comme le paramètre principal reliant la taille de l'électro-catalyseur à son activité, plusieurs autres phénomènes doivent être pris en compte pour comprendre l'effet de la taille des particules[9] :
- forme d'équilibre : pour toute taille donnée d'une nanoparticule, il existe une forme d'équilibre qui détermine exactement ses plans cristallins ;
- nombre relatif de site de réaction : une taille donnée pour une nanoparticule correspond à un certain nombre d'atomes de surface et seuls certains d'entre eux hébergent un site de réaction ;
- structure électronique : en dessous d'une certaine taille, la fonction de travail d'une nanoparticule change et sa structure de bande s'estompe ;
- défauts : le réseau cristallin d'une petite nanoparticule est parfait ; ainsi, les réactions améliorées par des défauts lorsque les sites de réaction ralentissent à mesure que la taille des particules diminue ;
- stabilité : les petites nanoparticules ont tendance à perdre de la masse en raison de la diffusion de leurs atomes vers des particules plus grosses, selon le phénomène de maturation d'Ostwald ;
- agents de coiffage : pour stabiliser les nanoparticules, il faut une couche de coiffage, donc une partie de leur surface n'est pas disponible pour les réactifs ;
- support : les nanoparticules sont souvent fixées sur un support afin de rester en place, donc une partie de leur surface n'est pas disponible pour les réactifs.
Piles à combustible à l'éthanol[modifier | modifier le code]
Un électro-catalyseur de platine et de rhodium sur des nanoparticules de dioxyde d'étain soutenues par du carbone peut rompre les liaisons de carbone à température ambiante avec uniquement du dioxyde de carbone comme sous-produit, de sorte que l'éthanol peut-être oxydé en ions hydrogène et en électrons nécessaires à la production d'électricité[11].
Références[modifier | modifier le code]
- G. Valenti, A. Boni, M. Melchionna et M. Cargnello, « Co-axial heterostructures integrating palladium/titanium dioxide with carbon nanotubes for efficient electrocatalytic hydrogen evolution », Nature Communications, vol. 7, , p. 13549 (PMID 27941752, PMCID 5159813, DOI 10.1038/ncomms13549, Bibcode 2016NatCo...713549V).
- Xin Wang, « CNTs tuned to provide electrocatalyst support » [archive du ], Nanotechweb.org, (consulté le ).
- Éditions Larousse, « Définitions : catalyseur - Dictionnaire de français Larousse », sur www.larousse.fr (consulté le )
- (en) Jean-Michel Savéant, « Molecular Catalysis of Electrochemical Reactions. Mechanistic Aspects », Chemical Reviews, vol. 108, no 7, , p. 2348–2378 (ISSN 0009-2665 et 1520-6890, DOI 10.1021/cr068079z, lire en ligne, consulté le ).
- Julia Kunze et Ulrich Stimming, « Electrochemical Versus Heat-Engine Energy Technology: A Tribute to Wilhelm Ostwald's Visionary Statements », Angewandte Chemie International Edition, vol. 48, no 49, , p. 9230–9237 (PMID 19894237, DOI 10.1002/anie.200903603).
- Richard Haverkamp, « What is an electrocatalyst? » [QuickTime video and transcript], Science learning New Zealand, (consulté le ).
- Allen J. Bard et Larry R. Faulkner, Electrochemical methods : fundamentals and applications, New York, Wiley, , 864 p. (ISBN 978-0-471-04372-0, lire en ligne).
- H. Mistry, A.S. Varela, P. Strasser et B.R. Cuenya, « Nanostructured electrocatalysts with tunable activity and selectivity », Nature Reviews Materials, vol. 1, no 4, , p. 1–14 (DOI 10.1038/natrevmats.2016.9).
- M.T.M. Koper, « Structure sensitivity and nanoscale effects in electrocatalysis », Nanoscale, The Royal Society of Chemistry, vol. 3, no 5, , p. 2054–2073 (PMID 21399781, DOI 10.1039/c0nr00857e).
- M. Carmo, D.L. Fritz, J. Mergel et D. Stolten, « A comprehensive review on PEM water electrolysis », International Journal of Hydrogen Energy, vol. 38, no 12, , p. 4901–4934 (DOI 10.1016/j.ijhydene.2013.01.151).
- Mark Harris, « Booze-powered cars coming soon » [archive du ], techradar.com, (consulté le ).

