Dermatán sulfato

| Dermatán sulfato | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
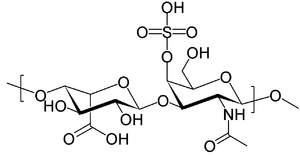
| (2R,3S,4S,5R,6R)-6-[(2R,3R,4R,5R,6R)-3- acetamido -2- hydroxy-6 -(hydroxymethyl)-5- sulfonatooxyoxan-4-yl ]oxy-3,4,5 -trihydroxyoxane-2 -carboxylate | ||
| General | ||
| Otros nombres | beta-Heparina Sulfato de condroitina B Sulfato de condroitina de tipo B Ácido condroitinsulfúrico Ácido condroitinsulfúrico B Ácido condroitinsulfúrico de tipo B Dermatán 4-sulfato Dermatán hidrógeno sulfato Dermatán sulfato de bajo peso molecular Desmin 370 DS 435 EINECS 246-552-8 MF 701 MF 701 (polisacárido) | |
| Fórmula semidesarrollada | C14H21NO15S | |
| Fórmula estructural | C=14 | |
| Fórmula molecular | ?H21NO15S2 | |
| Identificadores | ||
| Código ATC | B01AX04 | |
| Número CAS | 24967-94-0[1] | |
| ChEBI | 18376 | |
| ChemSpider | 30361 | |
| DrugBank | 15880 | |
| UNII | J3OC7JVS54 73S257UH1S, J3OC7JVS54 | |
| KEGG | C00426 | |
| Familia | glicosaminoglicano | |
El dermatán sulfato, (en inglés: Dermatan sulfate), pertenece a una familia de compuestos llamados glicosaminoglicanos (GAG), antes llamados mucopolisacáridos, que se encuentra principalmente en la piel pero también en los vasos sanguíneos, válvulas del corazón, tendones y pulmones.
También se le puede llamar sulfato de condroitina B,[2] y heparina-13,[3] pero la mayoría de las fuentes ya no lo clasifican como una forma de estos dos glicosaminoglicanos. Fue aislado de la piel de cerdo por primera vez por Meyer y Chaffee en 1941.
La fórmula es C14H21NO15S.
Localización[editar]
Es un glicosaminoglicano natural que se encuentra principalmente en la piel, pero también está localizado en los vasos sanguíneos, válvulas cardíacas, tendones, pulmones y en la mucosa intestinal.
Está ampliamente distribuido por el tejido conectivo de los animales vertebrados como componente principal de la matriz extracelular, de la membrana plasmática o bien formando parte de los gránulos intracelulares de ciertas células. En localizaciones de matriz tales como la piel y el cartílago, adquiere una función principalmente estructural, mientras que en las membranas parece funcionar principalmente como receptor.[4]
Estructura[editar]

El Dermatán sulfato es un polisacárido largo sin ramificaciones y contiene repeticiones de una unidad de disacáridos. Las unidades de disacáridos contienen azúcares modificados, N-acetilgalactosaminas (GaINAc) y un ácido urónico, el iduronato.[5]
In vivo se asocia con proteínas estructurales, además de ser un catión asociado con sodio, potasio, magnesio o, más a menudo, con aniones de calcio.[4]
Son moléculas negativamente cargadas con una conformación extendida que brinda alta viscosidad a una solución.
Cuando fue aislado por primera vez en 1941, su componente hexosamina fue identificado pronto como galactosamina, mientras que estudios más recientes han demostrado que el componente de ácido urónico mayor es el de ácido L-idurónico[6][7] Sin embargo, casi siempre pequeñas cantidades de ácido D-glucurónico están presentes en las preparaciones de dermatán sulfato[8]
No ha quedado claro si la presencia del ácido D-glucurónico representa una contaminación con otro polímero o si es una parte integral del dermatán sulfato. Esta última posibilidad sido sugerida por hallazgos de los científicos Hoffman, Linker, y Meyer.[9]
Una sugerencia más directa de que el sulfato de dermatán es un híbrido se obtuvo en estudios de Rod & y Dorfman.[10]
Biosíntesis[editar]
La cadena de GAG se sintetiza a partir de la adición sucesiva de residuos de glúcidos individuales a la proteïna del núcleo. La enzima UDP en la forma activada es la portadora de glúcidos, mientras que glicosiltransferasas específicas catalizan estas reacciones de transferencia de glúcidos. Los materiales de partida son la UDP-Glucosa (UDPG) y la UDP-N-acetilglucosamina (UDP-NAG). Los otros monosacáridos se forman mediante la modificación de la glucosa y la N-acetilglucosamina vinculadas a UDP.
Por ejemplo, UDPG puede ser oxidada a UDP-glucuronato (UDP-GIcUA), que además se puede descarboxilar a UDP-xilosa. Tanto UDPG y UDP-NAG pueden sufrir epimerización en el carbono 4 para formar UDP-galactosa (UDP-Gal) y galactosamina UDP-N-acetil- (UDP-nagal).[4]
Síntesis de la proteína nuclear[editar]
Como pasa en muchas glicoproteínas de membrana y secretoras, la biosíntesis de la proteína nuclear se inicia con el proceso de traducción en el citosol y la posterior translocación del polipéptido naciente en el lumen del Retículo endoplasmático a través del translocon, vía una secuencia señal que media el proceso.
Después de la translocación de la proteína nuclear al lumen del Retículo endoplasmático, se añaden cotraduccionalmente oligosacáridos ligados a N a residuos de Asn que provienen de intermediarios de fosfato de dolicol.
Antes de que la proteína salga del Retículo endoplasmático, ésta se modifica: se produce su plegamiento mediado por chaperonas, se forman los enlaces disulfuro y el recorte inicial de oligosacáridos ligados a N.
Las proteínas que no están correctamente plegadas se degradan y nunca salen del RE, pero aún no está claro qué conformaciones son requeridas o qué plegamientos mínimos son necesarios para evitar su movimiento del RE a Golgi para iniciar la síntesis de los glicosaminoglicanos.
En la actualidad no está claro qué provoca que una proteína se convierta en un proteoglicano.
Formación de los precursores[editar]

La glucosa es el principal precursor de los azúcares, aunque la galactosa, derivada principalmente de la lactosa, puede ser un precursor para la galactosa, ácido glucurónico, y residuos de xilosa a través de la formación de UDP-Gal, UDP-GlcA y UDP-Xyl.
La glucosamina puede servir como sustrato para los residuos de N-acetilgalactosamina mediante la formación de UDP-GalNAc, si se proporciona la glucosamina como monosacárido a células cultivadas o a un animal intacto.
La sulfatación se proporciona desde 30-phosphoadenosine 50 phosphosulfate (SAFP). Su formación es catalizada por la ATP sulfurilasa y APS quinasa, actividades que residen en una única proteína bifuncional en los mamíferos.
En general, el sulfato se obtiene principalmente por ingestión directa de sulfato libre o por el metabolismo de compuestos sulfatados, pero algunos pueden ser proporcionados por la oxidación de los grupos sulfhidrilo de cisteína o metionina, principalmente en el hígado.
Las células capaces de sintetizar glicosaminoglicanos contienen todas las enzimas necesarias para la formación de los precursores, debido a que los nucleótidos de azúcar y PAPS normalmente no entran en las células.
Las reacciones para la activación de azúcares y sulfato son catalizadas por enzimas solubles en el citosol, con la excepción de la formación de UDP-Xyl de UDP-GlcA, que se produce dentro del lumen del RE o Golgi. Posteriormente, los nucleótidos de azúcar y PAPS son transportados desde el citosol a través de la membrana hacia el lumen del RE o Golgi por medio de un mecanismo de antiport.
Un suministro adecuado de los azúcares de nucleótidos y PAPS dentro del RE y Golgi es crítico para la biosíntesis de proteoglicanos, cualquier fallo en las cantidades suficientes de estas moléculas afectaría la regulación de la iniciación de la cadena de glicosaminoglicano, la longitud de la cadena final, y el tipo y el alcance de la sulfatación.[11]
Síntesis de la cadena[editar]
- Transferencia de xilosa

- Dos transferencias de galactosa

- Transferencia de ácido glucorónico

- Transferencia galactosamina

Modificación del polímero[editar]
- Fosforilación
La fosforilación de xilosa ha sido reportada tanto para agrecano y decorina, así como para el sulfato de heparán, como un acontecimiento postraduccional temprano. En la matriz extracelular del cartílago, la modificación del agrecano es estable, pero en cambio, la fosforilación de xilosa en la región de vinculación de decorina es transitoria, con la eliminación del grupo fosfato tras la adición del primer residuo GlcA.
Se ha sugerido que la xilosa fosforilada puede servir como señal durante el tráfico intracelular o en la regulación de la modificación del glicosaminoglicano subsiguiente.[11]
- Sulfatación
El donante activo del grupo sulfato es el 3'-fosfoadenosina-5'-fosfosulfato (PAPS). Los grupos sulfato se transfieren en las posiciones 4 o 6 de la galactosamina y en la posición 2 de L-iduronato.[12]
- Epimerización
La epimerización del o-glucuronato a L-iduronato ha sido descrita por Malmström (1975).[13] Malmstrom explica que la epimerización del carbono 5 cambia el azúcar de la o- a la serie L. Para llevar a cabo este proceso, se requiere O-sulfatación para la epimerización en el carbono 5. No se sabe si la sulfatación se produce antes o después de la epimerización, pero esta impulsa la reacción hacia la formación de iduronato. Que se produzca la sulfatación antes de la epimerización explica la especificidad de la epimerasa. En cambio, en caso de que la sulfatación se produjera después de la epimerización, esto puede cambiar el equilibrio de la reacción de modo desfavorable a la formación de L-iduronato ya que retira el producto inicial.[4]
La ubicación subcelular precisa donde se produce la epimerización no se conoce, pero estudios con monensina, que bloquea la vía secretora en la región medial de Golgi, han indicado que la 6-sulfatación de decorina dermatán se ve menos afectada que el grado de epimerización y de 4-sulfatación.
Esto confirma que el 4-sulfotransferasa y epimerasa están muy próximos el uno al otro y sugiere que la 6-sulfatación de decorina se produce en un compartimiento anterior de Golgi.[11]

Funciones[editar]
Todos los Glicosaminoglicanos (GAGs), excepto la Heparina (Hep) se encuentran intracelularmente en mastocitos del tejido conectivo y otras células hematopoyéticas que participan en la respuesta inmune e inflamatoria. Principalmente participan en procesos de difusión de moléculas hidrosolubles, migración, proliferación y adhesión celular. En sangre solo se encuentran pequeñas cantidades de GAGs, en plasma y en células sanguíneas como plaquetas y leucocitos. Aun así, son conocidos por sus propiedades anticoagulante.
Algunas de las actividades biológicas más revelantes de los GAGs dependen de una secuencia específica de disacáridos y un patrón determinado de grupos carboxilo y sulfato.[14] Los mecanismos de acción más estudiados de los GAGS son la interacción de Hep y Dermatán sulfato (DS) con Antitrombina (AT) y Cofactor II de la Heparina (CH II).
El Dermatán sulfato en la coagulación[editar]

Normalmente el DS no se encuentra en circulación sanguínea, siendo casi nulos los niveles plasmático en individuos sanos. Sin embargo, se han observados niveles de entre 0.2 y 4μg/mL[15] de DS entre mujeres embarazadas (debido a la producción placentaria) y en pacientes en hemodiálisis crónica, pacientes quemados y pacientes sépticos (debido al daño endotelial producido).
El DS presenta una acción anticoagulante, siendo más efectivo el DS de alto peso molecular (DSA) que el DS de bajo peso molecular (DSB).
Acción sobre la trombina[editar]
EL DS actúa como activador de la CH II (un cofactor que actúa como inhibidor de trombina y meizotrombina). La molécula de CH II presenta en su estructura un dominio N-terminal de reconocimiento de trombina, unido intra-molecularmente a un dominio electropositivo denominado sitio de unión a GAGs. En presencia de DS se produce un desplazamiento del extremo N-terminal del CH II, quedando libre para interactuar con el exositio I de la trombina, lo que acerca ambos centros reactivos y facilita la reacción de inhibción.
La inhibición de trombina por acción del CH II aumenta aproximadamente 1000 veces en presencia de Hep, DS y Heparán Sulfato. Aunque, mientras la Hep necesaria para potenciar CH II es 20 veces mayor que para potencia AT, el DS es un potente activados de CH II a diferencia de AT, sobre la cual tiene un efecto mínimo.[16] Se ha descrito una secuencia hexasacárida específica de DS (tres repeticiones de IdoA 2S (α 1→3) GalNAc-4S (β 1→4) que presenta alta afinidad por el CH II.
Fisiológicamente, el CH II es un inhibidor extravascular de la trombina activado por proteoglicanos (PG) derivados del DS sintetizados den fibroblastos y células de músculo liso de la matriz subendotelial. Además actúa como regulador de la trombina durante el embarazo, en la regulación de procesos inflamatorios, regeneración de tejidos y reparació tisular.
Acción sobre la plasmina[editar]
EL proceso fibrinolítico involucra principalmente la activación de plasminógeno a plasmina gracias a la acción de los activadores de plasminógeno de tipo tisular (t-PA) y urinario (u-PA). Y la acción de la plasmina para producir la lisis de la fibrina que ayuda a la formación del coágulo.
En los estudios del efecteo del DS sobre el sistema fibrinolítico,[17] se pudo observar una aumento de la acción de t-PA y u-PA en función del aumento de concentración de DS. Por otro lado, también se estudió la aparición más temprana de plasmina, acompañada de una disminución de plasminógeno en presencia de DS. Por tanto, concluyeron que el DS provoca un cambio conformacional en los activadores de plasminógeno que les facilita el acceso al centro de activación del plasminógeno.
Efecto sobre las redes de fibrina[editar]
Teniendo en cuenta que el DS aumenta la inhibición de la trombina, podemos entender que en presencia de DS haya una disminución de la velocidad de fibrinoformación, prolongando de este modo el tiempo de formación del coágulo. Además, se ha observado que las redes de fibrina en presencia de DS presentan unas fibras más finas y delgadas.[18] Esto comporta una formación de redes de fibrina menos compactas. Sabiendo que la plasmina corta transversalmente las fibras de fibrina, unas fibras más delgadas se lisan más fácilmente que las gruesas. Por otro lado las redes menos densas tienen una mayor accesibilidad por parte de la plasmina, permitiendo una lisis más rápida de la red de fibrina y por tanto del coágulo.
El Dermatán sulfato en la matriz extracelular[editar]
El dermatán sulfato también lo encontramos unido al proteoglicano Decorina, una proteína con repetición rica en leucina. Esta es secretada a la matriz extracelular por las células del tejido conjuntivo y su función es unirse al colágeno y a la Tenacina X (una proteína de la matriz extracelular). Una cadena simple de dermatán sulfato de la decorina es la que se une a esta proteína (Tenacina X), estableciendo este puente con el colágeno para dar la resistencia al tejido. Se ha observado que en los paciente sin estos componentes ha aumentado la fragilidad de la piel.
De la misma manera, la decorina se une a la fibronectina, a la trombospondina, a la proteína del complemento Clq, a las lipoproteína de baja densidad, a TGF-β y al receptor de factores de crecimiento. En este último caso, se ha observado que el DS solo tiene relación con los factores de crecimiento FGF-2 (Factor de crecimiento de fibroblastos) y HGF/SF (Hepatocyte growth factor/scatter factor).
Se ha observado que una marca de los tumores es una matriz extracelular con cambios en la composición de GAGs (como de DS). Esto es debido a la relación que tiene el dermatán sulfato con los factores de crecimiento, ya que forma parte de la decorina.
Relación con las infecciones[editar]
El DS y las DSPGs (Glipoproteínas de DS) se han asociado con una modificación de la resistencia frente a agentes infecciosos. La decorina se ha identificado como un objetivo para Borrelia burgdorferi, el agente de la enfermedad de Lyme. Este organismo expresa proteínas de unión a la decorina, deforma que el agente patógeno se une a la célula. Se cree que el DS podría estar involucrado el la unión de otros microbios como: el virus del Dengue, el virus del herpes 1 y otros seis virus del herpes, el plasmodium de la malaria y la neisseria de la gonorrea.
El DS también está involucrado en infecciones través de mecanismos independientes de adherencia microbiana. La patogénesis de Pseudomonas aeruginosa, Enterococcus faecalis, y Streptococcus pyogenes implica la liberación de proteinasas que liberan el DS que está unido a las glicoproteínas. Este DS libre se une e inactiva los péptidos antimicrobianos catiónicos α-defensinas de neutrófilos. Las defensinas, así como catelicidinas, son pequeños péptidos catiónicos esenciales para la resistencia a la infección. Por tanto, la inactivación de estos péptidos a través de DS es una estrategia eficaz para aumentar la patogénesis.
Dermatán sulfato y los factores de crecimiento[editar]
En laboratorios, se ha observado que el Dermatán sulfato es capaz de interactuar con la FGF-2, una proteína que forma parte de los factores de crecimiento, de manera que activa y estimula la proliferación celular. Este crecimiento celular solo se ha experimentado "in vitro" pero supera a la proliferación causada por la interacción de este mismo factor (FGF-2) con el Heparán sulfato. El Dermatán sulfato también activa otras proteínas de factores de crecimiento como las HGF/SF, relacionadas con el crecimiento de hepatócitos...
Dermatán sulfato en la reparación de heridas[editar]
Aunque aún está en proceso de investigación, se cree que el dermatán sulfato juega un papel importante en la reparación de heridas cutáneas. Debido a su localización en la piel, recordamos que es un constituyente importante de la Dermis, y sabiendo que otras de sus funciones principales son las de anticoagulante, crecimiento celular y defensor del sistema immunitario, es lógico pensar que el DS estará interviniendo en la curación de heridas en la piel.
Patologías relacionadas[editar]
Las enfermedades principalmente relacionadas con el dermatán sulfato están clasificadas dentro del grupo de las mucopolisacaridosis y tienen base genética. Estas enfermedades se deben a una deficiencia enzimática en las hidrolasas ácidas del lisosoma que se encargan de la degradación del dermatán sulfato y del heparán sulfato. Dependiendo de la hidrolasa ácida ausente se producen diferentes patologías o síndromes. En ausencia de la encima que degrada el dermatán sulfato, este se acumula en los lisosomas de la célula provocando una sobreocupación tanto lisosómica como a nivel de la célula por aumulación de lisosomas, de manera que se ve afectado todo el funcionamiento celular ya que apenas queda espacio para otros compartimentos. La peligrosidad de este defecto genético aumenta en función de si la encima ausente o mutada se encuentra o no en todos los lisosomas de la célula y en muchas células del cuerpo, que normalmente es el caso que se da.
Asociados al dermatán sulfato, encontramos principalmente el síndrome de Hurler y la enfermedad de Hunter. El síndrome de Hurler se transmite genéticamente de forma autosómica y recesiva, mientras que la enfermedad de Hunter está ligada al cromosoma X. Ambas de caracterizan por anormalidades esqueléticas, retraso mental y muerte temprana
| Síndrome | Defecto enzimático | Síntomas |
|---|---|---|
| Hurler MPSIH (MPS1H) | α-L-iduronidasa | Anublamiento de la córnea, distosis múltiple, organomegalia, enfermedades cardiacas, enanismo, retraso mental, mortalidad temprana. |
| Scheie MPSIS (MPS1S) | α-L-iduronidasa | Nublamiento de la córnea; enfermedad de la válvula aórtica, endurecimiento de las articulaciones; inteligencia y esperanza de vida normales. |
| Hurler-Scheie MPSIHS (MPS1HS) | α-L-iduronidasa | Intermedios entre el síndrome de Hurler y de Scheie. |
| Hunter MPSII (MPS2) | L-iduronato-2-sulfatasa | Formas moderadas y severas, solo herencia ligada a X MPS, distosis múltiple, organomegalia, deformaciones faciales y físicas, no anublamiento de la córnea, retraso mental, muerte antes de los 15 años, excepto en la forma moderada en la cual sobreviven hasta 20–60 años. |
| Maroteaux-Lamy MPSVI (MPS6) | arilsulfatasa B también llamada N-acetilgalactosamina-4-sulfatasa | 3 formas distintas que van desde moderadas a severas, enfermedad de la válvula aórtica, distosis múltiple, inteligencia normal, anublamiento de la córnea, rasgos faciales ásperos. |
| Sly MPSVII (MPS7) | Β-glucuronidasa | Hepatosplenomegalia, distosis múltiple, amplio espectro de severidad, hidropsia fetal. |
Aplicaciones potenciales terapéuticas[editar]
El dermatán sulfato tiene un papel importante en la diferenciación, morfogénesis y migración celular. Es por este motivo que se cree que podría tener importantes aplicaciones clínicas.
Se han descrito varias actividades biológicas del dermatán sulfato sobre las cuales se espera que se puedan desarrollar terapias y medicamentos. Alguna de las cadenas del dermatán sulfato interacciona con factores de crecimiento que pueden producir entonces dos tipos de respuesta: o bien inhibición, o una potenciación de los efectos de estos factores de crecimiento. Mínimas cantidades de dermatán sulfato pueden ser utilizadas como moléculas altamente activas.
Fármaco contra infecciones[editar]
El dermatán sulfato y sus derivados podrían aplicarse como medicamentos inhibidores para aumentar la resistencia a enfermedades infecciosas, ya que muchas bacterias, virus y parásitos aprovechan los GAGs de la membrana plasmática como receptores para adherirse. Se conoce que Borrelia burgdorferi, Plasmodium y HSV-1, utilizan las cadenas de Condroitín sulfato y dermatán sulfato de la membrana celular como receptores.
Normalmente, las interacciones entre microorganismos y los GAGs son inespecíficas exceptuando las iónicas, sin embarco, en muchos casos se ha visto que secuencias únicas de glúcidos en las cadenas GAG están involucradas en la adhesión de microorganismos. Es por este motivo que es importante identificar las secuencias de oligosacáridos que interactúan específicamente con las proteínas de adherencia de los microorganismos. Saber cómo es la estructura de esta interacción es importante para conocer mejor los mecanismos de infección microbiana y para el diseño de oligosacáridos GAG ara aplicarlos como terapia para enfermedades infecciosas.
Medicamento regenerativo[editar]
El dermatán sulfato juega un papel importante en la morfogénesis y el mantenimiento de varios tejidos a través de interacciones con moléculas de adhesión de la célula, moléculas ECM y factores de crecimiento. Podría usarse para la regeneración del Sistema Nervioso Central y en la regeneración del hígado.
Reparación del Sistema Nervioso Central (SNC)[editar]
El SNC es una fuente rica y compleja de proteoglicanos entre los cuales se encuentra el dermatán sulfato. En la edad adulta, el SNC tiene una capacidad regenerativa limitada, sin embargo, durante el desarrollo del cerebro, los niveles de esta molécula son altos y tienen una función importante en todos los estadios del desarrollo. Está relacionado con la regulación de expresión de patrones de crecimiento, por lo tanto, la aplicación de fármacos de dermatán sulfato favorecería la regeneración. El dermatán sulfato puede también funcionar en el SNC bajo condiciones patológicas. En el caso del alzheimer, el dermatán sulfato se localiza en lesiones características de la enfermedad y se cree que son potenciadores de la fibrilogénesis amiloide.
En varias condiciones patológicas, hay elevados niveles de dermatán sulfato en el SNC y en la periferia, donde esta molécula está asociada en procesos de reparación de lesiones. Después de producirse una lesión en el SNC, el tejido glial dañado, sintetiza y expresa múltiples moléculas axonales inhibidoras del crecimiento, que producen una barrera física y molecular para la regeneración axonal. En la herida de la glía están presentes proteoglicanos con fracciones de dermatán sulfato, y este es generalmente un inhibidor de la reparación. El dermatán sulfato forma una red homogénea alrededor de heridas para prevenir la difusión de mediadores del daño hacia el tejido sano. Cuando se eliminan o se reducen las cadenas de dermatán sulfato en las zonas de lesión producidas por digestión enzimática, se promueve la regeneración de neuritas de la médula espinal. El dermatán sulfato y el condroitín sulfato promueven el nacimiento de neuritas en las neuronas embrionarias. Un dermatán sulfato sobresulfatado promueve el crecimiento de neuritas en las neuronas del hipocampo. Proteoglicanos con estas moléculas pueden promover o inhibir el nacimiento de neuritas dependiendo del tipo de neuronas, de las condiciones experimentales y de la estructura de las cadenas de condroitín sulfato y dermatán sulfato.
Se ha visto que los patrones de sulfatación de las cadenas de dermatán sulfato y condroitín sulfato sobresulfatados influencian directamente en la unión a proteínas bioactivas y regulan las funciones de proteoglicanos con esta molécula en la reparación del SNC, por eso, la actividad neurogénica depende de estos patrones y no de la densidad de las cadenas de estos GAGs.[19]
Estos patrones de sulfatación son un factor crucial que regula la proliferación de células neuronales en el SNC a través de interacciones específicas con factores proteicos bioactivos como factores de crecimiento y factores neurotróficos. Así, polisacáridos de dermatán sulfato que contengan una secuencia específica activa tienen un gran potencial terapéutico.
Regeneración hepática[editar]
El dermatán sulfato altamente sulfatado participa en el desarrollo del hígado. Se ha demostrado que se une fuertemente a diversos factores del hígado como factores de crecimiento de los hepatocitos (HGF) y los factores de crecimiento EGF-like de unión a heparina (HB-EGF), que es el factor clave para la progresión de los hepatocitos durante la regeneración del hígado.[20]
Durante la regeneración, se producen cambios transitorios en la estructura de los GAGs presentes en el hígado y que están asociados con la proliferación de hepatocitos. En hígados cirróticos con lesiones fibrosas, se produce un incremento de dermatán sulfato, al mismo tiempo que se produce un decrecimiento en el grado de sulfatación y en el contenido de IdoA de las cadenas de dermatán sulfato, en comparación con hígados sin lesiones fibrosas, donde esto no se produce. Una deficiencia de xylosyltransferasa 2, que es una enzima involucrada en la síntesis de GAGs, causa la pérdida de una gran cantidad de estos en el hígado y esto resulta en anormalidades hepáticas significativas como hiperplasia en el tracto biliar, fibrosis y quistes biliares.
Esto indica que el dermatán sulfato en el hígado es importante para la proliferación hepatocelular y para la diferenciación. Por esto, la administración de dominios funcionales de dermatán sulfato, que interactúen específicamente con factores para la regeneración del hígado como HGF y HB-EGF, pueden regular la fisiología de las funciones hepáticas. Las cadenas de dermatán sulfato y sus derivados, son candidatos potenciales para el desarrollo de terapias de regeneración hepática.
Reparación de heridas[editar]
El dermatán sulfato es muy abundante en la piel, y su actividad relacionada con la coagulación, el crecimiento celular y su capacidad para interactuar con varias proteínas, hacen que tenga potencial para reparar heridas.
Anticoagulante y antitrombótico[editar]
El cofactor II de la heparina produce la inhibición de la actividad coagulante de la trombina. El dermatán sulfato puede unirse a este cofactor, por eso, si administramos un fármaco que contenga dermatán, el efecto inhibitorio del cofactor II, aumenta 1000 veces.
El dermatán sulfato puede ser una buena alternativa como anticoagulante para sustituir la heparina sin fraccionar en pacientes en hemodiálisis. La heparina natural es un polímero con varias cadenas de distinto tamaño. La heparina sin fraccionar es un fármaco que se usa actualmente como anticoagulante en tratamientos de diálisis regulares, a pesar de que puede producir trombocitopenia, dislipemia, alergia y osteoporosis. El dermatán sulfato inhibe la trombina selectivamente, no inhibe F-Xa y no interfiere con las plaquetas. Hay estudios que han demostrado que el dermatán sulfato es tan efectivo como la heparina sin fraccionar, por eso es un fármaco potencial en casos de trombocitopenia u otros casos adversos.[21]
Fármaco antitumoral[editar]
La progresión del cáncer está relacionada con la acumulación de proteoglicanos como el dermatán sulfato y el condroitín sulfato en el tejido. El dermatán sulfato interactúa con diversos factores de crecimiento y citoquinas que participan en la formación y la progresión del cáncer. Las consecuencias son alteraciones estructurales de las cadenas de dermatán sulfato, y eso hará que sus propiedades influyan en el crecimiento y migración de las células cancerosas. Aún no se han identificado cuales son las secuencias que se unirán a las proteínas clave del desarrollo del cáncer, pero se está investigado para encontrar dianas moleculares que sirvan para el diagnóstico y el tratamiento de la enfermedad.[22]
Véase también[editar]
- Glicosaminoglicanos
- Ácido hialurónico
- Heparán sulfato
- Condroitín sulfato
- Queratán sulfato
- Mucopolisacaridosis
Referencias[editar]
- ↑ Número CAS
- ↑ Trowbridge, JM; Gallo, RL (septiembre de 2002). «Dermatan sulfate: new functions from an old glycosaminoglycan». Glycobiology 12 (9): 117R-25R. PMID 12213784. doi:10.1093/glycob/cwf066.
- ↑ SINGLA, SK (29 de junio de 2010). «Dermatan Sulphate: Structure, Biosynthesis and Functions». Biochemistry and Molecular Biology Education 16 (3).
- ↑ a b c d S K SINGLA (29 de junio de 2010). «Dermatan Sulphate: Structure, Biosynthesis and Functions». Biochemical Education (Department of Biochemistry. Punjab Agricultural University. Ludhiana-141004, India) 16 (3).
- ↑ «http://themedicalbiochemistrypage.org/es/glycans-sp.php».
- ↑ Meyer, K; Chaffee, E (1941). J. Biol. Chem. 138 (491).
- ↑ Hoffman, P; Linker, A; Meyer, K (1956). Science 124.
- ↑ Brimacombe, J. S.; Webber, J. M. (1964). Mucopolysaccharides. New York: American Elsevier Publishing Company, Inc. pp. p. 82.
- ↑ HOFFMAN, P; LINKER, A.; MEYER, K. (1957). Biochem. Biophys. 69 (435).
- ↑ Rod, G; Dorfman, A. (1958). J. Biol. Chem. 223 (1030).
- ↑ a b c Silbert JE1; Sugumaran G. (2002 Oct). «Biosynthesis of chondroitin/dermatan sulfate.». IUBMB Life. 54(4): :177-86.
- ↑ Robbins, P W; Lipmann, F. (1957). J. Biol. Chem. 229: 837-851.
- ↑ Malmström, A; Franson, L A.; Hook, M.; Lindahl, U. (1975). J. Biol. Chem. 250: 3419-3425.
- ↑ Casu B, Naggi A, Torri G. Chemical derivatization as a strategy to study structure-activity relationships of glycosaminoglycans. Sem Thromb Hemost 2002; 28 (4): 335-342
- ↑ Rossi E, Kordich L. Niveles plasmáticos e interacciones del sistema Cofactor II de la Heparina–Trombina– Der-matán Sulfato (tesis doctoral). Buenos Aires, Universi- dad de Buenos Aires; 1999.
- ↑ Tollefsen DM, Pestka CA, Monafo WJ. Activation of heparin cofactor II by dermatan sulfate. J Bio Chem 1983; 258(11): 6713-6
- ↑ Castañon MM, Gamba C, Kordich L. Insight into the profibinolytic activity of dermatan sulfate: effects on the activation of plasminogen mediated by tissue-type and urinary-type plasminogen activator. Thrombosis Research 2007; 120, 745-52
- ↑ Lauricella AM, Castañon MM, Gamba C, Usach V, Kordich L. Efecto del Dermatán Sulfato en la formación y lisis de redes de fibrina
- ↑ Yamada,S; Sugahara,K (2008) Potential Therapeutic Application of Chondroitin Sulfate/Dermatan Sulfate Current Drug Discovery technologies. 5, 289-301.
- ↑ Yamada,S; Sugahara,K (2008)Potential Therapeutic Application of Chondroitin Sulfate/Dermatan Sulfate Current Drug Discovery technologies. 5, 289-301.
- ↑ Vitale,C; et al (2013) Dermatan sulfate: an alternative to unfractionated heparin for anticoagulation in hemodialysis patients. JNEPHROL 26(01): 158- 163
- ↑ «https://www.bioiberica.com/salud-humana/heparina/productos-de-heparina/dermatan-sulfato/».
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Dermatán sulfato.
Wikimedia Commons alberga una categoría multimedia sobre Dermatán sulfato. Wikiquote alberga frases célebres de o sobre Dermatán sulfato.
Wikiquote alberga frases célebres de o sobre Dermatán sulfato. Wikcionario tiene definiciones y otra información sobre dermatán sulfato.
Wikcionario tiene definiciones y otra información sobre dermatán sulfato.- What Is The Definition Of Dermatan sulfate - Medical Dictionary Free Online
- Bioquímica: libro de texto con aplicaciones clínicas
Escrito por Thomas M. Devlin [1]