Alilación de carbonilo

La Alilación de carbonilo, en química orgánica, describe métodos para agregar un anión alilo a un aldehído o a una cetona para producir un alcohol homoalílico.[1] La alilación de carbonilo fue reportada por primera vez en 1876 por Alexander Zaitsev y empleó un reactivo de alilzinc.[2]
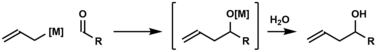
Versiones enantioselectivas[editar]
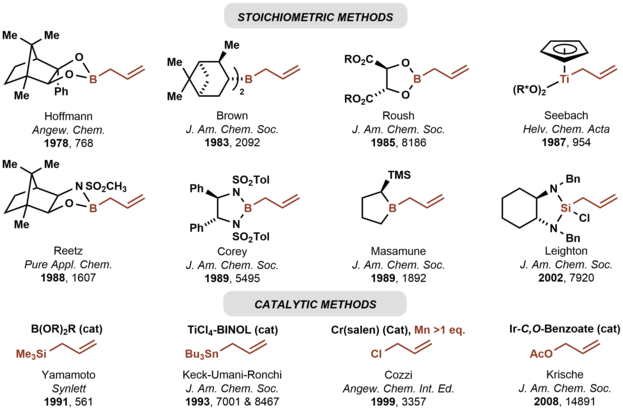
En 1978, Hoffmann informó sobre la primera alilación asimétrica de carbonilo utilizando un reactivo de alilmetal quiral, un alilborano derivado del alcanfor.[3][4] Dichos métodos utilizan reactivos de metales alílicos preformados. El enfoque está bien desarrollado utilizando alilboranos[5] Como se ilustra en la alilación de Keck,[6] las adiciones catalíticas enantioselectivas de reactivos de alilmetales aquirales a compuestos de carbonilo también son posibles mediante adiciones de organoestananos.[7]
(13)

Como lo ilustra la alilación de Keck,[6] Las adiciones catalíticas enantioselectivas de reactivos de alilmetales aquirales a compuestos de carbonilo también son posibles mediante adición de organoestananos.[7]
También se han desarrollado reactivos de boronato y -borano alílicos para la adición enantioselectiva de carbonilos; en esta clase de reacciones, el reactivo de boro alílico confiere control estereoquímico
Catálisis[editar]
En 1991, Yamamoto reveló el primer método enantioselectivo catalítico para la alilación de carbonilo, que empleaba un catalizador ácido de Lewis de boro quiral en combinación con aliltrimetilsilano.[8] Siguieron muchos otros métodos catalíticos enantioselectivos para la alilación de carbonilo.[9][6] Las variantes catalíticas de la reacción de Nozaki-Hiyama-Kishi representan un método alternativo para la alilación de carbonilo asimétrica, pero se requieren reductores metálicos estequiométricos.[10]
Mientras que las alilaciones de carbonilo asimétricas antes mencionadas se basan en reactivos de alilmetal preformados, la alilación de Krische explota el acetato de alilo para la alilación de carbonilo enantioselectiva.[11] Los métodos seleccionados para la alilación de carbonilo asimétrica se resumen a continuación.
Uso en síntesis total[editar]
La alilación de carbonilo se ha empleado en la síntesis de productos naturales de policétido y otras moléculas oxigenadas con una matriz contigua de estereocentros. Por ejemplo, la alilestananación de un aldehído derivado de la treosa produce el macrólido antascomicina B, que estructuralmente se parece a FK506 y rapamicina, y es un potente aglutinante de FKBP12.[12] La alilación de Krische se usó para preparar el policétido (+)-SCH 351448, un ionóforo macrodiólido con 14 centros estereogénicos.[13]

Referencias[editar]
- ↑ Yus, Miguel; González-Gómez, José C.; Foubelo, Francisco (2011). «Catalytic Enantioselective Allylation of Carbonyl Compounds and Imines». Chemical Reviews 111 (12): 7774-7854. PMID 21923136. doi:10.1021/cr1004474.
- ↑ Michael; Saytzeff, Alexander (1877). «Synthese des Allyldimethylcarbinols». Justus Liebigs Annalen der Chemie (en inglés) 185 (2–3): 151-169. ISSN 1099-0690. doi:10.1002/jlac.18771850204.
- ↑ Herold, Thomas; Hoffmann, Reinhard W. (1 de octubre de 1978). «Enantioselective Synthesis of Homoallyl Alcohols via Chiral Allylboronic Esters». Angewandte Chemie International Edition in English 17 (10): 768-769. doi:10.1002/anie.197807682.
- ↑ Hoffmann, Reinhard W.; Herold, Thomas (1 de enero de 1981). «Stereoselektive Synthese von Alkoholen, VII1) Optisch aktive Homoallylalkohole durch Addition chiraler Boronsäureester an Aldehyde». Chemische Berichte 114 (1): 375-383. doi:10.1002/cber.19811140139.
- ↑ Denmark, S. E.; Almstead, N. G. In Modern Carbonyl Chemistry; Otera, J., Ed.; Wiley-VCH: Weinheim, 2000; Chapter 10.
- ↑ a b c Keck, Gary E.; Tarbet, Kenneth H.; Geraci, Leo S. (1 de septiembre de 1993). «Catalytic asymmetric allylation of aldehydes». Journal of the American Chemical Society 115 (18): 8467-8468. doi:10.1021/ja00071a074.
- ↑ a b Denmark, Scott E.; Fu, Jiping (1 de agosto de 2003). «Catalytic Enantioselective Addition of Allylic Organometallic Reagents to Aldehydes and Ketones». Chemical Reviews (en inglés) 103 (8): 2763-2794. ISSN 0009-2665. PMID 12914480. doi:10.1021/cr020050h.
- ↑ Furuta, Kyoji; Mouri, Makoto; Yamamoto, Hisashi (1 de enero de 1991). «Chiral (Acyloxy)borane Catalyzed Asymmetric Allylation of Aldehydes». Synlett 1991 (8): 561-562. doi:10.1055/s-1991-20797.
- ↑ Costa, Anna Luisa; Piazza, Maria Giulia; Tagliavini, Emilio; Trombini, Claudio; Umani-Ronchi, Achille (1 de julio de 1993). «Catalytic asymmetric synthesis of homoallylic alcohols». Journal of the American Chemical Society 115 (15): 7001-7002. doi:10.1021/ja00068a079.
- ↑ Hargaden, Gráinne C.; Guiry, Patrick J. (5 de noviembre de 2007). «The Development of the Asymmetric Nozaki–Hiyama–Kishi Reaction». Advanced Synthesis & Catalysis 349 (16): 2407-2424. doi:10.1002/adsc.200700324.
- ↑ Kim, In Su; Ngai, Ming-Yu; Krische, Michael J. (5 de noviembre de 2008). «Enantioselective Iridium-Catalyzed Carbonyl Allylation from the Alcohol or Aldehyde Oxidation Level via Transfer Hydrogenative Coupling of Allyl Acetate: Departure from Chirally Modified Allyl Metal Reagents in Carbonyl Addition». Journal of the American Chemical Society (en inglés) 130 (44): 14891-14899. ISSN 0002-7863. PMC 2890235. PMID 18841896. doi:10.1021/ja805722e.
- ↑ Brittain, Dominic E. A.; Griffiths-Jones, Charlotte M.; Linder, Michael R.; Smith, Martin D.; McCusker, Catherine; Barlow, Jaqueline S.; Akiyama, Ryo; Yasuda, Kosuke et al. (2005). «Total Synthesis of Antascomicin B». Angewandte Chemie International Edition 44 (18): 2732-2737. ISSN 1521-3773. PMID 15806607. doi:10.1002/anie.200500174.
- ↑ Wang, Gang; Krische, Michael J. (6 de julio de 2016). «Total Synthesis of (+)-SCH 351448: Efficiency via Chemoselectivity and Redox-Economy Powered by Metal Catalysis». Journal of the American Chemical Society 138 (26): 8088-8091. ISSN 0002-7863. PMC 4935581. PMID 27337561. doi:10.1021/jacs.6b04917.
Véase también[editar]
- Esta obra contiene una traducción derivada de «Carbonyl allylation» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.