Acridina

| Acridina | ||
|---|---|---|
 | ||
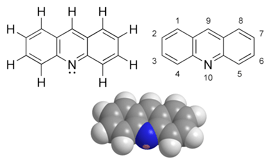 | ||
| Nombre IUPAC | ||
| Acridina | ||
| General | ||
| Otros nombres | 9-Azaantraceno, Dibenzo[b,e]piridina | |
| Fórmula estructural | | |
| Fórmula molecular | C13H9N | |
| Identificadores | ||
| Número CAS | 260-94-6[1] | |
| Número RTECS | AR7175000 | |
| ChEBI | 36420 | |
| ChEMBL | CHEMBL39677 | |
| ChemSpider | 8860 | |
| PubChem | 9215 | |
| UNII | 42NI1P5Q1X | |
| Propiedades físicas | ||
| Masa molar | 17 913 g/mol | |
| Punto de fusión | 380,15 K (107 °C) | |
| Punto de ebullición | 619,5 K (346 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La acridina, C13H9N, es un compuesto orgánico y un compuesto heterocíclico del nitrógeno. Además, el término se utiliza para describir a los compuestos que contienen al compuesto tricíclico C13N. La acridina se obtiene a partir de los aceites de antraceno, compuesto con el que se halla relacionada estructuralmente, durante el proceso de destilación del alquitrán. Principalmente, se utiliza en la fabricación de colorantes.
Descubrimiento, Aislamiento y Síntesis[editar]
Carl Gräbe y Heinrich Caro aislaron por primera vez acridina en 1870 del alquitrán de hulla. La acridina se separa del alquitrán de hulla extrayéndola con ácido sulfúrico diluido. La adición de dicromato de potasio a esta solución precipita el dicromato de acridinio. El dicromato se descompone con amoníaco.
La acridina y sus derivados pueden prepararse mediante muchos procesos sintéticos:
- En la síntesis de acridina de Bernthsen, la difenilamina se condensa con ácidos carboxílicos en presencia de cloruro de zinc. Cuando el ácido fórmico es el ácido carboxílico, la reacción produce la acridina original. Con los ácidos carboxílicos superiores más grandes, se generan los derivados sustituidos en el átomo de carbono meso.
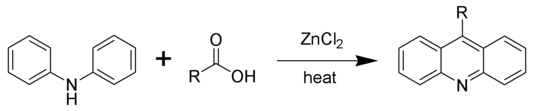
The Bernthsen acridine synthesis
Se han descrito métodos más antiguos para la síntesis orgánica de acridinas incluyen la condensación de difenilamina con cloroformo en presencia de cloruro de aluminio, pasando los vapores de ortoaminodifenilmetano sobre el litarge. Otro método procede calentando salicilaldehído con anilina y cloruro de zinc o destilando acridona (una cetona con el grupo carbonilo en la posición 9) sobre polvo de zinc.[2] Otro método clásico para la síntesis de acridonas es la síntesis de acridinas de Lehmstedt-Tanasescu.

Enzimáticamente, las acridinas naturales se sintetizan por una policétido sintasa (acridona sintasa):[3]

Referencias[editar]
- ↑ Número CAS
- ↑
 Una o varias de las anteriores afirmaciones incorpora texto de una publicación sin restricciones conocidas de derecho de autor:
Una o varias de las anteriores afirmaciones incorpora texto de una publicación sin restricciones conocidas de derecho de autor:  Varios autores (1910-1911). «Acridine». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Varios autores (1910-1911). «Acridine». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público. - ↑ Maier W, Baumert A, Schumann B, Furukawa H, Groger D (1993). «Synthesis of 1,3-dihydroxy-N-methylacridone and its conversion to rutacridone by cell-free extracts of Ruta-graveolens cell cultures». Phytochemistry 32 (3): 691-698. doi:10.1016/S0031-9422(00)95155-0.
Bibliografía[editar]
- Synthesis of Acridine-based DNA Bis-intercalating Agents Gerard P. Moloney, David P. Kelly, P. Mack Molecules 2001, 6, 230-243 [1] open source
 Varios autores (1910-1911). «Acridine». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Varios autores (1910-1911). «Acridine». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Enlaces externos[editar]
- Harper 27s New Monthly Magazine, Vol. XLIV, No. 261, February 1872, Editor= 27s Scientific Record- Acridine%2C a New Anthracene Derivative, A magazine account (1872) of the isolation of acridine.
- Synthesis of acridone in Organic Syntheses 19:6; Coll. Vol. 2:15 [2] from o-chlorobenzoic acid and aniline in a Goldberg reaction.
- Synthesis of 9-aminoacridine in Organic Syntheses 22:5; Coll. Vol. 3:53. [3] from N-phenylanthranilic acid.
