ARN no codificante

Un ARN no codificante (ncRNA) es una molécula de ARN funcional, que a diferencia del ARN mensajero no se traduce en una proteína. Sinónimos menos frecuentes son, ARN no codifica proteínas (npcRNA en inglés), ARN no mensajero (nmRNA) y ARN funcionales (fRNA). El término small ARN ( sRNA) se utiliza a menudo por sus siglas en las bacterias ncRNAs. La secuencia de ADN de la que un ARN no codificante se transcribe, a menudo se llama un gen de ARN no codificante.
Los genes de ARN no codificante incluyen funcionalidades abundantes y muy importantes como ARN de transferencia (tRNA) y ARN ribosomal (rRNA), así como también en ARN, tales como snoRNAs, microARNs, siRNAs y piRNAs y el ncRNA largo, que incluyen ejemplos tales como Xist y HOTAIR(HOX antisense intergenic RNA). El número de ncARNs (no codificantes de proteínas)en el genoma humano es desconocido; sin embargo, recientes estudios transcriptómicos y bioinformáticos sugieren la existencia de miles de ncARNs. La función de muchos de los ncARNs identificados recientemente no está confirmada, siendo posible,que muchos de estos, sean no funcionales.[1][2]
Historia y Descubrimiento[editar]
Los ácidos nucleicos fueron descubiertos por primera vez en 1868 por Friedrich Miescher, para 1939 el ARN había sido implicado en la síntesis de proteínas. Dos décadas más tarde, Francis Crick predijo un componente funcional de ARN que mediaba la traducción, sugirió que el ARN es más adecuado para pares de bases con la transcripción de ARNm de un puro polipéptido.
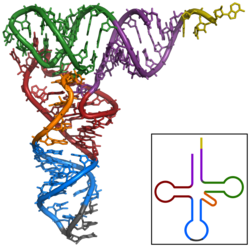
El primer ARN no codificante en ser caracterizado fue un tARN de alanina el cual se hallaba en la levadura utilizada para pastelería, su estructura se publicó en 1965. Para producir una muestra (purificada) de tARN de alanina, Robert W. Holley et al. utilizó 140 kg. de levadura de pastelería comercial para obtener no más de 1g de tARNA Ala purificada para su análisis. El tARN de 80 nucleótidos fue secuenciado primero y digerido en ribonucleasa pancreática (producto de fragmentos que producían Citosina o Uridina) y después en ribonucleasa takadiastasa Tl (producto de fragmentos que producía Guanosina). La cromatografía y la identificación de los extremos 5' y 3' va ayudar después a ordenar los fragmentos para estabilizar la secuencia de ARN. De las tres estructuras propuestas originalmente para este tARN, la estructura en forma de trébol va a ser propuesta de forma independiente en siguientes publicaciones. La estructura secundaria en forma de trébol va ser concretada después de un análisis con cristalografía de rayos X realizado por dos grupos de investigación independientes en 1974.
El ARN ribosomal fue el siguiente en ser descubierto, seguido por el UARN a principios de los años 80. Desde entonces el descubrimiento de nuevos ARNs no codificantes ha continuado con los snoRNAs, Xist, CRISPR y muchos más. Adiciones notables recientes incluyen Riboswitches y el miARN, el descubrimiento del mecanismo del ARNi fue descubierto por Craig C. Mello y Andrew Fire (ganadores en el 2006 del Premio Nobel de Medicina y Fisiología).
Funciones Biológicas del ncARN[editar]
Los ARNs no codificantes pertenecen a diversos grupos y participan en muchos procesos celulares. Estos van desde los ncARNs de vital importancia que se conservan en la mayoría de la vida celular a través de ncARNs más transitorios, que son específicos para una o unas pocas especies relacionadas. Se cree que los ncARNs más conservados son llamados fósiles o reliquias moleculares de LUCA y el mundo de ARN.
Traducción en ncRNAs[editar]

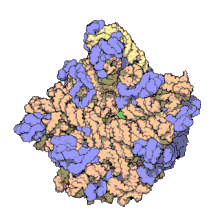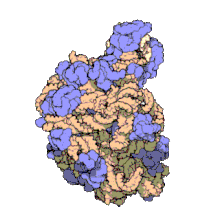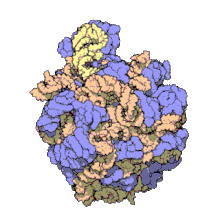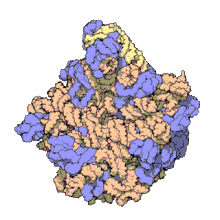
Muchos de los ncARNs esenciales y abundantes conservados están implicados en la traducción. Las partículas de ribonucleoproteina (RNP) o ribosomas son llamadas "fabricas" donde la traducción tiene lugar en la célula. El ribosoma cuenta con más del 60% de ARN ribosomal, formado por tres ncARNs en procariotas y cuatro ncARNs en eucariotas. Los ARNs ribosomales catalizan la traducción de secuencias de nucleótidos a proteína. Otro tipo de ncARNs, los ARN de transferencia, forman una molécula adaptadora” entre el mARN y las proteínas. Los snoARNs H/ACA box y C/D box son ncARNs que se encuentran en arqueas y eucariotas y la ARNasa MRP está restringida solo para las eucariotas, ambos grupos de ncARN están implicados en la maduración del rARN. Los snoARNs guían modificaciones covalentes de rARN, tARN y nARNs, la ARNasa MRP rompe el primer espaciador interno trascrito entre 18S u 5,8S rARNs. El ncARN omnipresente, RNasa P, es un pariente evolutivo de la RNasa MRP. La RNasa P madura secuencias de tARN generando 5' extremos maduros de tARN y cortanto el 5' elemento líder de los tARNs precursores. Otro omnipresente RNP llamado SRP reconoce y transporta nuevas proteínas al retículo endoplasmatico en eucariotas y a la membrana plasmática en procariotas. En bacterias el ARN mensajero de trasferencia (tmRNA)N) es un RNP implicado en rescatar ribosomas estancados, etiquetando polipéptidos incompletos y promoviendo la degradación de mARN en mal estado.
ncRNAs in RNA splicing (empalme)[editar]

En las eucariotas el espliceosoma (spliceosome) realiza las reacciones de empalme, esenciales para retirar las secuencias de los Intrones. Este proceso es necesario para la formación de mARN maduro. El spliceosome es un empalmador RNP a menudo también conocido como snRNP o tri-snRNP. Hay dos formas diferentes de espliceosoma, la mayor y la menor. Los componentes principales del espliceosoma ncRNA son U1, U2, U4, U5, U6. Los componentes menores del espliceosoma ncRNA son U11, U12, U5, U4atac y U6atac. Otro grupo de intrones pueden catalizar su propia eliminación de las transcripciones acogidas, a esto se le conoce como auto-empalme de ARNs y se dividen en dos grupos principales, el grupo I de intrones catalíticos y el grupo II de intrones catalíticos. Estos ncARNs catalizan su propia escisión a partir de los precursores de mARN, tARN y rARN en una gran diversidad de organismos.
En mamíferos, se ha descubierto que los snoARNs pueden regular el empalme alternativo del ARNm. Por ejemplo, el snoARN HBII-52 regula el empalme del receptor de serotonina 2C.[4]
En los nematodos, el SmY ncARN parece estar involucrada en el trans-splicing del mARN.
ncARNs en la Regulación Genética[editar]
La expresión de muchos miles de genes son regulados por ncRNAs. Esta regulación se puede producir en el trans o en cis.
trans-acting ncRNAs[editar]
En las eucariotas superiores el microARN regula la expresión génica. Un solo microARN puede reducir los niveles de expresión de centenares de genes. Es el mecanismo por el cual las moléculas de microARN maduro actúan a través de moléculas parcialmente complementarias a uno o más mensajeros mARNs, generalmente en 3'UTRs. La función principal de los microARNs es inhibir la expresión genética.
Se ha demostrado que la ncARN RNasa P también influye sobre la expresión génica. En el núcleo humano, la RNasa P es necesaria para la trascripción normal y eficiente de diversos ncARNs transcritos por el ARN polimerasa III. Estos incluyen genes de tARN, 5S rARN, SRP ARN y U6 snARN. La ARNasa P ejerce su función en la trascripción asociándose con la Pol III y la cromatina de los genes activos de tARN y 5S rARN.[5]
Se ha demostrado que el 7SK ARN, un ncARN de metazoos, actúa como un regulador negativo del factor de elongación P-TEFb de la ARN polimerasa II, y que esta actividad está influenciada por las vías de respuesta al estrés.
El ncARN bacterial, 6S ARN, se asocia específicamente en la holoenzima ARN polimerasa, que cuenta con el factor específico sigma 70. Esta interacción reprime la expresión de un promotor dependiente de sigma 70 durante la fase estacionaria.
Otro ncARN bacterial, el OxyS ARN, reprime la traducción asociándose a secuencias de Shine-Dalgarno obstaculizando la unión de los ribosomas. El OxyS ARN es producido como respuesta al estrés oxidativo en Escherichia coli.
El B2 ARN es un pequeño trascrito de ncARN polimerasa III que reprime la trascripción del mARN en respuesta al choque térmico producido en las células del ratón. El B2 ARN inhibe la trascripción asociándose al núcleo de la Pol II. A través de esta interacción, el B2 ARN reúne complejos de preiniciación en el promotor y bloquea la síntesis de ARN.[6]
Un estudio reciente ha demostrado que solo el acto de trascripción de la secuencia de ncARN puede tener influencia sobre la expresión genética. La trascripción a ncARN de la ARN polimerasa II se necesita para la remodelación de la cromatina en los Shizosaccharomyces pombe. La cromatina adopta progresivamente una configuración abierta, así es como diversas especies de ncARN son transcritos.[7]
cis-acting ncRNAs[editar]
Un número de ncARNs están unidos a los 5 'UTRs de los genes codificantes de proteínas e influencian su expresión de diversas maneras. Por ejemplo, un riboswitch puede unir directamente una molécula objetivo pequeña y esta unión afecta la actividad genética.
Se encuentran secuencias de ARN líder en la zona superior del primer gen de los peronés biosintetizadores de aminoácidos. Estos elementos de ARN forman una de las dos posibles estructuras en regiones codificadas con secuencias péptidas muy cortas que son ricos en aminoácidos producto final del operon. Una estructura degradadota se forma cuando existe un exceso de los aminoácidos reguladores y el movimiento ribosómico sobre la trascripción del líder no se simplifica. Cuando hay una deficiencia de tARN cargado del aminoácido regulador, el ribosoma actúa formando la estructura no-degradativa. Así permite al ARN polimerasa transcribir el operón. Los ARN líderes conocidos son el operó líder de histidina, el operón líder de leucina, el operón líder de treonina y el operón líder de triptòfan.
El IRE (“Iron reponse elements”, Elementos de respuesta al hierro) están unidos por IRP (Iron response proteins”, proteínas de respuesta al hierro). El IRE se encuentra en UTRs de diferentes mARNs producidos que participan en el metabolismo del hierro. Cuando la concentración del hierro es baja, los IRPs conducen la IRE mARN de ferritina para la represión de su traducción.
IRES (“Internal ribosome entry sites”, sitios de entrada internos de los ribosomas) son una estructura de ARN que permiten la iniciación de la traducción en la mitad de la secuencia de mARN como parte del proceso de síntesis proteica.
ncRNAs y la defensa del Genoma[editar]
Los ARNs Piwi-interactivos (piARNs) se expresan en los testículos y las células somáticas de los mamíferos, forman proteínas de ARN con las proteínas Piwi. Estas complejas piARNs están relacionadas con la inhibición de la trascripción genética de los retrotransposones y otros elementos genéticos de las células de la línea germinal, especialmente aquellas implicadas en la espermatogénesis.
El CRISPR (“Clustered Regularly Interspaced Short Palindromic Repeats”) son repeticiones encontradas en el DNA de muchas bacterias y de las arqueas. Las repeticiones están separadas por espacios de longitud similar. Se ha demostrando que estos espacios pueden derivar de infecciones víricas y, consecuentemente, pueden ayudar a las células a protegerse de las infecciones.
ncRNAs y la estructura Cromosómica[editar]
La telomerasa es una enzima RNP que añade repeticiones de secuencias específicas de DNA ("TTAGGG" en vertebrados) a regiones teloméricas, las cuales se encuentran al final de los cromosomas de los eucariotas. Los telomeros contienen DNA condensado, que dan estabilidad a los cromosomas. La enzima es una transcriptasa inversa que lleva ARN telomerasa, que es utilizada para alargar los telòmeros, que se acortan después de cada ciclo de replicación.
Xist (“X-inactive-specific transcript”, trascriptor especifico de X inactivo) es un gen largo ncARN que se encuentra en los cromosomas X de los mamíferos placentarios y actúa como un efector del proceso de inactivación del cromosoma X y la formación de cuerpos de Barr. Un RNA antisentido, Tsix, es un regulador negativo de Xist. Los cromosomas X con falta de expresión de Tsix (por lo tanto tiene un alto nivel de trascripción de Xist) son inactivados más frecuentemente que en los cromosomas normales. Existen también los drosofilidos, que utilizan de igual forma un sistema de determinación del sexo XY, los ARNs roX (ARN del cromosoma X) están involucrados en la compensación de la dosis. Tanto Xist como roX presentan una regulación epigenètica de la trascripción a través de la captación de enzimas modificadoras de las histonas.
RNA Bifuncional[editar]
Los ARNs bifuncionales son ARNs que tienen dos funciones diferentes. También son conocidos como ARNs de doble función. La mayoría de los ARNs bifuncionales conocidos son mARNs que codifican una proteína y ncARNs. Sin embargo, también hay un creciente número de ncARNs que se dividen en dos categorías diferentes de ncARN. Por ejemplo, H/ACA caja snoARN y miARN.[8][9]
Dos ejemplos bien conocidos de ARNs bifuncionales son el SgrS ARN y el ARNIII. Sin embargo, se conocen también otros ARNs bifuncionales existentes: SRA,[10] VegT ARN,[11][12] Oskar ARN[13] y ENOD40.[14]
ncRNAs y las Enfermedades[editar]
Al igual que con las proteínas, las mutaciones o los desequilibrios en el repertorio ncRNA en el cuerpo pueden causar una variedad de enfermedades.
Cancer[editar]
Muchos ncARNs muestran patrones anormales de expresión en tejidos cancerosos. Estos incluyen miARNs, mARN-like ncARNs largos, GAS5 SNORD 50, ARN telomerasa y YARNs. Los miARNs están involucrados en una gran escala regulatoria de muchos genes codificadores de proteínas; los YARN son importantes para la iniciación de la replicación de DNA, El ARN telomerasa funciona como inicio para la telomerasa, una RNP encargada de alargar o mantener las regiones teloméricas en los extremos de los cromosomas. La función directa del mARN-like ncARNs lago es muy clara.
Se ha demostrado que las mutaciones de la línea germinal en los precursores primarios del miR-16-1 y del miR-15 son más frecuentes en los pacientes con leucemia linfoide crónica que en la población controlada.
Se ha sugerido que un SNP extraño (rs11614913) que está superpuesto a la hsa-mir-196a2 está asociado al carcinoma pulmonar de las células pequeñas. Del mismo modo, una pantalla de 17 miARNs que se ha previsto que regula un número de variaciones de genes asociados al cáncer de mama presentara variaciones al miR17 y miR-30c-1. Estos pacientes no eran portadores de mutaciones BRCA1 ni BRCA2, arrojando la posibilidad de que el cáncer de mama hereditario pudiera ser causado por variaciones de estos miARNs.
Síndrome Prader-Willi[editar]
La supresión de los 48 ejemplares de la C / D caja snoRNA SNORD116 ha demostrado ser la causa principal del síndrome de Prader-Willi. Síndrome de Prader-Willi es un trastorno del desarrollo asociado con comer en exceso y dificultades de aprendizaje. SNORD116 tiene sitios de potencial objetivo en un número de genes codificadores de proteínas, y podría tener un papel en la regulación del empalme alternativo. llll
Autismo[editar]
El lugar cromosómico que contiene el ARN nucleolar pequeño SNORD115 de grupo de genes se ha duplicado en aproximadamente el 5% de individuos con rasgos autistas. Un modelo de ratón diseñado para tener una duplicación de la agrupación SNORD115 muestra el comportamiento de tipo autista.[15]
Hipoplasia cartílago-pelo[editar]
Se ha demostrado que las mutaciones en ARNses MRP causan hipoplasia cartílago cabello, una enfermedad asociada a un grupo de síntomas tales como baja estatura, escasez de cabello, anormalidades esqueléticas y una supresión del sistema inmune que se produce frecuentemente entre los Amish y los Filandeses. La variante mejor caracterizada es una transición A-G del nucleótido 70 que esta en una región bucle de dos bases 5' de un pseudoknot (estructura secundària del DNA) conservada. De todas maneras, muchas otras mutaciones entre ARNasa MRP también causan hipoplasia cartílago cabello.
Enfermedad de Alzheimer[editar]
El antisense RNA BACE1-AS está trascrito desde la banda opuesta del BACE1 y una regulación progresiva en los pacientes con Alzheimer. BACE1-AS regula la expresión de BACE1 Mitjançant lo cual incrementa la estabilización del BACE1 mARN y genera BACE1 adicional a través de un mecanismo post-traduccional de prealimentación. Por el mismo mecanismo también se aumentan las concentraciones de beta-amieloide, el principal constituyente de las placas seniles. Las concentraciones BACE1-AS son elevadas en individuos con la enfermedad de Alzheimer y en ratones transgènicos con la proteína precursora del amiloide.
miR-96 y Perdida de Audición[editar]
Variaciones en la región de inicio del miR-96 maduro se ha asociado a una enfermedad autosòmica dominante de progresiva perdida de audición en humanos y ratones. En los ratones homocigotos mutantes se descubrió que eran profundamente sordos, no mostrando respuestas cocleares. En los humanos y en los ratones heterocigotos progresivamente pierden su habilidad de escuchar.
Diferencia entre ARN funcional (fARN) y ncARN[editar]
Muchas publicaciones han comenzado a utilizar el término fARN, en comparación al ncARN, para describir regiones funcionales a nivel del ARN que podrían o no mantener separados los ARN transcriptos. Por tanto, cada ncARN es un fARN, pero existen fARN (tales como riboswitches, elementos SEICS y otras regiones cis-reguladoras) que no son ncARN. Sin embargo fARN también podría incluir mARN ya que este ARN codifica para proteínas y, por tanto, es funcional. Además, los ARNs evolucionados artificialmente también están englobados por el término fARN. Algunas publicaciones afirman que los términos ncARN y fARN son casi sinónimos.
Véase también[editar]
Referencias[editar]
- ↑ huelvaya.com. «Uno de cada cinco genes codificantes de los seres vivos podrían no serlo». Consultado el 25 de octubre de 2018.
- ↑ Hüttenhofer A, Schattner P, Polacek N (2005). «ARN no codificantes: esperanza o bombo?». Trends Genet 21 (5): 289-97. PMID 15851066. doi:10.1016/j.tig.2005.03.007.
- ↑ Ban N, Nissen P, Hansen J, Moore P, Steitz T (2000). «La estructura completa atómica de la subunidad ribosomal grande en la resolución 2,4. Ångström». Science 289 (5481): 905-20. PMID 10937989. doi:10.1126/science.289.5481.905.
- ↑ Kishore S, Stamm S (2006). «El snoRNA HBII-52 regula el empalme alternativo del receptor de la serotonina 2C». Science 311 (5758): 230-231. PMID 16357227. doi:10.1126/science.1118265.
- ↑ Reiner R, Ben-Asouli Y, Krilovetzky I, Jarrous N (2006). «Un papel para el catalizador P ribonucleoproteína RNasa en la transcripción del ARN polimerasa III.». Genes Dev 20 (12): 1621-35. PMC 1482482. PMID 16778078. doi:10.1101/gad.386706.
- ↑ Espinoza CA, Allen TA, Hieb AR, Kugel JF, Goodrich JA (2004). «B2 ARN se une directamente a la ARN polimerasa II para reprimir la síntesis de transcripción.». Nat Struct Mol Biol 11 (9): 822-9. PMID 15300239. doi:10.1038/nsmb812.
- ↑ Hirota K, Miyoshi T, Kugou K, Hoffman CS, Shibata T, Ohta K (2008). «Cromatina de remodelación por etapas por una cascada de iniciación de la transcripción de ARN no codificantes.». Nature 456 (7218): 130-4. PMID 18820678. doi:10.1038/nature07348.
- ↑ Saraiya AA, Wang CC (2008). «snoRNA, un precursor de la novela de microARN en Giardia lamblia.». PLoS Pathog 4 (11): e1000224. PMC 2583053. PMID 19043559. doi:10.1371/journal.ppat.1000224.
- ↑ Ender C, Krek A, Friedländer MR, Beitzinger M, Weinmann L, Chen W, Pfeffer S, Rajewsky N, Meister G (2008). «Un humano snoRNA con funciones de microARN.». Mol Cell 32 (4): 519-28. PMID 19026782. doi:10.1016/j.molcel.2008.10.017.
- ↑ Leygue E (2007). «Esteroides del receptor activador del ARN (SRA1): inusual productos de los genes con relevancia a la sospecha de cáncer de mama.». Nucl Recept Signal 5: e006. PMC 1948073. PMID 17710122. doi:10.1621/nrs.05006.
- ↑ Zhang J, King ML (1996). «Xenopus Vegt ARN se localiza en la corteza vegetal durante la ovogénesis y codifica una novela de T-box factor de transcripción que participan en el patrón del mesodermo.». Development 122 (12): 4119-29. PMID 9012531.
- ↑ Kloc M, Wilk K, Vargas D, Shirato Y, Bilinski S, Etkin LD (2005). «El papel potencial estructural de la no-codificación y la codificación de ARN en la organización del citoesqueleto de la corteza vegetal de los ovocitos de Xenopus.». Development 132 (15): 3445-57. PMID 16000384. doi:10.1242/dev.01919.
- ↑ Jenny A, Hachet O, Závorszky P, Cyrklaff A, Weston MD, Johnston DS, Erdélyi M, Ephrussi A (2006). «Una traducción independiente del papel de Oskar ARN a principios de la ovogénesis Drosophila.». Development 133 (15): 2827-33. PMID 16835436. doi:10.1242/dev.02456.
- ↑ Gultyaev AP, Roussis A (2007). «Identificación de conservacion de estructuras secundarias y los segmentos de expansión en enod40 ARN que revela nuevos enod40 homólogos en las plantas.». Nucleic Acids Res 35 (9): 3144-52. PMC 1888808. PMID 17452360. doi:10.1093/nar/gkm173.
- ↑ Nakatani J, Tamada K, Hatanaka F, et al. (junio de 2009). «Comportamiento anormal en el cromosoma de ingeniería de modelo de ratón para el consumo humano 15q11-13 la duplicación se ve en el autismo». Cell 137 (7): 1235-46. PMID 19563756. doi:10.1016/j.cell.2009.04.024.
Enlaces externos[editar]
- Amplia base de datos de mamíferos ncRNAs.
- La Base de datos de Rfam — una lista de comisariado de cientos de familias de ncRNAs relacionados.
- NONCODE.org — una base de datos libre de todo tipo de ARN no codificante (con excepción de los ARNt y ARNr).
- Conjunto de ncRNA base de datos (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). — más de 30.000 secuencias individuales de 99 especies de bacterias, arqueas y eucariotas.