Strictosidin
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
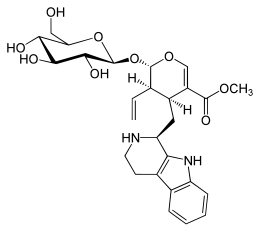
| Name | Strictosidin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C27H34N2O9 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 530,55 g·mol−1 | ||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Strictosidin ist ein Vincaalkaloid aus Rhazya stricta und dem Madagaskar-Immergrün (Catharanthus roseus) aus der Familie der Hundsgiftgewächse.[3] In der Synthese der Indolalkaloide spielt Strictosidin eine wichtige Rolle: Es ist der vermutete Vorläufer von über 1400 unterschiedlichen Indol-Terpen-Alkaloiden.[4] Zu erwähnen ist das Opioid Mitragynin, dessen Vorläufer Strictosidin ist, und somit für die Erforschung der Biosynthese von Opioiden neuer Generation eine große Rolle spielt.[5]
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Es entsteht durch Pictet-Spengler-Kondensation von Tryptamin und dem C-7 des Secologanin.[6] Diese Reaktion wird von dem Enzym Strictosidin-Synthase katalysiert.[7]

Forschung[Bearbeiten | Quelltext bearbeiten]
Die Beteiligung von Strictosidin an der antimikrobiellen Wirkung und der Wirkung als Antifraßstoff gegen diverse Insekten, der Blätter von Catharanthus roseus wurde untersucht. Strictosidin und sein Deglucosylierungsprodukt, das spezifisch durch das Enzym Strictosidin-Glucosidase gebildet wird, erwiesen sich als aktiv gegen mehrere Mikroorganismen.[8]
Analytik[Bearbeiten | Quelltext bearbeiten]
Der spezifische Drehwinkel des Hydrochlorids in Methanol beträgt −143° bei 25 °C im Natriumlicht.[9]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Renyer Alves Costa, Maria Lucia Belem Pinheiro, Kelson Mota Teixeira de Oliveira, Andersson Barison, Kahlil Schwanka Salomé, Júlio Rodolfo Iank, Noam Gadelha da Silva, Tiara Souza Cabral, Emmanoel Vilaça Costa: Structural, Vibrational, and Electronic Properties of the Glucoalkaloid Strictosidine: A Combined Experimental and Theoretical Study. In: Journal of Chemistry. Band 2016, 2016, S. e1752429, doi:10.1155/2016/1752429 (hindawi.com).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Von Strictosidin existieren verschiedene Stereoisomere, von denen das 3-α(S)-Isomer das biologisch aktive ist und in diesem Artikel besprochen wird.
- ↑ R. Hänsel, O. Sticher, E. Steinegger: Pharmakognosie – Phytopharmazie. 6. Auflage. Band 1. Springer, Berlin / Heidelberg 1999, ISBN 978-3-662-09269-9, S. 1029, doi:10.1007/978-3-662-09269-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Surash Ramanathan, Francisco León, Nelson J.Y. Chear, Siti R. Yusof, Vikneswaran Murugaiyah, Lance R. McMahon, Christopher R. McCurdy: Kratom (Mitragyna speciosa Korth.): A description on the ethnobotany, alkaloid chemistry, and neuropharmacology. In: Studies in Natural Products Chemistry. Band 69. Elsevier, 2021, ISBN 978-0-12-819487-4, S. 195–225, doi:10.1016/b978-0-12-819487-4.00003-3.
- ↑ Rimpler: Biogene Arzneistoffe (2. Auflage). S. 307–308.
- ↑ Bayer: Charakterisierung der Vinorin-Synthase aus „Rauvolfia serpentina“ durch Reinigung, Expression, Mutation und Kristallisation, Dissertation im Fachbereich Chemie und Pharmazie der Johannes-Gutenberg-Universität in Mainz (2003), S. 9.
- ↑ Teus J. C. Luijendijk, Ed van der Meijden, Rob Verpoorte: Involvement of strictosidine as a defensive chemical in Catharanthus roseus. In: Journal of Chemical Ecology. Band 22, Nr. 8, August 1996, S. 1355–1366, doi:10.1007/BF02027718.
- ↑ Eintrag zu Strictosidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.