Methaqualon
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
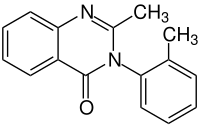 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Methaqualon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C16H14N2O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 250,30 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | 2,54[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Methaqualon ist ein Chinazolin-Derivat, dessen Name sich von der englischen chemischen Bezeichnung Methylquinazolinone (deutsch: Methylchinazolinon) ableitet. Es ist ein Arzneistoff, der als Hypnotikum und als Rauschmittel verwendet wurde und – mit gegenwärtigem Verbreitungsgebiet Afrika – weiterhin in Gebrauch ist.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Es wurde 1951 vom indischen Forscher M. L. Gujiral zufällig im Zuge der Suche nach einem Malariamittel entdeckt[4] und seit den 1960er-Jahren als Schlafmittel eingesetzt. 1965 wurde es unter den Handelsnamen Quaalude und Parest in den USA als Alternative zu den nicht ungefährlichen Barbituraten eingeführt. Das ursprünglich in der Werbung als nicht abhängig machend dargestellte Mittel führte aber durchaus zu Fällen physischer und psychischer Abhängigkeit, über die bereits 1966 in Großbritannien berichtet wurde.
Als auf der Straße gehandeltes Rauschmittel erfreute es sich in den USA aufgrund seiner euphorisierenden und aphrodisierenden Wirkung sehr bald großer Beliebtheit. Anfang der 1970er Jahre war das sogenannte „Luding out“, die Einnahme von 300 bis 450 mg Methaqualon zusammen mit Wein, unter College-Studenten weit verbreitet. Durch den Alkohol wird das durch Methaqualon ausgelöste Gefühl der Unzerstörbarkeit und starken Euphorie noch verstärkt. Methaqualon senkt (wie andere sedative Hypnotika) die Hemmschwelle und kann damit auch zu einer Steigerung des sexuellen Empfindens führen.
Im Juli 2015 wurde aus Gerichtsakten aus dem Jahr 2005 bekannt, dass Bill Cosby in mindestens einem Fall einer Frau ohne ihr Wissen Betäubungsmittel verabreicht haben soll, um mit dieser Sex zu haben. Er bestätigte in einem Gerichtsverfahren, in diesem Fall „Quaaludes“ verwendet zu haben.[5][6]
Pharmakologie[Bearbeiten | Quelltext bearbeiten]
Pharmakodynamik[Bearbeiten | Quelltext bearbeiten]
Methaqualon ist ein positiver allosterischer Modulator an GABAA-Rezeptoren, und zwar an jenen Typen, welche sich zusammensetzen aus den Untereinheiten α1,2,3,5 und β2,3 sowie γ2S.[2] Daneben verhält sich Methaqualon am Typ α4β1δ als stiller, an α6β1δ als negativer, an α4β2δ und α6β2,3δ als positiver Modulator, an α4β3δ als „Superagonist“.[2] Keine Wirkung zeigt es dabei an Benzodiazepin-, Barbiturat- oder Neurosteroid-Bindungsstellen.[2] Es wird angenommen, dass sich eine mögliche Wirkungskavität im transmembranären Abschnitt der Schnittstelle β(+)α(–) befindet und sich mit jener des Anästhetikums Etomidat überlappt.[7] Nach heutigem Kenntnisstand (2015) gilt es als selektiver GABAA-Rezeptor-Ligand.
Pharmakokinetik und Metabolismus[Bearbeiten | Quelltext bearbeiten]
Die therapeutische Plasmakonzentration liegt im Bereich von 0,4 bis 5 μg/mL, die Plasmahalbwertszeit beträgt 20 bis 60 Stunden und die Proteinbindung wird mit 75–95 % angegeben.[8] Methaqualon wird großenteils verstoffwechselt, vor allem durch Hydroxylierung an den Methylgruppen und den aromatischen Ringen. Es folgt Konjugation zu O-Glucuroniden und O-Methylethern. Durch N-Oxidation bildet sich Methaqualon-N-oxid.[2] Deutliche interindividuelle Unterschiede wurden im Mengenverhältnis der Metabolite beobachtet. 4'- und 2'-Hydroxymethaqualon können als die Metabolite mit den höchsten Konzentrationen ausgemacht werden, es folgen 3'-, 2- und 6-Hydroxymethaqualon. Das Methaqualonmolekül ist sterisch gehindert und unterliegt unter physiologischen Bedingungen der Atropisomerie, es ist damit chiral und es existieren entsprechende Rotamere. Nach Gabe von racemischem Methaqualon wird 4'-Hydroxymethaqualon über den menschlichen Urin nahezu stereospezifisch ausgeschieden. Bei den 3'-, 2'- und 2-Hydroxymetaboliten werden ungleiche Enantiomerenverhältnisse beobachtet, 6-Hydroxymethaqualon wird als Racemat ausgeschieden.[8] Die Enzyme CYP2D6 und CYP2C19 sind an der Verstoffwechselung nicht nennenswert beteiligt.[9]
Arzneimittelrechtlicher Status[Bearbeiten | Quelltext bearbeiten]
In den USA wurde das Medikament aufgrund der weiten Verbreitung als Rauschmittel schon 1984 vom Markt genommen, aber dennoch weiterhin illegal hergestellt, wobei es sich bei später sichergestellten illegal produzierten angeblichen Methaqualontabletten allerdings meist lediglich um hochdosierte Benzodiazepine, wie etwa Diazepam, handelte.
In der Bundesrepublik Deutschland war Methaqualon als Normi-Nox auf dem Markt, wurde allerdings schon 1981 dem Betäubungsmittelgesetz unterstellt und war damit als eine in der Anlage II des BtMG aufgeführte Substanz nicht mehr verschreibungsfähig. Ähnliches widerfuhr dem Wirkstoff in der DDR, wo Methaqualon der Hauptbestandteil des Schlafmittels Dormutil war, das aufgrund seiner häufigen Verwendung zu Rauschzwecken[10] schließlich ebenfalls aus dem medizinischen Verkehr gezogen wurde (das heute unter dem Namen Dormutil N bekannte Nachfolgepräparat enthält den Wirkstoff Diphenhydramin).
In Österreich wurde Methaqualon seines Suchtpotentials wegen 1992, in Deutschland 1993 die Zulassung als Schlafmittel gänzlich entzogen, während es in der Schweiz unter dem Namen Toquilone weit verbreitet blieb. Es war jedoch nur noch als Toquilone compositum, das zusätzlich Diphenhydramin enthält, im Handel und ist seit 2005 auch in der Schweiz nicht mehr verschreibungsfähig.
Verbreitung[Bearbeiten | Quelltext bearbeiten]
Während in westlichen Ländern Methaqualon nicht mehr erhältlich ist und demnach auch selten Verwendung als Rauschdroge findet, spielt es für den illegalen Einsatz in manchen afrikanischen Ländern, vor allem in Südafrika, immer noch eine große Rolle. In Südafrika ist es neben Marihuana sogar das verbreitetste illegale Rauschmittel (Stand 2017), es kommt in vielen verschiedenen Tabletten auf den Schwarzmarkt, die, ähnlich den Ecstasytabletten hierzulande, mit verschiedenen Logos versehen sind. Der Großteil des dort verbrauchten Methaqualons stammt aus illegaler Produktion aus Indien, von wo aus es nach Afrika eingeschmuggelt wird. Die am häufigsten anzutreffende Konsumform dort ist das Rauchen der zerbröselten Tabletten, oft gemischt mit Marihuana, was einen kurzzeitigen, sehr intensiven „Euphorieflash“ auslöst. Danach beginnt die sedative Komponente zu überwiegen und der Konsument verfällt in einen länger andauernden Dämmerzustand.
Geschichtlich zählt Methaqualon zu den Schlafmitteln, die in den 1960ern als Ersatz der aufgrund einer möglichen tödlichen Überdosierung umstrittenen Barbiturate dienen sollten. Andere Beispiele sind Ethchlorvynol (Handelsname Placidyl) oder Glutethimid (Handelsname Doriden). Allerdings riefen viele dieser Stoffe Euphorie und damit die Gefahr einer psychischen Abhängigkeit hervor, weshalb sie heute kaum noch in Verwendung sind.
Nebenwirkungen und Abhängigkeit[Bearbeiten | Quelltext bearbeiten]
Chronischer Gebrauch kann zu Polyneuropathie, zur psychischen und zur physischen Abhängigkeit führen. Bei Einnahme kleinerer Dosen kann die Wirkung euphorisierend anstatt sedierend sein, wie es eigentlich bei einem Schlafmittel zu erwarten wäre. Mögliche Symptome einer Methaqualon-Überdosis sind Magen-Darm-Beschwerden, Benommenheit, Ataxie, Kribbeln, langsame, undeutliche Sprache und Muskelhyperaktivität, innere Blutungen, Konvulsionen, Koma.
Szenenamen und Darstellung in der Kunst[Bearbeiten | Quelltext bearbeiten]
Im Drogenslang ist Methaqualon teilweise als seven-one-fours, seventeen, oder lemmon 714 bekannt. Diese Bezeichnungen rühren von dem Lemmon 714-Aufdruck auf der Quaalude-Tablette her. Andere Bezeichnungen sind ludes (ebenfalls von Quaalude) oder einfach Mandrax nach dem gleichlautenden Handelsnamen. Unter dem Handelsnamen Mozambin wurde es von Falco in Ganz Wien besungen. Wegen der Größe der Tabletten war das Methaqualon in den frühen 1980er Jahren in New York auch als „Gorilla Biscuits“ bekannt, woher die Straight-Edge-Band Gorilla Biscuits ihren Namen hat. Quaaludes waren ein von der weiblichen Rockband The Runaways bevorzugtes Rauschmittel.[11] Ebenso werden sie im Film The Wolf of Wall Street (2013) mehrfach genannt und konsumiert, wobei auch die Nebenwirkungen dargestellt werden.
Die Wirkungen und unerwünschten Nebenwirkungen hat der Singer-Songwriter Shel Silverstein 1980 in seinem satirischen Lied Quaaludes Again beschrieben. Der Handelsname Quaalude wird darüber hinaus noch in David Bowies Liedern Time („…Quaaludes and red wine…“) sowie Rebel Rebel („…You got your cue line and a handful of ’ludes“) erwähnt. Im 1989 veröffentlichten Lied Wasted Rock Ranger von Great White heißt es: „I have bennies with the breakfast toast, Quaaludes with the evening roast“. (Mit "Bennies" sind Benzedrine gemeint.) 2020 veröffentlichten The Flaming Lips auf ihrem Album American Head das Lied At The Movies On Quaaludes.
Im Roman Neue Vahr Süd aus der Herr-Lehmann-Trilogie von Sven Regener täuscht die Hauptfigur Frank Lehmann mithilfe von Methaqualon/Mandrax und Alkohol einen Selbstmordversuch vor, um damit aus der Bundeswehr entlassen zu werden.[12]
Synthese[Bearbeiten | Quelltext bearbeiten]
Methaqualon kann durch die Kondensationsreaktion von N-Acetylanthranilsäure mit o-Toluidin in Toluol in Anwesenheit eines wasserentziehenden Reagenz wie zum Beispiel Phosphorylchlorid synthetisiert werden.[13] Aus diesem Grund unterliegt die Anthranilsäure der Grundstoffüberwachung.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Karow, Lang-Roth: Allgemeine und Spezielle Pharmakologie und Toxikologie. Eigenverlag, Köln 2004, OCLC 610616770.
- Zaheer Kacker: Synthesis of substituted 4-quinazolones. In: Journal of the Indian Chemistry Society. Band 28, 1951. S. 344 (Synthese).
- R. Bonnichsen, R. Dimberg, Y. Mårde, R. Ryhage: Variations in human metabolism of methaqualone given in therapeutic doses and in overdose cases studied by gas chromatography-mass spectrometry. In: Clinica Chimica Acta. Band 60, Nr. 1, 1975, S. 67–75, doi:10.1016/0009-8981(75)90181-3 (Metabolismus).
- Edwin I. Goldenthal: A compilation of LD50 values in newborn and adult animals. In: Toxicology and Applied Pharmacology. Band 18, Nr. 1, 1971, S. 185–207, doi:10.1016/0041-008X(71)90328-0 (Toxizität).
- Dahyabhai M. Patel, Anthony J. Visalli, Jerome J. Zalipsky, Nelson H. Reavey-Cantwell: Methaqualone. In: Analytical Profiles of Drug Substances. Band 4, 1975, S. 245–267, doi:10.1016/S0099-5428(08)60016-7 (ausführliche Beschreibung).
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Methaqualon. In: Erowid. (englisch)
- drugaware.co.za Informationen zum Methaqualonmissbrauch in Südafrika (englisch)
- drugaware.co.za Photos illegaler Methaqualontabletten aus Südafrika (englisch)
- Quaaludes Again Satirisches Lied von Shel Silverstein
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Eintrag zu Methaqualone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c d e f Eintrag zu Methaqualon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2019.
- ↑ a b Datenblatt Methaqualone hydrochloride bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- ↑ Etienne F. van Zyl: A survey of reported synthesis of methaqualone and some positional and structural isomers. In: Forensic Science International 122 (2001), S. 142–149, doi:10.1016/S0379-0738(01)00484-4.
- ↑ Neue Enthüllungen Bill Cosby machte Frau mit Drogen gefügig. In: Frankfurter Allgemeine Zeitung. 7. Juli 2015 (faz.net [abgerufen am 7. Juli 2015]).
- ↑ Beruhigungsmittel: Bill Cosby machte Frau mit Medikamenten gefügig. In: Zeit Online. 7. Juli 2015, abgerufen am 2. März 2017.
- ↑ Hammer H, Bader BM, Ehnert C, Bundgaard C, Bunch L, Hoestgaard-Jensen K, Schroeder OH, Bastlund JF, Gramowski-Voß A, Jensen AA: A Multifaceted GABAA Receptor Modulator: Functional Properties and Mechanism of Action of the Sedative-Hypnotic and Recreational Drug Methaqualone (Quaalude). In: Molecular Pharmacology. 88. Jahrgang, Nr. 2, 2015, S. 401–20, doi:10.1124/mol.115.099291, PMID 26056160.
- ↑ a b Prost F, Thormann W: Enantiomeric analysis of the five major monohydroxylated metabolites of methaqualone in human urine by chiral capillary electrophoresis. In: Electrophoresis. 22. Jahrgang, Nr. 15, 2001, S. 3270–3280, doi:10.1002/1522-2683(200109)22:15<3270::AID-ELPS3270>3.0.CO;2-K, PMID 11589290. Weitere Referenzen dort.
- ↑ Prost F, Thormann W: Assessment of the stereoselective metabolism of methaqualone in man by capillary electrophoresis. In: Electrophoresis. 24. Jahrgang, Nr. 15, 2003, S. 2598–607, doi:10.1002/elps.200305512, PMID 12900872.
- ↑ Autobiografie „Bekenntnisse“ | Das wilde Leben der Nina Hagen, zuletzt abgerufen 13. Januar 2014.
- ↑ Audiokommentar von Schauspielerin Kristen Stewart, Rockmusikerin Joan Jett und Schauspielerin Dakota Fanning, enthalten im Bonusmaterial der Blu-ray Disc The Runaways, Regie: Floria Sigismondi, 2010, River Road Entertainment, Los Angeles + Capelight Pictures OHG, Ahrensfelde + Summit Entertainment, Universal City, Kalifornien
- ↑ Sven Regener: Neue Vahr Süd, Band 2 von Die Lehmann-Trilogie, Bastei Lübbe, 2015, ISBN 3-73257-574-8, S. 304ff.
- ↑ Patent GB843073: 2-methyl-3-orthotolyl-4-quinazolone and acid addition salts thereof. Veröffentlicht am 4. August 1960, Anmelder: Laboratoires Toraude.