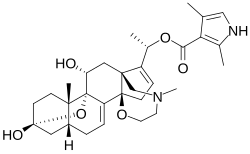
سمين ضفدعي

| سمين ضفدعي | |
|---|---|
| أسماء أخرى | |
3α,9α-epoxy-14β,18-(2′-oxyethyl-N-methylamino)-5β-pregna-7,16-diene-3β,11α,20α-triol 20α-2,4-dimethylpyrrole-3-carboxylate | |
| المعرفات | |
| رقم CAS | 23509-16-2 |
| بوب كيم (PubChem) | 31958 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C=31 H=42 N=2 O=6 |
| الكثافة | 1.304 g/mL [3] |
| الذوبانية في الماء | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
السمين الضفدعي أو البتراكوتوكسين (بالإنجليزية: Batrachotoxin) أو اختصارا BTX، هي مادة شبه قلوية ستيرويدية شديدة السمية، تنتجها بعض أنواع الضفادع في أمريكا الجنوبية، بالإضافة إلى حشرات من فصيلة الخنافس الزهور ذات الأجنحة الناعمة وبعض طيور غينيا الجديدة. اسمد مصطلح بتراكوتوكسين اسمه من الكلمتين اليونانيتين القديمتين «بتراكوس» (βάτραχος) التي تعني ضفدع، و«توكسيكون» (τοξικόν) التي تعني السم، وتعني مجتمعة «سم الضفدع».[4] سمي هذا المركب بهذا الاسم نسبة للحيوان الذي تم اكتشافه عليه، وهو ضفدع Phyllobates aurotaenia، الذي وصف لأول مرة في سنة 1913 على يد عالم الحيوان جيورج بولنجر.
تاريخ[عدل]
سمي البتراكوتوكسين بهذا الاسم على يد الكيميائيين الأمريكيين جون وليام دالي وبيرنهارد فيتكوب، اللذين قامو بفصل الأجزاء الشبه القلوية الشديدة السمية وحددوا خصائصها الكيميائية. حيث عزلوا فعليا أربعة من القلويدات ستيرويدية سامة رئيسية، تشمل كلا من: البتراكوتوكسين، والإزوبتراكوتوكسين، والبسودوبتراكوتوكسين إضافة إلى البتراكوتوكسينين إي.[5] بسبب صعوبة التعامل مع مثل هذا السم القوي والمقدار الضئيل الذي يمكن جمعه، تضمنت عملية التحديد الكامل لبنيته العديد من الصعوبات. مع ذلك، نجح تاكاشي توكوياما، الذي التحق بالبحث في وقت لاحق، في تحويل أحد المركبات المتجانسة التي هي البتراكوتوكسينين إي إلى مشتق بلوري، تم حل تركيبته الفريدة من نوعها بحلول سنة 1968 باستعمال و تقنيات حيود الأشعة السينية.[6] عندما تمت مقارنة الطيف الكتلي وطيف الرنين المغناطيسي النووي للبتراكوتوكسين ومشتقات البتراكوتوكسينين إي، تم إدراك أن الاثنين يتشاركان في نفس البنية الستيرويدية وأن البتراكوتوكسين كان هو البتراكوتوكسينين إي نفسه مع جزء إضافي واحد من البيرول المرفقة. في الواقع، كان البتراكوتوكسين قادرا على التحلل جزئيا باستخدام هيدروكسيد الصوديوم إلى مادة ذات استشراب لوني بالطبقة الرقيقة و تفاعلات لون متطابقة مثل البتراكوتوكسينين إي.[5] بحلول سنة 1969 تم بناء بنية البتراكوتوكسين من خلال إعادة التركيب الكيميائي لكلتا الشظيتين.[5] في حين تم تركيب البتراكوتوكسينين إي من قبل ميشيو كورسو، ولاورانس مارسين، وتيموثي غرينستيانر، ويوشيتو كيشي بحلول سنة 1998.[7]
آلية العمل[عدل]
يقتل البتراكوتوكسين عن طريق منع انتقال الإشارات العصبية إلى العضلات بشكل دائم. ذلك لأن البتراكوتوكسين هو في الواقع لجين لقنوات الصوديوم الغشائية المتواجدة على مستوى القلب والجهاز العصبي المركزي. يودي وجوده بالتالي إلى منع إفراز أيونات كلوريد الصوديوم في تجويف الخلايا الظهارية لهذه الأعضاء.
وفقا لتجارب أجريت على قوارض، تقدر الجرعة المتوسطة المحقون تحت الجلد التي يمكن أن تكون قاتلة بحوالي 2 ميكروغرام من السمين الضفدعي لكل كغ.[8] في المقابل تصل الجرعة المتوسطة القاتلة من البتراكوتوكسينين إي، وهو منتج ثانوي إلى حوالي 1000 ميكروغرام لكل كغ.[5]
يتم إفراز السم على شكل سائل عديم اللون أو حليبي من غدد تقع على ظهر وخلف آذان الضفادع من جنس Phyllobates.
للبتراكوتوكسين تأثير مباشر على الجهاز العصبي المحيطي. حيث يؤدي وجوده على مستوى الجهاز العصبي المحيطي إلى زيادة نفاذية (انتقائية وغير قابلة للعكس) غشاء الخلية المستريحة لأيونات الصوديوم، بدون تغيير في تركيز البوتاسيوم والكالسيوم. يعمل تدفق الصوديوم هذا على إزالة استقطاب غشاء الخلية المستقطب سابقا. كما بعمل أيضا على تغيير انتقائية القنوات الأيونية، عن طريق زيادة نفاذية القناة للكاتيونات الأكبر. تصبح قنوات الصوديوم الحساسة للجهد نشطة باستمرار للجهد الكامن للغشاء.
بارتباط الباتراكوتوكسين، تفتح بشكل لا رجعة فيه قنوات الصوديوم الغشائية للخلايا العصبية ويمنعها من الإغلاق. بعبارة أخرى، يرتبط السمين بقناة الصوديوم ويبقي الغشاء نافذا على أيونات الصوديوم.[9] نتيجة لذلك، لا يعود بإمكان الخلية العصبية (العصبون) إرسال إشارات، الشئ الذي يؤدي إلى الشلل.
على الرغم من تصنيفه بشكل عام على أنه سم عصبي، إلا أن للبتراكتوكسين تأثير ملحوظ على عضلات القلب. تكون هذه التأثيرات مشابهة للتأثيرات السمية التي تحدث للقلب بسبب عقار الديجيتاليس (الديجوكسين)، وهو السم الموجود في نبات ديجيتال. يتداخل الباتراكوتوكسين مع التوصيل القلبي، مسببا اضطرابات في نبض القلب، وانقباضات بطينية سابقة لأوانها، والرجفان البطيني وغيرها، تؤدي في نهاية المطاف إلى توقف القلب. يحرض البتراكتوكسين على تحرير الأستيل كولين بغزارة في الأعصاب والعضلات وتدمير الحويصلات التشابكة.
ترجع التغيرات البنيوية الحاصلة على مستوى الأعصاب والعضلات بالأساس إلى التدفق الهائل لأيونات الصوديوم، التي تنتج تعديلات تناضحية على مستوى الغشاء. هذا واقترح أيضا أن ذلك قد يكون له علاقة بتأثير آخر على الجهاز العصبي المركزي، على الرغم من أنه ليس من المعروف حاليا حصول مثل هذا التأثير.
يعتمد نشاط البتراكوتوكسين على درجة الحرارة، مع أقصى قدر من النشاط عند حرارة 37 درجة مئوية (99 درجة فهرنهايت). كما أن نشاطه يصبح أسرع في ظل درجة الحموضة القلوية، لذلك فالشكل غير المبرتن قد يكون عادة الأكثر نشاطا.
العلاج[عدل]
حاليا، لا وجود لأي ترياق فعال لعلاج التسمم بالبتراكوتوكسين. الفيراتريدين والأقونيطين والغريانوتوكسين شانها شأن البتراكوتوكسين، هي كلها سموم قابلة للذوبان في الدهون لها موقع عمل مشترك، حيث تعمل بشكل مماثل على تبديل الانتقائية الأيونية لقنوات الصوديوم. بسبب هذه التشابهات، يمكن لعلاج التسمم بالبتراكوتوكسين أن يكون مبنيا على علاج أي من هذه السموم. كما يمكن أن يكون مبنيا على شاكلة علاج التسمم بالديجيتاليس، الذي ينتج عنه آثار مسممة للقلب مشابهة إلى حد ما.
بالرغم من عدم وجود ترياق، إلا أنه يمكن منع استقطاب الغشاء أو عكسه إما بواسطة التيدرودوتاكسين (من السمكة الينفوخية) الذي هوهو مثبط غير تنافسي، أو ال[[ساكسيتكسين المد الأحمر. كلاهما له تأثيرات معادية لتلك التي يقوم بها البتراكوتوكسين على تدفق الصوديوم. في المقابل قد تلعب بعض العقاقير المخدرة دور مستقبلات مناهضة لتأثير هذا السم الشبه قلوي، في حين أن بعض مواد التخدير الموضعية الأخرى يمكنها منع جملة نشاطته من خلال العمل كمناهضات تنافسية.
انظر أيضا[عدل]
مراجع[عدل]
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Dumbacher JP; Spande TF; Daly JW (1 Nov 2000). "Batrachotoxin alkaloids from passerine birds: a second toxic bird genus (Ifrita kowaldi) from New Guinea". Proceedings of the National Academy of Sciences of the United States of America (بالإنجليزية). 97 (24): 12970–12975. Bibcode:2000PNAS...9712970D. DOI:10.1073/PNAS.200346897. ISSN:0027-8424. PMC:27162. PMID:11035772. QID:Q33921856.
- ^ Daly, J. W.; Journal of the American Chemical Society 1965, V87(1), P124-6 CAPLUS
- ^ (Bailly 1901)
- ^ أ ب ت ث Tokuyama, T.؛ Daly, J.؛ Witkop, B. (1969). "Structure of Batrachotoxin, a steroidal alkaloid from the Colombian arrow poison frog, Phyllobates aurotaenia, and partial synthesis of Batrachotoxin and its analogs and homologs". J. Am. Chem. Soc. ج. 91 ع. 14: 3931–3933. DOI:10.1021/ja01042a042.
- ^ Tokuyama, T.؛ Daly, J.؛ Witkop, B.؛ Karle, I. L.؛ Karle, J. (1968). "The structure of Batrachotoxinin A, a novel steroidal alkaloid from the Columbian arrow poison frog, Phyllobates aurotaenia". J. Am. Chem. Soc. ج. 90 ع. 7: 1917–1918. DOI:10.1021/ja01009a052.
- ^ Kurosu, M.؛ Marcin, L. R.؛ Grinsteiner, T. J.؛ Kishi, Y. (1998). "Total Synthesis of (±)-Batrachotoxinin A". J. Am. Chem. Soc. ج. 120 ع. 26: 6627–6628. DOI:10.1021/ja981258g.
- ^ Tokuyama, T.؛ Daly, J.؛ Witkop, B. (1969). "The structure of batrachotoxin, a steroidal alkaloid from the Colombian arrow poison frog, Phyllobates aurotaenia, and partial synthesis of batrachotoxin and its analogs and homologs". J. Am. Chem. Soc. ج. 91 ع. 14: 3931–3938. DOI:10.1021/ja01009a052.
- ^ Wang, S. Y.؛ Tikhonov, Denis B.؛ Mitchell, Jane؛ Zhorov, Boris S.؛ Wang, Ging Kuo (2007). "Irreversible Block of Cardiac Mutant Na+ Channels by Batrachotoxin Channels". Channels. ج. 1 ع. 3.
| في كومنز صور وملفات عن: سمين ضفدعي |