كوبالت

| |||||||||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي | |||||||||||||||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | كوبالت، 27، Co | ||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | ||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 9، 4، d | ||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 58.933195 غ·مول−1 | ||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d7 4s2] | ||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 15, 2 (صورة) | ||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 8.90 غ·سم−3 | ||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 7.75 غ·سم−3 | ||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1768 ك، 1495 °س، 2723 °ف | ||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3200 ك، 2927 °س، 5301 °ف | ||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 16.06 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 377 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 24.81 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 5, 4 , 3, 2, 1, -1[1] (أكاسيده مذبذبة) | ||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.88 (مقياس باولنغ) | ||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 760.4 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||
| الثاني: 1648 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||
| الثالث: 3232 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 125 بيكومتر | ||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | (لف مغزلي منخفض) 126±3 ، (لف مغزلي مرتفع) 150±7 بيكومتر | ||||||||||||||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري سداسي | ||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية حديدية | ||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 62.4 نانوأوم·متر (20 °س) | ||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 100 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 13.0 ميكرومتر·متر−1·كلفن−1 (25 °س) | ||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 4720 متر/ثانية (20 °س) | ||||||||||||||||||||||||||||||||||||
| معامل يونغ | 209 غيغاباسكال | ||||||||||||||||||||||||||||||||||||
| معامل القص | 75 غيغاباسكال | ||||||||||||||||||||||||||||||||||||
| معامل الحجم | 180 غيغاباسكال | ||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.31 | ||||||||||||||||||||||||||||||||||||
| صلادة موس | 5.0 | ||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 1043 ميغاباسكال | ||||||||||||||||||||||||||||||||||||
| صلادة برينل | 700 ميغاباسكال | ||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-48-4 | ||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الكوبالت | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
الكوبالت [ملاحظة 1] عنصرٌ كيميائي رمزه Co وعدده الذرّي 27، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة التاسعة في الجدول الدوري؛ ويصنّف كيميائياً ضمن الفلزّات الانتقالية. يوجد الكوبالت في الطبيعة غالباً في القشرة الأرضية مرتبطاً مع عناصر كيميائية أخرى ضمن معادن مختلفة، ولا يوجد في شكله الطبيعي الحرّ؛ ولكن عند استحصاله في الحالة النقيّة يكون الكوبالت على هيئة فلزّ رمادي فضّي برّاق. للكوبالت نظيرٌ مستقرّ وحيد، وهو كوبالت-59؛ كما يوجد له نظير مشعّ مهمّ، وهو كوبالت-60، والذي يُستخدَم على هيئة قائفة مشعّة، ومن أجل إنتاج أشعّة غامّا مرتفعة الطاقة.
يمكن استحصال الكوبالت بشكل مباشر من خاماته؛ ولكن عادةً ما يُستحصَل على هيئة ناتجٍ إضافيٍّ من عمليّات تعدين النحاس أو النيكل. توجد توضّعات رسوبية كبيرة من خامات الكوبالت في أفريقيا، وخاصّةً في جمهورية الكونغو الديمقراطية، والتي تساهم تقديرياً بما نسبته 50% من الإنتاج العالمي لهذا الفلز. عُرِفَ خضاب أزرق الكوبالت منذ القدم، واستُخدَم في مجال صناعة الخُضُب وتلوين الزجاج؛ أمّا في الوقت الحالي فيُستخدَم الكوبالت بشكلٍ كبيرٍ في مجال صناعة بطّاريات أيونات الليثيوم وفي مجال صناعة السبائك.
يعدّ الكوبالامين (فيتامين بي 12) المثال الأشهر على دخول الكوبالت في المركبات الحيوية، وهو فيتامين أساسي لجميع الحيوانات؛ كما يصنّف الكوبالت في شكله اللاعضوي ضمن المغذّيات الدقيقة بالنسبة للبكتيريا والطحالب والفطريات.
التاريخ وأصل التسمية[عدل]
استُخدمت مركّبات الكوبالت لعدّة قرونٍ لإضفاء لونٍ أزرقٍ غنيٍّ على الزجاج والمينا والخزف. اكتُشِفَ عنصر الكوبالت في المنحوتات المصريّة، وفي المجوهرات الفارسيّة من الألفية الثالثة قبل الميلاد، وفي أطلال مدينة بومبي، التي دُمّرت في سنة 79 للميلاد؛ وكذلك في الصين، والتي يرجع تاريخ القطع الأثرية الحاوية على الكوبالت فيها إلى سُلالَتي تانغ (618-907 م) ومينغ (1368–1644 م) الحاكِمَتين.[2]

استُخدِمَ الكوبالت في تلوين الزجاج منذ العصر البرونزي؛ وقد أسفرت عمليّة استخراج حطام السفينة أولوبورون [ط 1] عن اكتشاف صبّة من زجاج أزرق مصنّعة خلال القرن الرابع عشر قبل الميلاد.[3][4] كان الزجاج الأزرق من مصرَ ملوّناً إمّا باستخدام النحاس أو الحديد أو الكوبالت. تعود أقدم نماذج الزجاج الملوّنة بالكوبالت إلى الأسرة المصرية الثامنة عشر (1550-1292 قبل الميلاد)؛ ولا يزال مصدر الكوبالت الذي استخدمه المصريون غيرَ معروف.[5][6]
اشتُقّت تسمية الكوبالت من كلمة «kobalt» الألمانية، والآتية من كلمة كوبولد [ط 2]، وهو مسمّى لكائنات خيالية في الأساطير الجرمانية، من ضمنها أقزام غوبْلِن [ط 3]، وقد انتشر استخدام ذلك المصطلح الخرافي بين عمّال المناجم إشارةً إلى خامات الكوبالت؛ إذ إنّ المحاولات الأولى من أجل صهرها لم تعطِ فلزّاتٍ مثل النحاس أو النيكل، إنّما أسفرت ببساطة عن مسحوقٍ من أكسيد الكوبالت بدلاً من ذلك. ونظراً لأنّ الخامات الأساسية للكوبالت تحتوي دائماً على الزرنيخ، فإنّ صهر الخام سيؤدّي إلى أكسدة الزرنيخ إلى أكسيد الزرنيخيك السامّ والمتطاير؛ ممّا أدّى إلى انتشار صيت ذلك الخام.[7]
يُنسَب الفضل في اكتشاف الكوبالت إلى الكيميائي غيورغ براندت [ط 4] (1694-1768) قرابة سنة 1735، والذي وضّح أنّه فلزّ غير معروف سابقاً باختلافه عن البزموت والفلزّات التقليدية الأخرى؛ ووصفه براندت بأنّه شبه فلز.[ملاحظة 2][8] وبيّن أنّ مركّبات الكوبالت كانت مصدر اللون الأزرق في الزجاج، والذي كان يُنسب في السابق إلى البزموت الموجود مع الكوبالت. بذلك أصبح الكوبالت أوّل فلزّ يُعلَن عن اكتشافه منذ فترة ما قبل التاريخ؛ إذ أنّ جميع الفلزّات الأخرى المعروفة آنذاك (الحديد والنحاس والفضّة والذهب والزنك والزئبق والقصدير والرصاص والبزموت) لم تُنسَب إلى مكتَشِفين محدَّدِين.[9] ساهمت جهود وأبحاث توربرن برغمان [ط 5] في دعم فكرة أنّ الكوبالت هو عنصرٌ جديدٌ بالفعل.[10]
تعدّ صناعة الخُضُب من أقدم تطبيقات الكوبالت ومركّباته، فقد استُخدِمَ أزرق الكوبالت منذ القدم في تلوين الأواني؛ كما استُخدمَت مركّبات الكوبالت في تلوين الرسومات وخاصّةً في القَرنين الثامن عشر والتاسع عشر. ففي سنة 1780 اكتشف سفن رينمان [ط 6] خضاب أخضر الكوبالت [ط 7]؛ وفي سنة 1802 اكتشف لوي جاك تينار [ط 8] خضاب أزرق الكوبالت [ط 9] (المعروف أيضاً باسم «الإِسْمَلت» [ط 10]؛[de 1] وفي سنة 1848 اكتشف نيكولاوس فولفغانغ فيشر [ط 11] خضاب أصفر الكوبالت.[de 2] وخلال القرن التاسع عشر انتشرت التجارة في الدول الأوربية بتلك الخُضُب، مثل الزعفر [ط 12] (وهو خضاب أزرق يُستحصَل من تحميص خام الكوبالت)؛ وكذلك بمسحوق زجاج الكوبالت الأزرق ؛ وتركّزت صناعة تلك المواد في موقع بلافارفيفيركت [ط 13] في بلدية مودوم النرويجية.[11][12] انخفض تعدين هذا الفلزّ في أوروبا بعد اكتشاف خام الكوبالت في مناطق مختلفة من العالم، مثل مجموعة جزر كاليدونيا الجديدة في المحيط الهادي ومقاطعة أونتاريو الكندية، وكذلك خاصّةً في محافظة كاتانغا في جمهورية الكونغو الديمقراطية.[7] رغم اندلاع النزاعات في جمهورية الكونغو الديمقراطية سنة 1978 أثناء حرب شابا الثانية [ط 14]، إلّا أنّ ذلك لم يكن له كبير الأثر على الاقتصاد العالمي حينها؛ خاصّةً بعد تطوير طرائق فعّالة لإعادة تدوير مواد الكوبالت؛ ومع الانتقال إلى استخدام بدائل خالية من الكوبالت.[13][14]
في سنة 1938 اكتشف جون ليفينغود [ط 15] بمرافقة غلين سيبورغ [ط 16] النظير المشعّ كوبالت-60؛[15] ووَجد له تطبيقات في أبحاث أجريت في جامعة كولومبيا في خمسينيات القرن العشرين عن خاصّية التكافؤ في اضمحلال بيتّا المُشعّ.[16][17]
الوفرة الطبيعية[عدل]

يتخلّق الكوبالت بشكله الثابت في الكون داخل المُستعِرَات العظمى من خلال عملية التقاط النيوترون السريعة [ط 17].[18] غالباً ما يترافق الكوبالت في الطبيعة مع النيكل، وكلاهما داخلٌ في تركيب الحديد النيزكي، على الرغم من أنّ الكوبالت أقلّ وفرةً في النيازك الحديدية من النيكل.[19] غالباً ما يترافق الكوبالت أيضاً مع النيكل في الخامات الأرضية، وكلاهما من العناصر المحبّة للحديد [ط 18] وفقاً لتصنيف غولدشميت [ط 19]، ويكثُر وجودها في طبقات الصخور النارية.
في الغلاف الصخري[عدل]
يعدّ الكوبالت من العناصر قليلة الوفرة نسبياً في القشرة الأرضية، وتتراوح كمّيّته فيها قرابة 0.004% وزناً.[de 3] من الصعب العثور على فلزّ الكوبالت بشكله العنصري الحرّ في الطبيعة؛ وهو غالباً ما يوجد على هيئة مركّبات كيميائية، خاصّةً مع الكبريت والزرنيخ، داخل المعادن المختلفة. من الأمثلة على تلك المعادن كلّ من الكوبالتيت [ط 20] والسافلوريت [ط 21] والغلاوكودوت [ط 22] والسيغينيت [ط 23] والسكوتيروديت [ط 24]؛[de 4] بالإضافة إلى معدن الكاتيريت [ط 25] وهو معدن كبريتيدي له بنية تشبه بنية البيريت [ط 26]، ويرافق معدن الفايسيت الحاوي على النيكل، وينتشر في مواقع تعدين النحاس في محافظة كاتانغا الكونغولوية.[20] عادةً ما يكون محتوى الكوبالت في المعادن الكبريتيدية ضئيلاً، وهو يتراوح بين 0.1 إلى 0.3%.[de 5] عندما تصل معادن الكوبالت الكبريتيدية السطح، وتكون على تماسٍ مع الغلاف الجوّي، فإنّها تتأثّر بعملية التجوية، إذ تتأكسد وتعطي شكلاً ثانوياً ذا لون أحمر وردي من معدن الإريثريت [ملاحظة 3] ومن معدن السفيروكوبالتيت [ط 27].[21][22]
في الغلاف المائي[عدل]
يوجد الكوبالت في مياه المحيطات، نظراً لمساهمته على هيئة فلز نزر في عمليّة التركيب الضوئي وفي عمليات تثبيت النتروجين، ولكونه من المغذّيات الصغرى للعوالق النباتية [ط 28] والبكتيريا الزرقاء [ط 29].[23][24] يكون تركيز الكوبالت المنحلّ قليلاً في الطبقات القريبة من السطح، ومثلما هو الحال مع المنغنيز والحديد فإنّ الامتصاص الحيوي [ط 30] للكوبالت مبنيٌّ على المساهمة في عمليات التركيب الضوئي القريبة من السطح، وعلى الاقتيات [ط 31] في أعماق المحيطات، على الرغم من أنّ أغلب عمليات اقتيات الكوبالت محدّدة بوجود بنىً معقّدةً من الرُبَيطات العضويّة.[25][26]
يعود مصدر الكوبالت في المحيطات بشكلٍ كبيرٍ إلى مصادرَ خارجيّةٍ من الأنهار التي تصبّ في المحيطات ومن عمليّات الصرف السطحي على اليابسة [ط 32]، بالإضافة إلى مصادرَ داخلية من المنافس المائية الحرارية [ط 33].[27] توجد مصادر الكوبالت في أعماق المحيطات في الغالب بالقرب من الجبال البحرية حيث تَكنُسُ التيّارات المحيطية قاع المحيطات وتتراكم بقربها الرواسب.[28] من المناطق البحرية التي يُتوقّع أن يكون فيها ترسّبات كبيرة من الكوبالت منطقة تصدّع كليبرتون [ط 34] في قاع المحيط الهادي، ممّا قد يفتح المجال لعمليّات تعدينٍ في قاع البحر.[29] على العموم، فإنّ تركيز الكوبالت المنحلّ في مياه المحيطات ضئيلٌ نسبياً، ووجدت بعض النماذج في بعض المناطق حيث يرتفع تركيز الكوبالت المنحلّ مع انخفاض تركيز الأكسجين المنحلّ،[30] مثلما هو الحال في جنوبيّ المحيط الأطلسي.[27]
الاستخراج[عدل]
| البلد | الإنتاج | الاحتياطي |
|---|---|---|
| 64,000 | 3,500,000 | |
| 5,600 | 250,000 | |
| 5,000 | 1,200,000 | |
| 4,300 | 250,000 | |
| 4,200 | 500,000 | |
| 4,000 | 280,000 | |
| 3,800 | 150,000 | |
| 3,200 | 51,000 | |
| 2,900 | 270,000 | |
| 2,800 | - | |
| 2,500 | 29,000 | |
| 1,500 | ||
| 650 | 23,000 | |
| دول أخرى | 5,900 | 560,000 |
| الإجمالي العالمي | 110,000 | 7,100,000 |

عادةً ما يُستخرَج الكوبالت من المواقع الغنيّة بخامات النحاس والنيكل. تُقدِّر هيئة المساحة الجيولوجية الأمريكية [ط 35] الاحتياطيَّ العالميَّ من الكوبالت بمقدار 7 ملايين طنّ متري.[32] تُنتِج جمهورية الكونغو الديمقراطية حاليّاً قرابة 63% من الكوبالت في العالم. قد تصل هذه الحصّة السوقية إلى 73% بحلول سنة 2025؛ ووفق تقديرات مالية قد يكون الطلب العالمي بحلول عام 2030 أكثر بقرابة 47 مرّة ممّا كان عليه في سنة 2017.

يعدّ خام الكوبالت من الخامات الإستراتيجية؛[33] وقد ازداد الطلب العالميّ عليه بشكلٍ متصاعدٍ منذ القرن العشرين، وشهد ذلك الطلب ارتفاعاً ملحوظاً منذ بدايات القرن الحادي والعشرين مع ازدياد النزعة إلى تطوير بطّاريات السيّارات الكهربائية.[34] بلغ سعر الطنّ المتري الواحد من الكوبالت زهاء 20 ألف دولار أمريكي في سنة 2015، وقفزَ إلى ما يقارب 100 ألف دولار أمريكي في سنة 2018، ليهبط إلى ما يقارب 50 ألف دولار أمريكي في سنة 2021. من الدول الغنيّة بخامات الكوبالت والرائدة في إنتاجه بالإضافة إلى جمهورية الكونغو الديمقراطية كلّ من أستراليا وكندا وروسيا وزامبيا ومدغشقر وكوبا والفلبين.
إنّ جمهورية الكونغو الديموقراطية رائدةٌ على مستوى العالم في إنتاج الكوبالت وفي الاحتياطي الغنيّ من خاماته،[35] خاصّةً في مناطق استخراج النحاس في محافظة كاتانغا [ط 36]، والتي تحوي وفق تقديرات هيئة المساحة الجيولوجية البريطانية [ط 37] سنة 2009 على قرابة 40% من الاحتياطي العالمي من هذا الفلزّ.[36] ازداد إنتاج الكوبالت في جمهورية الكونغو الديموقراطية بعد انتهاء الحَربين الأهليّتين فيها، الأولى والثانية، مطلع القرن الحادي والعشرين؛ كما جرى تقديم تسهيلات تنظيمية للتعدين في أراضيها منذ سنة 2003، ممّا دفع شركات التعدين مثل جلينكور [ط 38] إلى الاستثمار في إنشاء مناجم في عددٍ من المواقع في محافظة كاتانغا،[37] مثل منجم موتاندا [ط 39]، والذي أغلق أواخر سنة 2019.[38] بالإضافة إلى شركة الاستكشاف والتعدين في وسط أفريقيا [ط 40] المُستمَلكة من شركة مؤسسة الموارد الطبيعية الأوراسية [ط 41]، والمسؤولة عن إدارة منجم موكوندو [ط 42] الغنيّ بخام الكوبالت.[39] ولكن مع ذلك، لا زالت مواقع استخراج الكوبالت في جمهورية الكونغو الديموقراطية خاضعةً لتقلّبات وصراعات جيوسياسية وإقليمية.[13]
من جهةٍ أخرى، تساهم عمليّات التعدين على النطاق الصغير [ط 43] في نسبةٍ تتراوح بين 17-40% من إنتاج الكوبالت في جمهورية الكونغو الديموقراطية.[40] إذ يُستخدَم نحو 100 ألف من عمّال المناجم وسائل بدائية يدوية من أجل الحفر؛ كما يساهم نقص احتياطات السلامة بشكلٍ متكرّرٍ إلى حدوث إصابات أو وفيّات؛ كما لوحظ ضَعفٌ في التخطيط والتنظيم لعمليّات التعدين، بالإضافة إلى تعريض الحياة البرّية والسكان الأصليّين إلى مخاطرَ بيئيّة.[41] نشرت تقارير حقوقية وصحفيّة استقصائيّة عديدة عن الظروف المحيطة في استخراج الكوبالت في هذه الدولة الإفريقية؛[42] وخاصّةً فيما يتعلّق باستغلال عمالة الأطفال في عمليّات التعدين البدائية.[40][43] ركّزت تلك التقارير على التجاوزات التي كانت تحدث في مناطق التعدين البدائية التابعة لشركة كونغو دونغ فانغ [ط 44] التابعة لشركة جيجيانغ هوايو كوبالت [ط 45] الصينية، وهي واحدةٌ من أكبر مُوَرّدي الكوبالت في العالم؛ الأمر الذي دفع شركاتٍ كبرى إلى اتخاذ إجراءات لضبط التعامل معها، مثل شركة أبّل [ط 46]؛[44] وشركة إل جي للكيماويات [ط 47].[45]
الإنتاج[عدل]

يُستحصَل على الكوبالت غالباً من عمليّات صهر واختزال النواتج الثانوية المستخرَجة من تعدين النيكل والنحاس.[46][47] بالمقابل، يوجد عددٌ من الخامات الحاوية على الكوبالت بشكلٍ رئيسي، من ضمنها الكوبالتيت والإريثريت والسكوتيروديت والغلاوكودوت؛[48] وتكثر تلك الخامات في الصخر فوق المافي [ط 48]، كما هو الحال في منطقة بو وازار المنجمية في المغرب. في تلك المواقع، يُستحصَل على خام الكوبالت بشكل حصري، بالرغم من انخفاض التركيز، ممّا يتطلّب إجراء عمليات تعدين باطنية أكثر من أجل استخراج هذا الفلز.[49]
ينبغي فصل الكوبالت عن المكوّنات المرافقة في الخام في عمليّات الاستحصال غير المباشر، وتوجد طرائق عديدة لإنجاز هذا الأمر، وذلك يعتمد على تركيز الكوبالت وعلى تركيب الخام؛ من إحدى تلك الطرائق التعويم الرغاوي [ط 49]، حيث ترتبط المؤثّرات السطحية إلى مكوّنات الخامة، ممّا يؤدّي إلى تخصيب خامات الكوبالت. في البداية يُفصَل الحديد جزئياً بإجراء عملية تحميص للخام، ممّا يؤدّي إلى أكسدة كبريتيدات الحديد المرافقة (FeS و FeS2) إلى أكسيد الحديد الثلاثي، والذي يضاف إليه ثنائي أكسيد السيليكون للحصول على خَبَث [ط 50] من سيليكات الحديد. بعد التحميص يُستحصَل على خامٍ يحوي بالإضافة إلى الكوبالت على النيكل والنحاس والجزء المتبقّي من الحديد، وذلك على هيئة كبريتيدات أو زرنيخيدات. يؤدّي التحميص اللاحق بوجود الأكسجين، وإجراء التصويل مع الماء إلى استخلاص الكبريتات بشكلٍ مرافقٍ مع الزرنيخات؛ والتي تترُك وراءها مجموعةً من أكاسيد الفلزّات الموجودة، والتي تعالَج بحمض الكبريتيك، ممّا يؤدّي إلى فصل النحاس على هيئة كبريتات النحاس، في حين يبقى الكوبالت والنيكل والحديد في المحلول.

تؤدّي إضافة كلور الكلس (وهو مزيجٌ من هيبوكلوريت الكالسيوم وكلوريد الكالسيوم وهيدروكسيد الكالسيوم) إلى اسخلاص الكوبالت بشكلٍ انتقائيٍّ من الوسط على هيئة هيدروكسيد الكوبالت الثنائي Co(OH)2، والذي يُحمّص للحصول على أكسيد الكوبالت الثنائي والثلاثي Co3O4؛ والذي يُختَزل باستخدام الألومنيوم وفق تفاعلٍ حراري [ط 51]، أو بالاختزال باستخدام الكربون (الفحم) في فرنٍ لافح [ط 52].[de 4]
بعد ذلك يُنقّى فلزّ الكوبالت المستحصَل باستخدام وسائل التحليل الكهربائي.
النظائر[عدل]

يُعرَف للكوبالت عددٌ من النظائر المعروفة، التي تتراوح أعدادها الكتلية بين 47 و77، من بينها نظيرٌ مستقرٌّ وحيدٌ وهو كوبالت-59 59Co، في حين أنّ باقي نظائر الكوبالت هي نظائر مشعّة؛ بالتالي فالكوبالت هو عنصرٌ أحاديُّ النُوَيْدَة.[50] أطول نظائر الكوبالت المشعّة عمراً هو النظير كوبالت-60 والذي يبلغ عمر النصف له مقدار 5.2714 سنة، يليه كوبالت-57 57Co بعمر نصف مقداره 271.8 يوم، ومن ثمّ كوبالت-56 56Co بعمر نصف مقدار 77.27 يوم، وكوبالت-58 58Co بعمر نصف مقداره 70.86 يوم. لباقي نظائر الكوبالت المشعّة أعمار نصف أقلّ من 18 ساعة، وأغلبها دون ثانية واحدة. كما يوجد هنالك مُصاوَغات نووية عديدة للكوبالت، وجميعها لها أعمار نصف أقلّ من 15 دقيقة. إنّ نمط الاضمحلال الأساسي لنظائر الكوبالت المشعّة التي لها عدد كتلة أقلّ من النظير المستقرّ كوبالت-59 يكون على شكل اصطياد إلكترون، متحوّلةً بذلك إلى نظائر الحديد الموافقة. بالمقابل، فإنّ نمط الاضمحلال لنظائر الكوبالت ذات أعداد الكتلة الأكبر من 59 فهو على شكل اضمحلال بيتّا، متحوّلةً بذلك إلى نظائر النيكل الموافقة.[50]
يضمحلّ النظير كوبالت-57 57Co إلى نظير الحديد-57 57Fe؛ ولهذا الاضمحلال تطبيقات عمليّة، وذلك في مطيافية موسباور [ط 53] للتمييز بين الحديد الثنائي والثلاثي؛ كما يستخدم في الوسم النظيري لامتصاص فيتامين بي 12 وفق اختبار شيلينغ [ط 54]؛[51] يعدّ النظير كوبالت-60 60Co من النظائر المعروفة للكوبالت، فهو نظيرٌ مشعٌّ أيضاً، ويبلغ عمر النصف له مقدار 5.27 سنة، ويُستحصَل من التنشيط النيوتروني للنظير كوبالت-59 59Co؛ وهو يضمحلّ إلى نظير النيكل 60Ni مع إصدار أشعّة غاما، ويُستخدَم لذلك في تعقيم [ط 55] وتشعيع الأغذية [ط 56]، وفي الاختبار الإشعاعي [ط 57]، وفي العلاج الإشعاعي بالكوبالت [ط 58]؛ كما استُخدِمَ نظير الكوبالت-60 في تجربة وُو [ط 59] للتحقّق من مبدأ انحفاظ التكافؤ الفيزيائي [ط 60].[16]
الخواص الفيزيائية[عدل]

يوجد الكوبالت في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلزّ ذي لون رمادي، وهو يُصنّف ضمن الفلزّات الثقيلة، إذ تبلغ كثافته مقدار 8.89 غ/سم3.[de 4] للكوبالت خواص مغناطيسية حديدية [ط 61]، وتبلغ قيمة درجة حرارة كوري [ط 62] مقدار 1150 °س؛[de 4][52] في حين أنّ العزم المغناطيسي [ط 63] مقداره 1.6–1.7 مغنطون بور [ط 64] لكل ذرة.[53] تبلغ قيمة النفاذية الكهرومغناطيسية [ط 65] ثُلثَي قيمتها من التي للحديد.[54] الكوبالت موصل جيد للحرارة وللكهرباء، وتبلغ قيمة الموصلية الكهربائية للكوبالت قرابة 26% من التي للنحاس.[de 5]
وفقاً للبنية البلّورية يمكن أن يوجد الكوبالت وفق شكلَين مختلفَين. الأوّل وفق نظام بلّوري سداسي بتعبئة متراصّةٍ [ط 66] وزمرة فراغية [ط 67] من النمط P63/mmc، وتبلغ قيمة ثابتي الشبكة البلّورية [ط 68] a و c فيه 250.7 بيكومتر و406.9 بيكومتر على الترتيب؛ مع وجود وحدَتي صيغة [ط 69] في وحدة الخليّة [ط 70]، ويُرمَز له بالحرف ألفا α. أمّا الشكل الثاني فهو وفق نظام بلّوري مكعّب مركزيّ الوجه [ط 71]، وتكون قيمة ثابت الشبكة البلورية a فيه مقدار 354.4 بيكومتر،[de 6] ويُرمَز له بالحرف بيتّا β. يعدّ النمط ألفا مستقرّاً عند درجات حرارة منخفضة، وعند درجة حرارة تقارب 450 °س يتغيّر التركيب البلّوري للكوبالت من النمط ألفا إلى النمط بيتّا؛ إلّا أنّه عمليّاً تكون الفروق الطاقيّة بينهما صغيرةً، إلى درجة أنّ النموّ البيني العشوائي [ط 72] بينهما شائع.[55]
الخواص الكيميائية[عدل]
ينتمي الكوبالت كيميائياً إلى مجموعة الفلزّات الانتقالية، وهو مُختَزِلٌ ضعيف، وتبلغ قيمة الكمون النظامي [ط 73] −0.277 فولت، لذلك فهو ينتمي إلى الفلزّات الوضيعة غير النبيلة؛ وتغطّي سطحَه طبقةٌ مُخَمّلّةٌ من الأكسيد [ط 74]، والتي تذوب في الأحماض المؤكسدة. يتشكّل عند التسخين بوجود الأكسجين أكسيد الكوبالت الثنائي والثلاثي Co3O4، والذي يفقد الأكسجين عند الدرجة 900 °س تقريباً ليعطي أكسيد الكوبالت الثنائي CoO.[de 4] لا يتفاعل الكوبالت مع الهيدروجين أو النتروجين حتّى باستخدام التسخين. بالمقابل، يتفاعل الكوبالت مع الهالوجينات عند درجات حرارة مرتفعة ليعطي هاليدات الكوبالت الثلاثي الموافقة. ومن جهةٍ أخرى، يتفاعل عند درجات حرارة مرتفعة أيضاً مع البورون والكربون والفوسفور والزرنيخ والكبريت.[56]
المركبات الكيميائية[عدل]
تسود حالتا الأكسدة الثنائية (+2) والثلاثية (+3) على الكوبالت في مركّباته الكيميائية، لكنّ حالات الأكسدة الأخرى للكوبالت أيضاً ملحوظة، سواءٌ الدنيا منها (-1 و 0 و +1) أم العليا (+4 و +5). يشكّل الكوبالت العديدَ من المعقّدات التناسقية الملوّنة، وغالباً في حالة الأكسدة +3، منها المعقّد المائي 2+ [Co(H2O)6] ذو اللون الزهري، والذي يعمد عند وجود أيونات الكلوريد إلى تشكيل معقّد ذي لون أزرق داكن من 2− [CoCl4].[1]
اللاعضوية[عدل]


- الأكاسيد
يُعرَف للكوبالت عددٌ من الأكاسيد؛ لأكسيد الكوبالت الثنائي الأخضر CoO بنية بلّورية مكعّبة، وهو لا ينحلّ في الماء ويتأكسد بوجود الأكسجين إلى هيدروكسيد الكوبالت الثلاثي Co(OH)3 البنّي. عند درجات حرارة تتراوح بين 600–700 °س يتأكسد CoO إلى أكسيد الكوبالت الثنائي والثلاثي Co3O4 الأسود، وهو مركّب يحوي على الكوبالت في حالتي أكسدة مختلفَتين، وله بنية الإسبينل [ط 75].[1] كما يُعرَف أيضاً أكسيد الكوبالت الثلاثي Co2O3 الأسود.[57]
- الهاليدات
إنّ جميع هاليدات الكوبالت الثنائي معروفة، وأشهرها مركّب كلوريد الكوبالت الثنائي، والذي يبدو في الشكل اللامائي بلونٍ أزرق، أمّا الشكل المائي منه سداسي الهيدرات فهو ذو لون زهري.[1] للشكل اللامائي من كلوريد الكوبالت الثنائي قدرةٌ عاليةٌ على الاسترطاب وسحب جزيئات الماء من الوسط المحيط، ويرافق ذلك تحوّلٌ لونيٌّ من الأزرق إلى الزهري. يمكن إجراء التحوّل اللوني العكسي من الزهري إلى الأزرق بتسخين الشكل المائي إلى درجات حرارة تفوق 35 °س.[de 4] بسبب هذا التحوّل اللوني النمطي يُستخدَم مركّب كلوريد الكوبالت الثنائي مُستشعراً كيميائياً في المجفّفات مثل هلام السيليكا؛ بالإضافة إلى استخدامه في الأشكال الأوّلية من الحبر السرّي، إذ أنّ الخطّ المكتوب بمحلول الشكل المائي على ورقة بالكاد يُقرَأ، لكنّ تسخين تلك الورقة بمكواةٍ مثلاً يظهر اللون الأزرق للشكل اللامائي من هذا المركّب. يوجد مركّب فلوريد الكوبالت الثنائي CoF2 على هيئة بلّورات زهرية؛ أمّا بروميد الكوبالت الثنائي CoBr2 فهو صلب بلّوري أخضر اللون سهل الاسترطاب، والذي يتحوّل لونياً أيضاً إلى سداسي الهيدرات الأحمر؛ أمّا يوديد الكوبالت الثنائي الأسود CoI2 فله بنية تشبه بنية يوديد الكادميوم البلّورية.[58]
تبلغ قيمة كمون اختزال [ط 76] الكوبالت الثلاثي إلى الكوبالت الثنائي مقدار +1.92 فولت؛ وهي أكبر من قيمة كمون اختزال الكلور إلى الكلوريد (+1.36 فولت)؛ لذلك فإنّ كلوريد الكوبالت الثلاثي غير مستقرّ، وسرعان ما يُختَزل إلى كلوريد الكوبالت الثنائي، وهذا ينطبق على البروميد واليوديد؛ في حين أنّ كمون اختزال الفلور إلى فلوريد مرتفع (+2.87 فولت) إلى درجةٍ تسمح بتشكّل فلوريد الكوبالت الثلاثي CoF3، والمستخدم في تفاعلات الفلورة [ط 77].[de 4]

- مركبات وأملاح أخرى
يوجد مركّب نترات الكوبالت الثنائي Co(NO3)2 على هيئة صلب بلّوري ذي لون أحمر بنّي، وهو سهل الاسترطاب، ويكون الشكل المائي سداسي الهيدرات هو السائد. أمّا كبريتات الكوبالت الثنائي CoSO4 فهو مركّب سهل الاسترطاب، والشكل المائي منه سباعي الهيدرات، ويُستخدَم في صناعة الخُضُب وفي الطلي الكهربائي؛ بالإضافة إلى استخدامه مضافاً للغذاء في أحواض السمك.[de 7] يُعرَف مركّب سداسي نتروكوبالتات البوتاسيوم باسم «أصفر الكوبالت»، وهو يُستخدَم بشكلٍ واسعٍ في الرسم الزيتي والمائي.
يعدّ أكسالات الكوبالت الثنائي CoC2O4 قابلاً للاشتعال، ولكن من الصعب إشعاله، وهو ملح عضوي ذو لون زهري، وعمليّاً غير قابل للانحلال في الماء. يتفكّك هذا المركّب عند درجات حرارة تتجاوز 300 °س، ويوجد على هيئة شكلَين بلّوريَّين، الأوّل أحادي الميل [ط 78]، والآخر مَعيْني قائم [ط 79].[59] للشكل اللامائي من هذا المركّب تطبيقات في مجال الحصول على مسحوق الكوبالت الفلزّي؛[60] أمّا الشكل المائي فيُستخدَم في مجال التحفيز الكيميائي.[58]
المعقدات التناسقية[عدل]

يشكّل الكوبالت عدداً معتبراً من المعقّدات التناسقية، وتلك خاصّةٌ مميّزةٌ على العموم للفلزّات الانتقالية؛ وتتميّز تلك المعقّدات بألوانها الزاهية، وبتنوّع الرُبَيطات، ويكون الكوبالت فيها غالباً سداسي التناسق. أشهر تلك المعقّدات هي المعقّدات المائية عندما تكون الرُبَيطة من جزيء ماء H2O مثل سداسي ماءات الكوبالت الثنائي [ط 80] 2+ [Co(H2O)6]؛ والمعقّدات الأمينية عندما تكون الرُبَيطة من جزيء أمونيا NH3 مثل ثنائي ماءات رباعي أمين الكوبالت الثلاثي [ط 81] 3+ [Co(NH3)4(H2O)2].[61] يستطيع الكوبالت أن يشكّل معقّدات أخرى مع اختلاف نوع الرُبَيطة الكيميائي، مثل الكربونات، كما هو الحال في أنيون ثلاثي كربونات الكوبالت الثلاثي [ط 82] 3− [Co(CO3)3]؛[61] [62][63] والنتريت، كما هو الحال في أنيون ثنائي أمين رباعي نتريت الكوبالت الثلاثي [ط 83] − [Co(NO2)4(NH3)2]؛[61] والهيدروكسيد، كما هو الحال في معقّد الهكسول [ط 84]؛ والكلوريد، كما هو الحال في معقّد رباعي كلوريد الكوبالت الثنائي [ط 85] 2− [CoCl4]؛ والأكسالات، كما هو الحال في أنيون ثلاثي أكسالات الكوبالت الثلاثي −3 [Co(C2O4)3].[61] من الرُبَيطات الأخرى أيضاً، كلّ من السيانيد، كما هو الحال في معقّد سداسي سيانو الكوبالت الثنائي [ط 86] 4− [CoCN6]، والثيوسيانات، كما هو الحال في معقّد رباعي ثيوسيانات الكوبالت الثنائي [ط 87] 2− [Co(SCN)4].[de 8]
يؤثّر نوع الرُبَيطة على ثباتية واستقرار حالة الأكسدة لذرّة (أو ذرّات) الكوبالت في المعقّد، وذلك وفقاً للقواعد العامّة للكهرسلبية [ط 88] ولمبادئ نظرية قساوة وطراوة الرُبَيطات [ط 89]. فعلى سبيل المثال، تميل معقّدات الكوبالت الثلاثي لأن تكون معقّدات أمينية؛ ولكن نظراً لأنّ الفوسفور أطرى من النتروجين، فإنّ رُبَيطات الفوسفين تفضّل الارتباط مع مراكز الكوبالت الأحادي +Co والثنائي 2+Co، مثلما هو الحال في معقّد ثلاثي(ثلاثي فينيل فوسفين) الكوبالت الأحادي [ط 90] P(C6H5)3)3CoCl. من جهةٍ أخرى، فإنّ الرُبَيطات الأكثر كهرسلبية (الأقسى) مثل الأكسيد والفلوريد قادرةٌ على تثبيت معقّدات الكوبالت الرباعي 4+Co والخماسي 5+Co، مثلما هو الحال في معقّد سداسي فلوروكوبالتات السيزيوم [ط 91] Cs2CoF6 ومعقد بيركوبالتات البوتاسيوم [ط 92] K3CoO4.[de 4]

أجرى ألفرد فيرنر [ط 93]، الحائز على جائزة نوبل في الكيمياء لأبحاثه في الكيمياء التناسقية، تجاربَ عديدةً على معقّدات الكوبالت الأمينية انطلاقاً من الصيغة المجملة للأيون 3+ [Co(NH3)6]؛ وتمكّن من تحضير كلوريد سداسي أمين الكوبالت الثلاثي [ط 94] (المعروف أيضاً باسم معقّد فيرنر [ط 95]) [Co(NH3)6]Cl3. يتميّز هذا المعقّد بتشكيل ذرّة الكوبالت المركزية ستّ روابط تناسقية مع ستّ رُبَيطات من الأمين المتعامِدة على بعضها، وبوجود ثلاث أيونات مقابلة من الكلوريد من أجل معادلة الشحنة الكهربائية. باستخدام رُبَيطات من ثنائي أمين الإيثيلين [ط 96] المُخَلِّبَة [ط 97] عوضاً عن الربيطات الأمينية فإنّ ذلك ينتج معقّد كلوريد ثلاثي (ثنائي أمين إيثيلين) الكوبالت الثلاثي [ط 98]، وهو واحد من أوائل المعقّدات التناسقية التي بُرْهِنَ على تصاوُغها الضوئي (اليدوية الكيميائية [ط 99]).[de 9][64]
انطلاقاً من محلول كلوريد الكوبالت الثنائي 2− [CoCl4] يمكن الحصول على سلسلةٍ من المعقّدات، فبإضافة كمّيّات قليلةٍ من محلول من هيدروكسيد الأمونيوم إليه يَنتُجُ في البداية راسبٌ من هيدروكسيد الكوبالت الثنائي Co(OH)2؛ والذي ينحلّ عند إضافة كمّيّة فائضة من محلول هيدروكسيد الأمونيوم وكلوريد الأمونيوم بوجود الأكسجين مع تشكّل مزيجٍ أحمر غامق منحلّ، والذي يتكوّن من معقّدَين للكوبالت، الأّوّل من كلوريد سداسي أمين الكوبالت الثلاثي [ط 100] الأصفر البرتقالي، والثاني من كلوريد خماسي أمين الكوبالت المائي [ط 101] الأحمر.
يمكن الحصول على معقّد سداسي أمين الكوبالت الثنائي من تمرير غاز الأمونيا على محلول من كبريتات الكوبالت الثنائي اللامائي.


العضوية[عدل]
يعدّ الكوبالتوسين [ط 102] من أشهر مركّبات الكوبالت العضوية، وهو مشابهٌ بُنيَويٌّ للفرّوسين، ولكنّه أكثر حساسيةً للأكسدة بأكسجين الهواء من الأخير.[65] كما يستطيع الكوبالت أن يشكّل معقّدات كربونيلية مثل معقّد ثماني كربونيل ثنائي الكوبالت Co2(CO)8، والمُستخدَم في مجال تحفيز تفاعلات إضافة الكربونيل [ط 103] وإضافة السيليل الهيدروجينية [ط 104].[66] يعدّ الفيتامين بي 12 مثالاً على مركّب كوبالت عضوي، والمتوفّر طبيعياً، وهو من الأمثلة النادرة في الطبيعة لفيتامين حاوٍ على ذرّة فلزّ مركزية في تركيبه.[67]
من الأمثلة على مركّبات الكوبالت العضوية الألكيلية معقّد رباعي (1-نوربورنيل) الكوبالت الرباعي [ط 105]، وهو يحوي على الكوبالت في حالة الأكسدة النادرة +4، ويحيط بذرّة الكوبالت المركزية أربع وحدات من النوربورنان [ط 106]؛ ويتميّز بثباتيّته تجاه تفاعل حذف الهيدريد بيتّا [ط 107].[68][69]
التحليل الكيميائي[عدل]
يعطي اختبار اللهب لأيونات الكوبالت لوناً أزرق في كلا نوعَي اللهب المستخدم: المؤكسِد والمختَزِل.[70] يمكن الكشف عن الكوبالت بالوسائل التحليليّة التقليديّة باستخدام مركّب ثيوسيانات الكوبالت الثنائي Co(SCN)2، والذي يمكن أن يُحضّر من تفاعل تبادل بين ملحَي كلوريد الكوبالت الثنائي وثيوسيانات البوتاسيوم. لمركّب ثيوسيانات البوتاسيوم لون أحمر في المحاليل المائية، والذي ينقلب إلى اللون الأزرق في الأوساط العضوية، مثل الكحول الأميلي أو الأسيتون. [de 8] يمكن إجراء التحليل الكمّي للكوبالت بالوسائل التقليدية عن طريق إجراء معايرة تشكّل معقّد [ط 108] للكوبالت مع ثنائي أمين الإيثيلين رباعي حمض الأسيتيك (EDTA) [ط 109] باستخدام الموركسيد [ط 110] مؤشّراً كيميائيّاً لونيّاً.
الدور الحيوي[عدل]
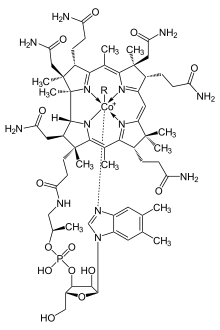
للكوبالت دورٌ حيويٌّ مهمٌّ في استقلاب عددٍ من الكائنات الحيّة، فهو من المُغَذّيّات الضرورية، خاصّةً لدى الحيوانات، إذ أنّه مُكَوّنٌ مٌهِمٌّ في تركيب الفيتامين بي 12 (B12)، والذي يُعرَف باسم «الكوبالامين» [ط 111].[71] ينبغي على الكوبالامين أن يرتبط بعاملٍ داخليٍّ [ط 112]، وهو بروتينٌ سكّريٌّ يُنتَج بواسطة الخلايا الجدارية في المعدة، ويُمتصّ في منطقة اللفائفي [ط 113] في الأمعاء الدقيقة.[72] بما أنّ مركز إنتاج الكوبالامين في جسم الإنسان يقع في الأمعاء الغليظة؛ لذلك ينبغي تأمين مصدر الكوبالامين من الغذاء.[de 10] يعدّ الكوبالت من العناصر الشحيحة الزهيدة التي يكفي كمّيّات ضئيلة منها لتغطية المدخول اليومي [ط 114]. تقوم البكتريا (العتائق [ط 115]) الموجودة في أمعاء الحيوانات المجترة بتحويل أملاح الكوبالت المختلفة إلى كوبالامين؛ لذلك فإنّ وجود أملاح الكوبالت بمجرّد كمّيّات نَزِرة كفيلٌ بتحسين صحّة الحيوانات في المراعي، إذ أنّ الحصول على كمّيّة من الكوبالت بمقدار 0.20 مغ/كغ كافٍ لتأمين مصدرٍ لاصطناع الكوبالامين حيوياً.[73] تقوم البروتينات الحاوية على الكوبالامين باستخدام مركّب الكورين [ط 116] لاحتجاز الكوبالت؛ في حين أنّ الكوبالامين يتميّز بوجود رابطة فعّالة بين الكربون والكوبالت C-Co تساهم بدخوله في التفاعلات الحيوية.[74]
يوجد نمطان من الرُبَيطات الألكيليّة [ط 117] في الكوبالامين لدى الإنسان، وذلك إمّا على هيئة مجموعة ميثيل أو أدينوزيل. في الحالة الأولى، يدعى المركب «ميثيل الكوبالامين» [ط 118] (والذي يُرمَز له اختصاراً MeB12)، ويقوم بدورٍ في نقل مجموعة الميثيل الحيوية. في الحالة الثانية يقوم الكوبالامين بتحفيز تفاعلات إعادة الترتيب الحيوية، فعلى سبيل المثال، يعدّ الكوبالامين الحاوي على الأدينوزيل ضرورياً من أجل الدور الوظيفي لإنزيم موتاز ميثيل المالونيل-مرافق الإنزيم A [ط 119]، والذي يقوم بتحويل وحدة ميثيل المالونيل في ميثيل المالونيل-مرافق الإنزيم A [ط 120] إلى وحدة سكسينيل في سكسينيل-مرافق الإنزيم A [ط 121]، وتلك خطوة مهمّة في أيض (استقلاب) الدهون والبروتينات.[75] إلى جانب الكوبالامين يوجد البعض من البروتينات الحاوية على الكوبالت والتي لا تستخدم الكورين من أجل حجز الكوبالت، إنّما يكون الارتباط بالكوبالت مباشراً، ومن الأمثلة عليها إنزيم ميثيونين أمينوببتيداز [ط 122] وهيدريتاز النتريل [ط 123].[76]
عوز الكوبالت[عدل]

لا تصادَف حالة عوز الكوبالت (نقص الكوبالت) [ط 124] عند البشر في حال تناول الإنسان للمصادر الغذائية الطبيعية الحاوية على الكوبالامين (فيتامين بي 12). يؤدّي عوز الفيتامين بي 12 إلى حدوث خللٍ في تكوّن الكريّات الحمر [ط 125]، ممّا قد يؤدّي إلى حدوث حالة من فقر الدم [ط 126].[de 11] أمّا المجترّات من البقر والغنم فتؤمّن حاجتها من الكوبالامين عن طريق الاصطناع الحيوي، الذي تقوم به البكتريا الموجودة في كروش تلك المواشي.[de 12] يؤثّر نقص الكوبالت على صحّة المواشي، إذ يؤدّي إلى اضطراب في النموّ والرضاعة وحدوث حالة من فقر الدم وفقدان الشهية.[de 13] وتلك ظاهرة اكتشفت أوائل القرن العشرين ، وذلك أثناء برنامج تطوير الزراعة في الهضبة البركانية في الجزيرة الشمالية [ط 127] في نيوزيلندا؛ إذ لوحِظَ أنّ المواشي كانت تعاني من الهزال، فيما أطلق عليه حينها اسم «داء الشجيرات» [ط 128].[77] اكتُشفَ فيما بعد أنّ التربة البركانية المنتشرة هناك كانت فقيرة بأملاح الكوبالت الضروريّ توفّرها في السلسلة الغذائية للمواشي.[78] لوحظت ظاهرة مشابهة في المواشي في منطقة صحراء التسعين ميلاً [ط 129] في جنوب أستراليا.[79] جرى التغلّب على هذه الظاهرة من خلال مزج التربة بمضغوطاتٍ من أملاح الكوبالت اللاعضوية.[78][80]
الاستخدامات[عدل]
بلغ الإنتاج العالميّ من الكوبالت سنة 2016 مقدار 116 ألف طن؛[81] ولهذا الفلزّ تطبيقات كبيرة ومهمّة، فهو يدخل في تركيب السبائك مرتفعة الأداء؛[47][48] كما يُستخدَم في تركيب بطّاريات السيارات الكهربائية وفي مجال التحفيز؛ ومن التطبيقات التاريخية دخوله في تركيب الخُضُب. يُستخدَم الكوبالت أيضاً في عمليّات الطلي الكهربائي [ط 130] نظراً لمظهره الجذّاب ولصلادَته ولمقاوَمته فعل الأكسدة.[82]
التلوين وصناعة الخضب[عدل]

ُأنتِجَ زجاج الكوبالت في الماضي من صهر مزيجٍ مُكَوّنٍ من معدن الإسملتيت [ط 131] الحاوي على الكوبالت والكوارتز (المرو) ورماد البوتاس؛ ثمّ بتحميص المزيج، والذي يعطي في النهاية زجاجاً سيليكاتيّاً ذا لون أزرق داكن، والذي كان يطحن فيما بعد إلى مسحوقٍ ناعمٍ، ويُستخدَم في تلوين الأواني الخزفية والبورسلانية وفي مجال الرسم.[83][84] استُخدِمَت خُضُب الكوبالت المختلفة في تلوين الرسومات المائية والزيتية بالألوان المتنوّعة، وذلك باللون الأصفر باستخدام أصفر الكوبالت [ط 132] (وهو مركّب سداسي نتروكوبالتات البوتاسيوم)؛ وباللون الأزرق باستخدام أزرق الكوبالت أو أزرق السيرولين [ط 133] المكوّن من قصديرات الكوبالت الثنائي [ط 134]؛ وكذلك بطيف متعدد من اللون الأخضر باستخدام أخضر الكوبالت (وهو مزيج أكسيد الكوبالت الثنائي والزنك)؛ بالإضافة إلى اللون البنفسجي باستخدام فوسفات الكوبالت الثنائي Co3(PO4)2.[85][86]
السبائك[عدل]
يدخل الكوبالت في تركيب السبائك الفائقة [ط 135]؛[47][48] وتساهم الاستقرارية والثباتيّة الحرارية لتلك السبائك في جعلها ملائمةً لاستخدامها في صناعة رِيَش [ط 136] العَنَفات الغازيّة [ط 137] والمحرّكات النفّاثة [ط 138]؛ على الرغم من أنّ سبائك البلّورات الأحادية [ط 139] الحاوية على النيكل تفوقها من ناحية الأداء.[87] بدأ استخدام سبائك الكوبالت المقاومة للاهتراء منذ بداية القرن العشرين مع تطوير سبائك الستيليت [ط 140] المقاوِمَة وشديدة الصلادة، والحاوية بالإضافة إلى الكوبالت على التنغستن والكروم والنيكل والموليبدنوم والكربون؛ كما تتميّز سبائك الكوبالت مع الكروم وكربيد التنغستن أيضاً بصلادتها ومقاومتها للاهتراء.[88] يدخل الكوبالت في تركيب فولاذ القطع السريع [ط 141] المقاوم أيضاً للاهتراء وللحرارة؛ وكذلك في سبيكة الكوبالت والساماريوم [ط 142]، والمستخدَمة في صناعة المغانط الدائمة [ط 143]؛ وكذلك أيضاً سبيكة «ألنيكو» [ط 144] المصنوعة من الألومنيوم والنيكل والكوبالت والحديد.[89] يُسبَك الكوبالت أيضاً بنسبةٍ قليلةٍ دون 5% مع البلاتين لصنع المجوهَرات.[90]
تتميّز السبائك الحاوية على الكوبالت بأنّها مقاومة للتآكل والاهتراء، ممّا يجعلها إلى جانب التيتانيوم مفيدةً في زراعة العظام؛ فعلى سبيل المثال، تُستخدَم سبيكة فيتاليوم [ط 145] المصنوعة من الكوبالت والكروم والموليبدنوم في تركيب الأطراف الصناعية [ط 146]، خاصّةً لبدائل الورك والركبة.[91] كما تُستخدَم سبائك الكوبالت في صناعة غرسات الأسنان، وذلك بديلاً عن سبائك النيكل التي يمكن أن تسبّب الحساسية [ط 147].[92]
البطاريات[عدل]

يُستخدَم مركّب أكسيد الليثيوم والكوبالت LiCoO2 [ط 148] بشكل واسع في تركيب بطّارية أيونات الليثيوم، وتتألّف هذه المادّة من طبقات من أيونات الليثيوم الأحادي المُقْحَمة [ط 149] بين صفائح ممتدّة مُكَوّنة من أيونات الكوبالت الثلاثي المحصورة بين طبقتين من أيونات الأكسيد؛[93] وأثناء عملية تفريغ البطارية تتحرّر أيونات الليثيوم.[94] يدخل الكوبالت أيضاً في تركيب بطّاريات النيكل والكادميوم (NiCd)،[95] وفي بطّاريات النيكل وهيدريد الفلز (NiMH)،[96] وذلك من أجل تحسين أكسدة النيكل في البطّاريات المذكورة.[95]
تُستخدَم تلك البطّاريات الحاوية على الكوبالت بشكلٍ رئيسيّ في الأجهزة المحمولة من هواتف وحواسيب، نظراً لارتفاع كثافة الطاقة فيها؛ كما بدأت تُستخدَم أيضاً بشكلٍ واسعٍ في تركيب بطّاريات السيّارات الكهربائيّة، والتي يُتوَقّع أن ينمو سوقها بشكلٍ متزايد، بالتالي سيزداد الطلب على الكوبالت.[97] نظراً للتنافس الشديد على سوق الكوبالت بدأت بعض الشركات المصنّعة للسيارات الكهربائية بالتقليل من محتوى الكوبالت في البطّاريات، أو بالاعتماد على بدائل من بطّاريات خالية من الكوبالت، مثل بطّارية فوسفات الحديد والليثيوم [ط 150]، إذ أعلنت شركة تسلا عن نيّتها فعل ذلك على سبيل المثال.[98]
التحفيز[عدل]
تُستخدَم مركّبات الكوبالت بشكلٍ واسعٍ في مجال التحفيز الكيميائي، وخاصّةً في تفاعلات الأكسدة. إذ يُستخدَم مركّب أسيتات الكوبالت الثنائي Co(CH3COO)2 من أجل تحويل الزيلين [ط 151] إلى حمض التيريفثاليك [ط 152]، وهو مركّب طليعي [ط 153] في إنتاج بولي إيثيلين تيرفثالات [ط 154]. تعدّ كربوكسيلات الكوبالت على العموم من الحفّازات النمطية المُستخدَمة في مجال الدهان والورنيش والأحبار على هيئة عوامل مجفّفة من خلال أكسدة الزيوت الجفوفة [ط 155]؛[94] كما تُستخدَم أيضاً من أجل تسريع عملية البلمرة في راتنج البوليستر [ط 156].[99]
تدخل الحفّازات الحاوية على الكوبالت في تحفيز التفاعلات الكيميائية في عددٍ من العمليّات الكيميائية المهمّة، مثل عملية فيشر-تروبش [ط 157] من أجل تحويل مزيج من أحادي أكسيد الكربون والهيدروجين إلى هيدروكربونات سائلة؛[100] ومثل عملية إضافة الفورميل الهيدروجينية [ط 158] المعتمدَة على حفّاز من ثماني كربونيل ثنائي الكوبالت Co2(CO)8؛[101] ومثل عملية نزع الكبريت المهدرج [ط 159]، التي تَستخدِمُ حفّازاً من الكوبالت والموليبدنوم من أجل التخلّص من الكبريت في المنتَجات النفطيّة.[94]
النظائر المشعة[عدل]
يُستخدَم النظير المشعّ كوبالت-60 (Co-60 أو 60Co) مصدراً لأشعّة غاما، ويُنتَج من قذف الكوبالت بالنيوترونات. يصدر هذا النظير أشعّة غاما بمقدارين من الطاقة، الأوّل قيمته 1.17 ميغاإلكترون فولت (MeV)، والثاني 1.33 ميغاإلكترون فولت.[50][102] من التطبيقات العمليّة لهذا النظير استخدامه في العلاج الإشعاعي الخارجي [ط 160]، وفي تعقيم التجهيزات والمخلّفات الطبية، وفي تشعيع الأغذية.[103] يبلغ نصف العمر المشعّ للنظير كوبالت-60 مقدار 5.27 سنة، لذلك فإنّ الاضمحلال الكامل يتطلّب إجراء تغيير دوري لمصدر الإشعاع في مجال العلاج بالأشعّة؛ ولذلك فإنّ أجهزة الإشعاع العاملة بالكوبالت قد استعيض عنها في بعض الدول بشكلٍ كبير بمسرّعات خطّية [ط 161].[104]
للنظير كوبالت-57 استخدام طبي أيضاً وذلك في مجال التقفّي الإشعاعي [ط 162] لمدخول الفيتامين بي 12 وفق اختبار شيلينغ [ط 163]؛ كما يُستخدَم مصدراً في مطيافية موسباور [ط 164]، وكذلك يعدّ مصدراً محتَملاً في أجهزة فلورية الأشعّة السينية [ط 165].[105][106] يمكن أن يُستخدَم النظير كوبالت-59 في تصميم السلاح النووي، إذ يمكن للنظير كوبالت-60 الناتج عن الانفجار النووي أن يتبعثر على هيئة تهاطل نووي [ط 166]، فيما يعرف باسم «قنبلة الكوبالت» [ط 167].[107]
المخاطر[عدل]
| كوبالت | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H302, H317, H319, H334, H341, H350, H412 |
| بيانات وقائية وفق GHS | P273, P280, P301+312, P302+352, P305+351+338, P308+313 |
| NFPA 704 | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
تعدّ مركّبات الكوبالت اللاعضوية من المركّبات السامة؛ وذلك ما أثبتته التجارب على الجرذان.[108] تقع قيمة الجرعة المميتة الوسطية [ط 168] لأملاح الكوبالت المنحلّة تقديرياً بين 150 إلى 500 مغ/كغ.[109] في الولايات المتّحدة الأمريكية حدّدت إدارة السلامة والصحّة المهنية [ط 169] حدّ التعرّض المسموح [ط 170] به من الكوبالت في مكان العمل في متوسّط زمني مُثَقّل [ط 171] بمقدار 0.1 مغ/م3؛ أمّا المعهد الوطني للسلامة والصحّة المهنية [ط 172] فوضع حدّ التعرّض الموصى به [ط 173] من الكوبالت بمقدار 0.05 مغ/م3؛ أمّا المقدار الذي يسبّب خطورةً فوريةً للحياة أو الصحّة [ط 174] فيبلغ 20 مغ/م 3.[110] تجدر الإشارة إلى أنّ تناول الكوبالت المزمن قد سبّب مشاكل صحّية جسيمة بجرعاتٍ أقلّ بكثير من الجرعة المميتة؛ ففي سنة 1966 أدّت إضافة مركّبات الكوبالت بغرض تثبيت رغوة الجعة في كندا إلى أشكال محدّدة من اعتلال عضلة القلب المحرَّض ذيفانياً [ط 175].[111][112]
يسبّب استنشاق الكوبالت مشاكل تنفسية؛[113] كما يؤدّي لمس هذا الفلز إلى مشاكل جلدية، إذ يأتي بعد النيكل والكروم في تسبّبه بحدوث التهاب الجلد التماسي التحسسي [ط 176].[114] يعدّ الكوبالت مكوّناً من مكوّنات دخان التبغ،[115] إذ يُمتَصّ نبات التبغ الكوبالت من التربة المحيطة ويُركّزه مع الفلزّات الثقيلة الأخرى في أوراقه بسهولة؛ وتلك المكوّنات اللاعضوية تُستَنشق لاحقاً أثناء تدخين التبغ.[116] تصنّف الوكالة الدولية لبحوث السرطان [ط 177] فلزّ الكوبالت ضمن المجموعة 2B [ط 178] في تصنيف المُسرطِنات؛ ممّا يعني أنه هناك احتمالية لهذا الفلز أن يسبّب مرض السرطان.[117]
طالع أيضاً[عدل]
| كوبالت في المشاريع الشقيقة: | |
| |
| يوجد في سكوليا ملف عن المادة الكيميائية كوبالت. |
الهوامش[عدل]
- ملحوظات
- ^ حسب معجم مصطلحات الكيمياء الصادر عن مجمع اللغة العربية بدمشق[ar 1] أو الكُوبَلْت بأسلوب كتابة آخر حسب معجم الكيمياء والصيدلة الصادر عن مجمع اللغة العربية بالقاهرة.[ar 2]
- ^ نشر براندت عن اكتشافه لعنصر الكوبالت أوّل مرّة في المجلة السويدية للآداب والعلوم[sv 1] ومن المنشورات اللاحقة باللغة السويدية أيضاً مقالة عنوانها: مشاهدات وملاحظات حول خضاب الكوبالت غير الاعتيادي (بالسويدية: Rön och anmärkningar angäende en synnerlig färg—cobolt)،[sv 2] ومقالة أخرى نشرها باللاتينية في مجلة الجمعية العلمية الملكية في أوبسالا عنوانها: "الكوبالت: فحص ووصف العنصر الجديد" (باللاتينية: Cobalti nova species examinata et descripta).[la 1]
- ^ أصل الاسم Erythrite، ويُعرف أيضاً باسم بريق الكوبالت أو الكوبالت الأحمر.
- مصطلحات
- ^ Uluburun shipwreck
- ^ Kobold
- ^ Goblin
- ^ Georg Brandt
- ^ Torbern Olof Bergman
- ^ Sven Rinman
- ^ Cobalt green
- ^ Louis Jacques Thénard
- ^ Cobalt blue
- ^ smalt
- ^ Nikolaus Wolfgang Fischer
- ^ Zaffre
- ^ Blaafarveværket
- ^ Shaba II
- ^ John Livingood
- ^ Glenn T. Seaborg
- ^ r-process
- ^ siderophile
- ^ Goldschmidt classification
- ^ Cobaltite
- ^ Safflorite
- ^ Glaucodot
- ^ Siegenite
- ^ Skutterudite
- ^ Cattierite
- ^ Pyrite
- ^ Spherocobaltite
- ^ phytoplankton
- ^ cyanobacteria
- ^ biological uptake
- ^ biological uptake
- ^ terrestrial runoff
- ^ hydrothermal vents
- ^ Clarion Clipperton Zone
- ^ United States Geological Survey (USGS)
- ^ Katanga Province
- ^ British Geological Survey (BGS)
- ^ Glencore
- ^ Mutanda Mine
- ^ Central African Mining and Exploration Company (CAMEC)
- ^ Eurasian Natural Resources Corporation PLC (ENRC)
- ^ Mukondo Mine
- ^ Artisanal mining
- ^ Congo DongFang
- ^ Zhejiang Huayou Cobalt
- ^ Apple Inc.
- ^ LG Chem
- ^ ultramafic rocks
- ^ Froth flotation
- ^ slag
- ^ aluminothermic reaction
- ^ Blast furnace
- ^ Mössbauer spectroscopy
- ^ Schilling test
- ^ Sterilization
- ^ Food irradiation
- ^ Industrial radiography
- ^ Cobalt therapy
- ^ Wu experiment
- ^ conservation of parity
- ^ Ferromagnetism
- ^ Curie temperature
- ^ Magnetic moment
- ^ Bohr magneton
- ^ Permeability
- ^ hexagonal close-packed (hcp)
- ^ Space group
- ^ Lattice constant
- ^ Formula unit
- ^ Unit cell
- ^ Face-centered cubic crystal system (fcc)
- ^ random intergrowth
- ^ normal potential
- ^ passivating oxide film
- ^ spinel structure
- ^ reduction potential
- ^ fluorination
- ^ Monoclinic crystal system
- ^ Orthorhombic crystal system
- ^ hexaaquocobalt(II)
- ^ diaquotetraamminecobalt(III)
- ^ triscarbonatocobaltate(III)
- ^ diaquotetranitritocobalt(III)
- ^ hexol
- ^ tetrachloridocobaltate(II)
- ^ hexacyanocobaltate(II)
- ^ tetrachloridocobaltate(II)
- ^ electronegativity
- ^ نظرية HSAB
- ^ tris(triphenylphosphine)cobalt(I) chloride
- ^ caesium hexafluorocobaltate
- ^ potassium percobaltate
- ^ Alfred Werner
- ^ Hexamminecobalt(III) chloride
- ^ Werner complex
- ^ Ethylenediamine
- ^ chelating
- ^ tris(ethylenediamine)cobalt(III)
- ^ Chirality
- ^ Hexamminecobalt(III) chloride
- ^ Aquapentaammincobalt(III) chloride
- ^ Cobaltocene
- ^ carbonylation
- ^ hydrosilylation
- ^ Tetrakis(1-norbornyl)cobalt(IV)
- ^ Norbornane
- ^ beta-Hydride elimination
- ^ Complexometric titration
- ^ Ethylenediaminetetraacetic acid
- ^ Murexide
- ^ cobalamin
- ^ Intrinsic factor
- ^ Ileum
- ^ Adequate Intake (AI)
- ^ archaea
- ^ corrin
- ^ alkyl ligands
- ^ Methylcobalamin
- ^ Methylmalonyl-CoA mutase (MCM)
- ^ Methylmalonyl-CoA (MMl-CoA)
- ^ succinyl-CoA (Su-CoA)
- ^ Methionine aminopeptidase 2 (METAP2)
- ^ Nitrile hydratase
- ^ Cobalt deficiency
- ^ Erythropoiesis
- ^ Anemia
- ^ North Island Volcanic Plateau
- ^ bush sickness
- ^ Ninety Mile Desert
- ^ electroplating
- ^ smaltite
- ^ Cobalt yellow
- ^ cerulean blue
- ^ cobalt(II) stannate
- ^ superalloys
- ^ turbine blades
- ^ gas turbines
- ^ jet engines
- ^ single-crystal alloys
- ^ Stellite
- ^ high-speed steels
- ^ Samarium–cobalt
- ^ permanent magnets
- ^ Alnico
- ^ Vitallium
- ^ prosthetic parts
- ^ allergenic
- ^ Lithium cobalt oxide
- ^ intercalated
- ^ Lithium iron phosphate battery (LFP)
- ^ xylene
- ^ terephthalic acid
- ^ precursor
- ^ polyethylene terephthalate (PET)
- ^ Drying oil
- ^ polyester resin
- ^ Fischer–Tropsch process
- ^ Hydroformylation
- ^ Hydrodesulfurization
- ^ external beam radiotherapy
- ^ linear accelerators
- ^ radiolabel
- ^ Schilling test
- ^ Mössbauer spectroscopy
- ^ X-ray fluorescence (XRF)
- ^ Schilling test
- ^ cobalt bomb
- ^ Median lethal dose (LD50)
- ^ Occupational Safety and Health Administration (OSHA)
- ^ permissible exposure limit (PEL)
- ^ time-weighted average (TWA)
- ^ National Institute for Occupational Safety and Health (NIOSH)
- ^ recommended exposure limit (REL)
- ^ IDLH
- ^ toxin-induced cardiomyopathy
- ^ Allergic contact dermatitis (ACD)
- ^ International Agency for Research on Cancer (IARC)
- ^ IARC group 2B
المراجع[عدل]
- بالعربية
- ^ معجم مصطلحات الكيمياء (بالعربية والإنجليزية والفرنسية) (ط. 1)، دمشق: مجمع اللغة العربية بدمشق، 2014، ص. 95، OCLC:931065783، QID:Q113378673
- ^ معجم الكيمياء والصيدلة (بالعربية والإنجليزية)، القاهرة: مجمع اللغة العربية بالقاهرة، ج. 2، 1994، ص. 466، QID:Q119442084
- بالألمانية
- ^ Gehlen, A. F. (1803). "Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard". Neues Allgemeines Journal der Chemie (بالألمانية). H. Frölich. 2. Archived from the original on 2023-06-13.
- ^ Fischer, N. W. (1848). "Ueber die salpetrichtsauren Salze". Annalen der Physik und Chemie (بالألمانية). 150 (5): 115–125. Bibcode:1848AnP...150..115F. DOI:10.1002/andp.18491500512. Archived from the original on 2022-03-20.
- ^ Harry H. Binder (1999). Lexikon der chemischen Elemente : das Periodensystem in Fakten, Zahlen und Daten (بالألمانية). Stuttgart: S. Hirzel. ISBN:3-7776-0736-3. OCLC:40933941.
- ^ أ ب ت ث ج ح خ د Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). "Cobalt". Lehrbuch der Anorganischen Chemie (بالألمانية) (102 ed.). de Gruyter. pp. 1146–1152. ISBN:978-3-11-017770-1. OCLC:612111124.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ أ ب Hans Breuer (2000). Dtv-Atlas Chemie (بالألمانية). München: dtv Verlagsgesellschaft. Vol. 1. p. 9. ISBN:3-423-03217-0. OCLC:426008036.
- ^ K. Schubert (1974). "Ein Modell für die Kristallstrukturen der chemischen Elemente". Acta Crystallographica (بالألمانية). 30: 193-204. DOI:10.1107/S0567740874002469. ISSN:0567-7408. OCLC:4646994743. Archived from the original on 2023-05-30.
- ^ C. Thomas (1996). Spezielle Pathologie (بالألمانية). Stuttgart: Schattauer. p. 179. ISBN:3-7945-2110-2. OCLC:47703363.
- ^ أ ب Heinrich Remy (1961). Lehrbuch der Anorganischen Chemie (بالألمانية). Leipzig: Geest & Portig. Vol. 2. pp. 356–365. OCLC:720294160.
- ^ Werner, A. (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V". Chemische Berichte (بالألمانية). 45: 121–130. DOI:10.1002/cber.19120450116. Archived from the original on 2022-03-13.
- ^ Kurt Hausmann (1955). "Die Bedeutung der Darmbakterien für die Vitamin B12- und Folsäure-Versorgung der Menschen und Tiere". Klinische Wochenschrift (بالألمانية). 33: 354–359. DOI:10.1007/BF01467965. ISSN:0023-2173. OCLC:104279845. Archived from the original on 2023-06-03.
- ^ Cem Ekmekcioglu (2006). Essenzielle Spurenelemente: Klinik und Ernahrungsmedizin (بالألمانية). Berlin: Springer. p. 198. ISBN:978-3-211-20859-5. OCLC:1264980428.
- ^ Wolfgang Löscher; Fritz Rupert; Reinhard Kroker, eds. (2006). Pharmakotherapie bei Haus- und Nutztieren (بالألمانية) (7 ed.). Stuttgart: Georg Thieme Verlag. p. 346. ISBN:978-3-8304-4160-1. OCLC:69105391.
- ^ Hans-Konrad Biesalski; Stephan C. Bischoff; Christoph Puchstein, eds. (2010). Ernährungsmedizin: nach dem neuen Curriculum Ernährungsmedizin der Bundesärztekammer (بالألمانية) (4 ed.). Stuttgart: Auflage, Georg Thieme Verlag. p. 205. ISBN:978-3-13-100294-5. OCLC:631137659.
- بالإنجليزية
- ^ أ ب ت ث Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. pp. 1117–1120. ISBN:0-08-037941-9.
- ^ "Cobalt: chemical element". Encyclopædia Britannica Online (بالإنجليزية). Archived from the original on 2015-05-18. Retrieved 2023-06-12.
- ^ Pulak, Cemal (1998). "The Uluburun shipwreck: an overview". International Journal of Nautical Archaeology (بالإنجليزية). 27 (3): 188–224. DOI:10.1111/j.1095-9270.1998.tb00803.x.
- ^ Henderson, Julian (2000). "Glass". The Science and Archaeology of Materials: An Investigation of Inorganic Materials (بالإنجليزية). Routledge. p. 60. ISBN:978-0-415-19933-9. Archived from the original on 2020-03-08.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (help) - ^ Rehren, Th. (2003). "Aspects of the Production of Cobalt-blue Glass in Egypt". Archaeometry (بالإنجليزية). 43 (4): 483–489. DOI:10.1111/1475-4754.00031.
- ^ Lucas, A. (2003). Ancient Egyptian Materials and Industries (بالإنجليزية). Kessinger Publishing. p. 217. ISBN:978-0-7661-5141-3. Archived from the original on 2020-04-06. Retrieved 2020-08-01.
- ^ أ ب Dennis, W. H (2010). "Cobalt". Metallurgy: 1863–1963 (بالإنجليزية). pp. 254–256. ISBN:978-0-202-36361-5. Archived from the original on 2020-01-21.
- ^ Wang, Shijie (2006). "Cobalt—Its recovery, recycling, and application". Journal of the Minerals, Metals and Materials Society (بالإنجليزية). 58 (10): 47–50. Bibcode:2006JOM....58j..47W. DOI:10.1007/s11837-006-0201-y.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. III. Some eighteenth-century metals". Journal of Chemical Education (بالإنجليزية). 9: 22. Bibcode:1932JChEd...9...22W. DOI:10.1021/ed009p22.
- ^ Battelle Memorial Institute (1960). Cobalt Monograph (بالإنجليزية). Brussels: Centre d'information du cobalt. p. 515. OCLC:921191777.
- ^ Ramberg, Ivar B. (2008). The making of a land: geology of Norway (بالإنجليزية). Geological Society. pp. 98–. ISBN:978-82-92394-42-7. Archived from the original on 2014-07-06. Retrieved 2011-04-30.
- ^ Cyclopaedia (1852). C. Tomlinson. 9 divs (ed.). Cyclopædia of useful arts & manufactures (بالإنجليزية). pp. 400–. Archived from the original on 2016-05-01. Retrieved 2011-04-30.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء عددية: قائمة المحررين (link) - ^ أ ب Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability" (بالإنجليزية). United States Geological Survey. Archived from the original on 2017-07-08.
- ^ Westing, Arthur H; Stockholm International Peace Research Institute (1986). "cobalt". Global resources and international conflict: environmental factors in strategic policy and action (بالإنجليزية). pp. 75–78. ISBN:978-0-19-829104-6. Archived from the original on 2015-10-04.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). "Long-Lived Radio Cobalt Isotopes". Physical Review (بالإنجليزية). 53 (10): 847–848. Bibcode:1938PhRv...53..847L. DOI:10.1103/PhysRev.53.847.
- ^ أ ب Wu, C. S. (1957). "Experimental Test of Parity Conservation in Beta Decay". Physical Review (بالإنجليزية). 105 (4): 1413–1415. Bibcode:1957PhRv..105.1413W. DOI:10.1103/PhysRev.105.1413.
- ^ Wróblewski, A. K. (2008). "The Downfall of Parity – the Revolution That Happened Fifty Years Ago" (PDF). Acta Physica Polonica B (بالإنجليزية). 39 (2): 251. Bibcode:2008AcPPB..39..251W. Archived from the original on 2019-03-05.
- ^ Ptitsyn, D. A.; Chechetkin, V. M. (1980). "Creation of the Iron-Group Elements in a Supernova Explosion". Soviet Astronomy Letters (بالإنجليزية). 6: 61–64. Bibcode:1980SvAL....6...61P.
- ^ Nuccio, Pasquale Mario and Valenza, Mariano (1979). "Determination of metallic iron, nickel and cobalt in meteorites" (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia (بالإنجليزية). 35 (1): 355–360. Archived from the original (PDF) on 2019-03-29.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Kerr, Paul F. (1945). "Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo" (PDF). American Mineralogist (بالإنجليزية). 30: 483–492. Archived from the original (PDF) on 2016-03-04.
- ^ Buckley, A. N. (1987). "The Surface Oxidation of Cobaltite". Australian Journal of Chemistry (بالإنجليزية). 40 (2): 231. DOI:10.1071/CH9870231.
- ^ Young, R. (1957). "The geochemistry of cobalt". Geochimica et Cosmochimica Acta (بالإنجليزية). 13: 28–41. Bibcode:1957GeCoA..13...28Y. DOI:10.1016/0016-7037(57)90056-X.
- ^ Bundy, Randelle M.; Tagliabue, Alessandro; Hawco, Nicholas J.; Morton, Peter L.; Twining, Benjamin S.; Hatta, Mariko; Noble, Abigail E.; Cape, Mattias R.; John, Seth G.; Cullen, Jay T.; Saito, Mak A. (1 Oct 2020). "Elevated sources of cobalt in the Arctic Ocean". Biogeosciences (بالإنجليزية). 17 (19): 4745–4767. Bibcode:2020BGeo...17.4745B. DOI:10.5194/bg-17-4745-2020. Archived from the original on 2022-02-27. Retrieved 2020-11-24.
- ^ Noble, Abigail E.; Lamborg, Carl H.; Ohnemus, Dan C.; Lam, Phoebe J.; Goepfert, Tyler J.; Measures, Chris I.; Frame, Caitlin H.; Casciotti, Karen L.; DiTullio, Giacomo R.; Jennings, Joe; Saito, Mak A. (2012). "Basin-scale inputs of cobalt, iron, and manganese from the Benguela-Angola front to the South Atlantic Ocean". Limnology and Oceanography (بالإنجليزية). 57 (4): 989–1010. Bibcode:2012LimOc..57..989N. DOI:10.4319/lo.2012.57.4.0989. ISSN:1939-5590.
- ^ Cutter, Gregory A.; Bruland, Kenneth W. (2012). "Rapid and noncontaminating sampling system for trace elements in global ocean surveys". Limnology and Oceanography: Methods (بالإنجليزية). 10 (6): 425–436. DOI:10.4319/lom.2012.10.425.
- ^ Bruland, K. W.; Lohan, M. C. (1 Dec 2003). "Controls of Trace Metals in Seawater". Treatise on Geochemistry (بالإنجليزية). 6: 23–47. Bibcode:2003TrGeo...6...23B. DOI:10.1016/B0-08-043751-6/06105-3. ISBN:978-0-08-043751-4. Archived from the original on 2022-02-27.
- ^ أ ب Lass, Hans Ulrich; Mohrholz, Volker (Nov 2008). "On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic". Journal of Marine Systems (بالإنجليزية). 74 (1–2): 1–43. Bibcode:2008JMS....74....1L. DOI:10.1016/j.jmarsys.2007.09.008.
- ^ International Seabed Authority. "Cobalt-Rich Crusts" (PDF). isa.org (بالإنجليزية). International Seabed Authority. Archived from the original (PDF) on 2022-03-08. Retrieved 2020-12-30.
- ^ US Department of Commerce, National Oceanic and Atmospheric Administration. "DeepCCZ: Deep-sea Mining Interests in the Clarion-Clipperton Zone: NOAA Office of Ocean Exploration and Research". oceanexplorer.noaa.gov (بالإنجليزية). National Oceanic and Atmospheric Administration. Archived from the original on 2022-02-27. Retrieved 2020-12-30.
- ^ Hawco, Nicholas J.; McIlvin, Matthew M.; Bundy, Randelle M.; Tagliabue, Alessandro; Goepfert, Tyler J.; Moran, Dawn M.; Valentin-Alvarado, Luis; DiTullio, Giacomo R.; Saito, Mak A. (7 Jul 2020). "Minimal cobalt metabolism in the marine cyanobacterium Prochlorococcus". Proceedings of the National Academy of Sciences (بالإنجليزية). 117 (27): 15740–15747. Bibcode:2020PNAS..11715740H. DOI:10.1073/pnas.2001393117. PMC:7354930. PMID:32576688.
- ^ Cobalt Statistics and Information (PDF) (بالإنجليزية), U.S. Geological Survey, 2018, Archived from the original (PDF) on 100-01-2019
{{استشهاد}}: تحقق من التاريخ في:|تاريخ أرشيف=(help) - ^ "Cobalt" (PDF) (بالإنجليزية). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53. Archived from the original on 14 -01-2019.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ أرشيف=(help) - ^ [a] "Cobalt to be declared a strategic mineral in Congo". Reuters (بالإنجليزية). 14 Mar 2018. Archived from the original on 2022-03-10. Retrieved 2023-06-12.
[b] "Congo's Kabila signs into law new mining code". Reuters (بالإنجليزية). 9 Mar 2018. Archived from the original on 2023-04-06. Retrieved 2023-06-12.
- ^ Henry Sanderson (14 Mar 2017). "Cobalt's meteoric rise at risk from Congo's Katanga" (بالإنجليزية). Financial Times. Archived from the original on 2022-03-05.
- ^ "The [Ivanhoe] pullback investors have been waiting for". Mining Journal (بالإنجليزية). 2 Feb 2018. Archived from the original on 2022-03-17. Retrieved 2023-06-12.
- ^ "African Mineral Production" (PDF) (بالإنجليزية). British Geological Survey. Archived from the original (PDF) on 2019-04-02. Retrieved 2009-06-06.
- ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (28 Feb 2018). "Perspective - The hidden costs of cobalt mining". Washington Post (بالإنجليزية). ISSN:0190-8286. Archived from the original on 2019-04-10. Retrieved 2018-03-07.
- ^ "Glencore closes Mutanda mine, 20% of global cobalt supply comes offline" (بالإنجليزية). Benchmark Mineral Intelligence. 28 Nov 2019. Archived from the original on 2022-03-05.
- ^ "CAMEC – The Cobalt Champion" (PDF) (بالإنجليزية). International Mining. Jul 2008. Archived from the original (PDF) on 2016-03-03. Retrieved 2011-11-18.
- ^ أ ب Frankel, Todd C. (30 Sep 2016). "Cobalt mining for lithium ion batteries has a high human cost". The Washington Post (بالإنجليزية). Archived from the original on 2019-04-17. Retrieved 2016-10-18.
- ^ Todd C. Frankel (30 Sep 2016). "THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers' phones and laptops" (بالإنجليزية). Washington Post. Archived from the original on 2019-04-17.
- ^ Crawford, Alex (7 Sep 2018). "Meet Dorsen, 8, who mines cobalt to make your smartphone work". Sky News UK (بالإنجليزية). Archived from the original on 2023-03-15. Retrieved 2023-06-13.
- ^ "Child labour behind smart phone and electric car batteries". Amnesty International (بالإنجليزية). 19 Jan 2016. Archived from the original on 2018-09-21. Retrieved 2018-01-07.
- ^ [a] Reisinger, Don. (3 Mar 2017). "Apple to Make Supplier Policy Change" (بالإنجليزية). Fortune. Archived from the original on 2022-03-05. Retrieved 2023-06-13.
[b] Frankel, Todd C. (3 Mar 2017). "Apple cracks down further on cobalt supplier in Congo as child labor persists" (بالإنجليزية). The Washington Post. Archived from the original on 2021-02-02. Retrieved 2023-06-13.
- ^ Audit Report on Congo Dongfang International Mining sarl (PDF) (Report) (بالإنجليزية). LG Chem. 23 May 2018. Archived from the original (PDF) on 2021-08-29.
- ^ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys (بالإنجليزية). ASM International. p. 347. ISBN:0-87170-685-7. Archived from the original on 2021-08-16.
- ^ أ ب ت Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF) (بالإنجليزية). United States Geological Survey. Archived from the original (PDF) on 2019-01-10. Retrieved 2008-10-26.
- ^ أ ب ت Shedd, Kim B. "Commodity Report 2008: Cobalt" (بالإنجليزية). United States Geological Survey. Archived from the original (PDF) on 2022-03-06. Retrieved 2008-10-26.
- ^ [a] Murray W. Hitzma; Arthur A. Bookstrom; John F. Slack; Michael L. Zientek (2017). Cobalt—Styles of Deposits and the Search for Primary Deposits (PDF) (Report) (بالإنجليزية). USGS. Archived from the original (PDF) on 2021-08-14. Retrieved 2023-06-14.
[b] Frik Els (17 Jul 2020). "Cobalt price: BMW avoids the Congo conundrum – for now" (بالإنجليزية). Archived from the original on 2022-03-06. Retrieved 2023-06-14.
- ^ أ ب ت Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A (بالإنجليزية), vol. 729, pp. 3–128, Bibcode:2003NuPhA.729....3A, DOI:10.1016/j.nuclphysa.2003.11.001, Archived from the original on 2017-08-09
- ^ L. E. Diaz. "Cobalt-57: Uses". JPNM Physics Isotopes (بالإنجليزية). University of Harvard. Archived from the original on 2000-10-31. Retrieved 2010-09-13.
- ^ Enghag, Per (2004). "Cobalt". Encyclopedia of the elements: technical data, history, processing, applications (بالإنجليزية). p. 667. ISBN:978-3-527-30666-4.
- ^ Murthy, V. S. R (2003). "Magnetic Properties of Materials". Structure And Properties Of Engineering Materials (بالإنجليزية). p. 381. ISBN:978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (1 May 2008). Electromagnetic Shielding (بالإنجليزية). p. 27. ISBN:978-0-470-05536-6. Archived from the original on 2022-02-16.
- ^ [a] Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). "Surface structures of the two allotropic phases of cobalt". Physical Review B (بالإنجليزية). 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. DOI:10.1103/PhysRevB.17.1510.
[b] "Properties and Facts for Cobalt" (بالإنجليزية). American Elements. Archived from the original on 2008-10-02. Retrieved 2008-09-19.
[c] Cobalt, Centre d'Information du Cobalt, Brussels (1966). Cobalt (بالإنجليزية). p. 45. Archived from the original on 2022-03-10.{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (بالإنجليزية) (3rd ed.). Prentice Hall. p. 722. ISBN:978-0-13-175553-6.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide (بالإنجليزية) (2 ed.). Greenwood Publishing Group. p. 107. ISBN:0-313-33438-2. Archived from the original on 2022-07-12.
- ^ أ ب D. Nicholls (1973). The Chemistry of Iron, Cobalt and Nickel: Comprehensive Inorganic Chemistry (بالإنجليزية). Pergamon. p. 1070-1072. DOI:10.1016/C2013-0-02680-1. ISBN:978-1-4831-4643-0. OCLC:881849460.
- ^ E. Romero; M. E. Mendoza; R. Escudero (2011). "Weak ferromagnetism in cobalt oxalate crystals". physica status solidi (بالإنجليزية). John Wiley & Sons. 248 (6): 1519–1525. DOI:10.1002/pssb.201046402. Archived from the original on 2023-05-30.
- ^ Matthias Bohnet (2003). Ullmann's Encyclopedia of Industrial Chemistry (بالإنجليزية) (6 ed.). Weinheim: John Wiley & Sons. p. 785. ISBN:3-527-30385-5. OCLC:55738480.
- ^ أ ب ت ث Thomas P. McCutcheon; William J. Schuele (1953). "Complex Acids of Cobalt and Chromium. The Green Carbonatocobalt(III) Anion". Journal of American Chemical Society (بالإنجليزية). 75 (8): 1845–1846. DOI:10.1021/ja01104a019. Archived from the original on 2023-05-30.
- ^ Bauer, H.; Drinkard, W. (1960). "A General Synthesis of Cobalt(III) Complexes; A New Intermediate, Na3[Co(CO3)3]·3H2O". Journal of American Chemical Society (بالإنجليزية). 82 (19): 5031–5032. DOI:10.1021/ja01504a004. Archived from the original on 2022-10-07.
- ^ Tafesse, Fikru; Aphane, Elias; Mongadi, Elizabeth (2009). "Determination of the structural formula of sodium tris-carbonatocobaltate(III), Na3[Co(CO3)3]·3H2O by thermogravimetry". Journal of Thermal Analysis and Calorimetry (بالإنجليزية). 102 (1): 91-97. DOI:10.1007/s10973-009-0606-2. Archived from the original on 2022-10-07.
- ^ Gispert, Joan Ribas (2008). "Early Theories of Coordination Chemistry". Coordination chemistry (بالإنجليزية). pp. 31–33. ISBN:978-3-527-31802-5. Archived from the original on 2016-05-05. Retrieved 2015-06-27.
- ^ James E. House (2008). Inorganic chemistry (بالإنجليزية). Academic Press. pp. 767–. ISBN:978-0-12-356786-4. Archived from the original on 2022-03-16. Retrieved 2011-05-16.


![{\displaystyle \mathrm {2\ CoCl_{2}+2\ NH_{4}Cl+10\ NH_{3}+1/2\ O_{2}\longrightarrow 2\ [Co(NH_{3})_{6}]Cl_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3bb13aee50b91f22617e0736f7f43095f3ff87cb)
![{\displaystyle \mathrm {2\ CoCl_{2}+2\ NH_{4}Cl+8\ NH_{3}+1/2\ O_{2}\longrightarrow 2\ [Co(H_{2}O)(NH_{3})_{5}]Cl_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/462adb052c102f0fd32915f78463b3ab8c0b6687)
![{\displaystyle \mathrm {CoSO_{4}+6\ NH_{3}\longrightarrow [Co(NH_{3})_{6}]SO_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c97ce856150ed5f62d7f11315245510a7d32a645)
